猪圆环病毒2型的分离鉴定及全基因组克隆和序列分析
王 赟,梅 淼,杨 雪,朱 玲
(四川农业大学动物生物技术中心,四川 雅安 625014)
猪圆环病毒2型(Porcine circovirus type 2,PCV-2)作为断奶仔猪多系统衰弱综合征(PMWS)的主要病原体,已被世界各国的学者所认同[1]。PMWS发生自1991年在加拿大被首次报道后,美国、法国、西班牙、德国、日本都进行了报道,在北美和欧洲的猪群中,发病率占被侵袭猪群的5%~50%,病死率达到50%~100%[2-3]。病原学和血清学调查证实,PCV-2呈世界性分布[4]。根据致病性、抗原性和核苷酸序列,PCV可分为PCV-1和PCV-2两个血清型,PCV-1无致病性,PCV-2有致病性。国内外研究表明,PCV-1基因胞为1759bp,PCV-2则有1767bp和1768bp两种[5]。PCV-2毒株间核苷酸序列的相似性大于96%,PCV-2与PCV-1的相似性小于80%。世界各地的PCV-2分离株的核苷酸序列具有很高的同源性,但在不同地域间病毒基因组序列仍存在变异,这种差异可能与PCV-2的感染特性有关[6]。该病的主要症状为渐进性消瘦,呼吸困难及黄疸,剖检可见淋巴组织退化,间质性肺炎,肝炎及肾炎。除了能引起PMWS之外,PCV-2还与猪的几种新出现传染病的发生密切相关,包括猪呼吸道病综合征(PRDC)及猪增生性和坏死性肺炎(PNP)、新生仔猪的先天性震颤(CT)和新生仔猪的腹泻病等[7]。2000年郎洪武等[8]首次报道中国猪群存在PCV-2感染,感染率为42.9%。而2007年周绪斌等[8]报道在2000年-2005年期间20多个省市PCV-2感染平均阳性率达55.04%。如今PCV-2及其所致的相关疾病引起了兽医界的高度重视,成为当前研究的热点。
本试验从所采典型PMWS病料中分离鉴定出PCV-2,并对PCV-2全基因组的扩增、克隆和序列分析,并与GenBank中的PCV-2参考毒株进行同源性比较,以期为四川省PCV-2的流行病学研究、诊断与防控、基因组学的完善,及其进一步阐明其致病机理提供依据。
1 材料与方法
1.1 材料
1.1.1 病料 选疑似典型断奶仔猪多系统衰竭综合征的病例的肺脏、脾脏、淋巴结等组织,病料采集自四川某规模化猪场,置-20℃保存备用。
1.1.2 细胞、质粒、菌种 PK-15细胞购自武汉病毒所细胞保管中心(经PCV-1及PCV-2检测为阴性),限制性内切酶 BamHⅠ、HindⅢ、pMD18-T Simple载体(宝生物工程大连有限公司),DH5α宿主菌,四川农业大学动物生物技术中心保存。
1.1.3 引物设计 采用Fenaux M 等[10]所设计用于扩增PCV-2全基因组为1767bp或1768bp的特异引物序列,扩增四川省PCV-2毒株的全基因组,并在上下游引物中引入BamHⅠ、HindⅢ酶切位点,引物由上海英骏生物技术有限公司合成。引物 序 列 为 P1,5′-GAAGGATCCCTGGCTAACTTTGAAAGT-3′;P2,5′-GCAAAGCTTAATTCTGACAACGTTACA-3′。
1.2 方法
1.2.1 病料的PCR扩增 将采集的肺脏、脾脏、淋巴结等病料,剪成小块,移入匀浆器内,按1∶10(W/V)加入PBS液将其研磨成匀浆,转移至离心管中,反复冻融3次。按常规的酚/氯仿法提取病毒基因组DNA,并以提取的目的DNA为模板进行如下PCR扩增:50μL反应体系(5μL10×bufffer、3μL 25mmol/L MgCl2、1μL 10mmol/L dNTPs、20 μmol/L P1和P2各1.0μL、Taq酶0.5μL、模板3 μL、超纯水补足50μL),于94℃变性5min,然后进行30个循环(94℃1min,56℃1min,72℃30s),最后72℃延伸10min。用10g/L琼脂糖凝胶电泳,在紫外灯下观察电泳图谱,拍照记录结果。
1.2.2 PK-15细胞PCV-1、PCV-2污染测定 取出1mL经胰酶消化完全的单层PK-15细胞悬液,反复冻融3次,让细胞充分破裂,完全释放出病毒粒子。12000r/min 4℃离心5min,取上清液备用。按照1.2.1的PCR反应体系来检测PK-15细胞是否含有PCV-1、PCV-2核酸污染,选择检测结果为阴性的单层细胞备用。
1.2.3 病毒的分离 用无菌PBS液将经1.2.1检测为PCV-2阳性的相对应的肺脏、脾脏、淋巴结等病料研磨制成1∶5(病料与PBS液体积比)的悬液,反复冻融3次,4000r/min离心30min,取上清过0.22μm滤器除菌,加入青霉素1000单位/mL,链霉素1000μg/mL,4℃作用6h,保存备用。取上述处理好的组织样品1mL,接种按常规方法消化制备致密PK-l5细胞单层,同时设不接种病毒的PK-15细胞作空白对照,37℃吸附作用1h,加入适量含20 mL/L小牛血清的维持营养液,37℃培养72h。将培养物反复冻融3次,3000r/min离心10min,收获上清。用上一代细胞病毒液再接种细胞连续盲传15代后收获病毒。
1.2.4 荧光抗体染色法检测 将已收获的病毒接种长有致密单层的PK-15细胞[11],按荧光抗体染色法检测的标准步骤制备样品,最后经超纯水冲洗,冷风吹干,以0.5mol/L pH9.5的碳酸盐缓冲甘油封固盖片,镜检,观察有无特异性荧光。
1.2.5 分离株的鉴定及全基因组的克隆 取出已经长成单层的接有病毒的PK-15细胞反复冻融3次,让细胞充分破裂,释放出病毒。在4℃以12000 r/min离心5min,取上清液,按照以上PCR反应体系检测,如果电泳结果为阳性则用PCR回收试剂盒回收特异的扩增片段。将回收的基因片段与克隆载体pMD18-T Simple连接,转化感受态细胞。重组质粒用BamHⅠ和HindⅢ进行双酶切鉴定,产物用10g/L琼脂糖凝胶电泳鉴定。
1.2.6 序列测定与全序列进化分析 对经酶切鉴定为阳性的重组质粒送往上海英俊生物有限公司测序。然后利用DNA Star软件分析所得PCV-2的基因组序列并与Gen Bank中公布的其他国内外毒株进行序列比较分析和进化树分析。
2 结果
2.1 病毒的分离
病毒在接种PK-15细胞后的间接免疫荧光方法检测结果显示:感染病毒的阳性细胞呈现绿色荧光,病毒抗原主要集中在细胞核区,细胞质中也有许多抗原分布,病毒感染的阳性细胞呈散在分布;阴性对照细胞中未见荧光(图1)。
2.2 PCV-2全基因组扩增结果及重组质粒的酶切鉴定
应用合成的引物通过反向PCR扩增出长度约为1800bp的片段,与预期目的片段大小一致(图2)。重组质粒经双酶切鉴定,显示出长度约为2600 bp和1800bp的特异性片段,结果表明克隆成功(图3)。
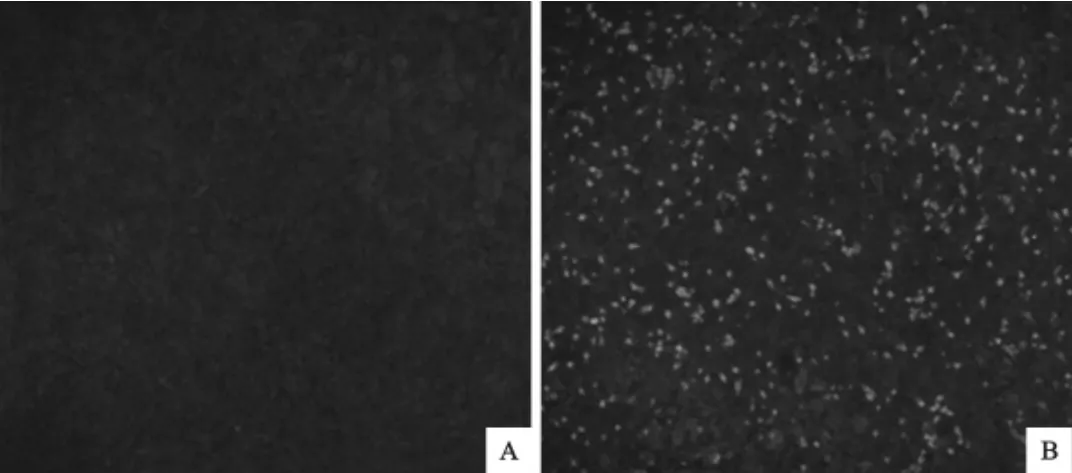
图1 间接免疫荧光鉴定PCV-2病毒粒子在PK-15细胞中的增殖Fig.1 Immunofluorescence identification of infection on PK-15cells infected with PCV-2
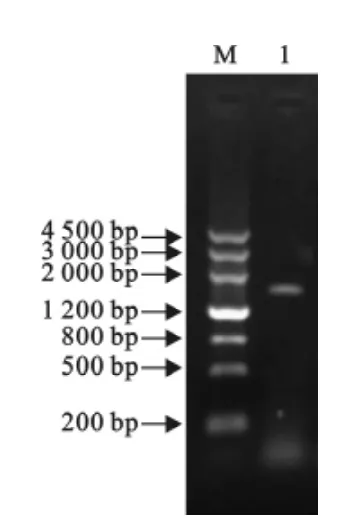
图2 PCR扩增结果Fig.2 The results of PCR amplication
2.3 序列测定与分析
阳性重组质粒经上海英俊生物有限公司测序,去除酶切位点及保护性碱基,得到长为1767bp的外源片段,该片段与预期结果完全相符(图3)。通过BLAST与GenBank中来自加拿大、新西兰及中国其他部分的PCV-2毒株进行相似性比较分析,结果与13个毒株间的相似性介于95.2%~99.5%(图4)。该结果表明从所采病料中成功分离了PCV-2四川株。PCV2-SC分离株与山东株(AY556473)亲缘关系最近,相似性高达99.7%;与日本株(AY424401)亲缘关系最远,相似性只有94.8%。根据比较结果绘制系统进化树(图5),可以看出澳大利亚株(AY424401)构成了一个独立的分支,PCV2-SC株分离株与山东株共同组成一组微小分支,且这两株与加拿大株、新西兰株和中国的其他分离株构成了另外一个大的分支。总体看来,由于地域原因,国内毒株同源性均较高,且与国外毒株新西兰株同源性较近。
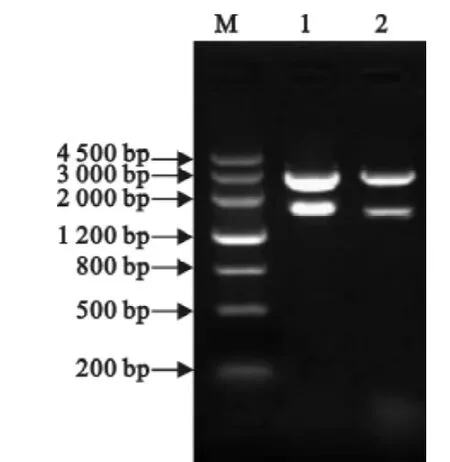
图3 重组质粒的酶切鉴定Fig.3 Identification of recombinant plasmid by enzyme digestion
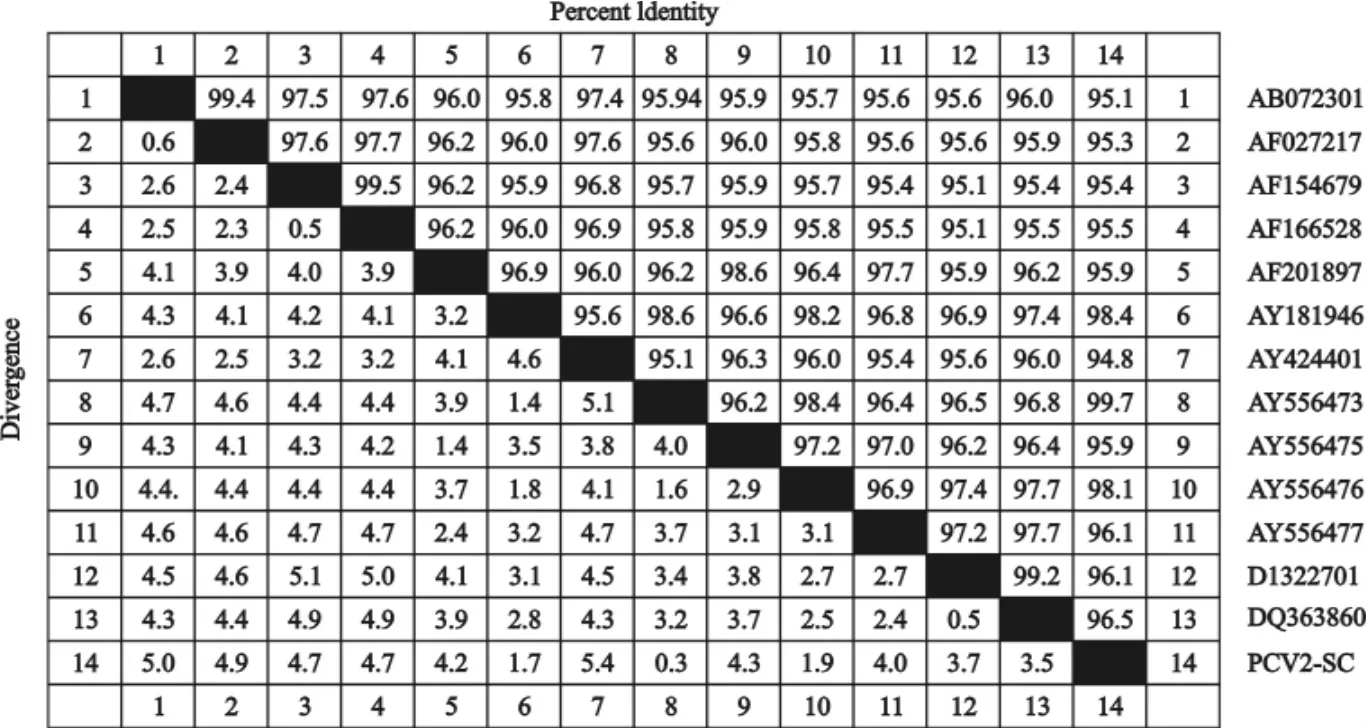
图4 PCV-2(SC)与其它PCV-2毒株的相似性比较Fig.4 Similarity comparison of the full genome sequence of PCV-2(SC)strain with other PCV-2isolates
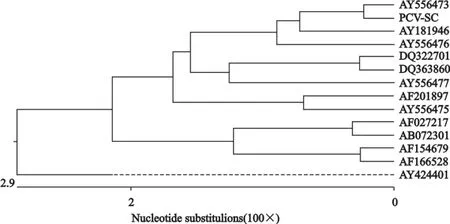
图5 PCV-2-SC全基因组系统发育进化树结构图Fig.5 Phylogenetic tree based on complete genome sequence of PCV-2-SC strain
3 讨论
PMWS是近10多年来出现的影响世界养猪业的重要传染病之一,PCV-2是引起该病的主要病原,但不是惟一病原,PCV-2单独感染可出现轻微的病变[12]。临床上出现的PMWS病例多为PCV-2、猪细小病毒(PPV)及猪繁殖与呼吸综合征病毒(PRRSV)的混合感染,尤其是最近几年暴发的猪高致病性蓝耳病(即高致病性猪繁殖与呼吸综合征),更是伴随有 PCV-2 的感染[13-14]。在对 PCV-2进行分离鉴定时考虑了两个问题,即克服PCV-1的干扰和检测方法的准确性。在试验中选择经能区分PCV-1和PCV-2的PCR特异引物检测PK-15细胞是否含有PCV-1和PCV-2污染,检测结果为阴性后。间接免疫荧光试验检测经接种PCV-2-SC株的PK15细胞,盲传培养15代次后获得了满意结果。
在设计引物时通过反复比较PCV-1和PCV-2的序列差异,选择在PCV-1和PCV-2毒株间变异较大,相对于PCV-2毒株间保守性较高的区域,设计出针对PCV-2的特异性引物P1,P2一次性扩增获得了1800bp左右的目的片段。既克服了病毒细胞培养过程可能引入的污染,又避免了因病毒对细胞的适应性而进行的多次反复传代,同时一次扩增克隆PCV-2全基因组还减少了分段扩增克降所需的多次基因操作。PCR反应扩增克隆测定PCV-2-SC株序列,与GenBank中的13株参考序列进行比较分析发现,相似性介于95.2%~99.5%。PCV-2-SC分离株与本次比较的山东株(AY556473)亲缘关系最近,相似性高达99.7%;与日本株(AY424401)相似性只有94.8%。但总体来说,不同分离株之间核苷酸水平的变异性比较小,各PCV-2分离株基因组之间总体上比较保守。但也存在着变异,变异的发生与地理位置和种猪来源不同有某种程度上的相关性。尹业师等[15]曾对2005年12月31日前GenBank中的253条PCV-2序列进行同源性比较和遗传进化分析,发现在核苷酸水平上PCV-分为两个亚型,其中亚型1是以分离自美国、加拿大、澳大利亚的毒株为代表,亚型2是以分离自法国和新西兰的毒株为代表。本研究所分离的PCV-2序列与新西兰代表株在同一分支,而与日本,加拿大和澳大利亚株不在同一分支,这说明本研究所得的流行毒株与新西兰代表株亲缘关系较近。本文的进化树分析表明国内外的毒株均形成了几个小的分支,表明不同地区的PCV-2分离株在基因组序列上存在一定的变异,可能存在地域上的相关性。
本研究是从一批典型PMWS的住群众分离到的,且全基因组的与GenBank上已提交的序列相似性分析显示,该毒株并不与国内外已分离的任何一株序列完全相同,因此可认为该毒株的分离鉴定具有地方的代表性。本研究成功分离到了PCV-2四川分离株,为进一步从分子水平研究PCV-2在四川省的流行、变异规律以及主要结构基因的特性等提供了参考数据,也为PCV-2的诊断及预防奠定了良好基础。
[1]柴少征,闫若潜,王东方,等.猪圆环病毒研究进展 [J].畜禽业,2009(7):34-36.
[2]Mankertz A,Domingo M,Folch J M,et al.Characterisation of PCV-2isolates from Spain,Germany and France[J].Virus Res,2000,66(1):65-77.
[3]Onuki A,Abe K,Togashi K,et al.Detection of porcine circovirus from lesions of a pig with wasting disease in Japan[J].J Vet Med Sci Soci,1999,61(10):1119-1130.
[4]Liu Q,Wang L,Willson P,et al.Seroprevalence of porcine circovirus type 2in swine populations in Canada and Costa Rica[J].Can J Vet Res,2002,66(4):225-231.
[5]Mankertz A,Hillenbrand B.Analysis of transcription of porcine circovirus type 1[J].J Gene Virol,2002,83(11):2743-2751.
[6]Allan G M,Mcneilly F,Ellis J,et al.PMWS:experimental model and co-infections[J].Vet Microbiol,2004,98(2):165-168.
[7]Stevenson G W,Kiupel M,Mittal S K,et al.Tissue distribution and genetic typing of porcine circoviruses in pigs with naturally occurring congenital tremors[J].J Vet Diagn Invest,2001,13(1):57-62.
[8]郎洪武,张广川,吴发权,等.断奶猪多系统衰弱综合征血清抗体检测 [J].中国兽医科技,2000(3):3-5.
[9]周绪斌,张馨玉,许秀梅.我国猪圆环病毒2型的流行情况和分析 [J].中国猪业,2007(5):37-41.
[10]Fenaux M,Halbur P,Haqshenas G,et al.Cloned genomic DNA of type 2porcine circovirus is infectious when injected directly into the liver and lymph nodes of pigs:characterization of clinical disease,virus distribution,and pathologic lesions[J].J Virol,2002,76(2):541-551.
[11]Zhu Y,Lau A,Lau J,et al.Enhanced replication of porcine circovirus type 2(PCV-2)in a homogeneous subpopulation of PK15cell line[J].Virology,2007,369(2):423-430.
[12]Opriessnig T,Madson D,Prickett J,et al.Effect of porcine circovirus type 2(PCV-2)vaccination on porcine reproductive and respiratory syndrome virus(PRRSV)and PCV-2coinfection[J].Vet Microbiol,2008,131(1-2):103-114.
[13]徐绍建,李 俊,曹 帅,等.猪圆环病毒2型全序列分析及感染性克隆的构建 [J].中国兽医杂志,2009(1):21-23.
[14]温永俊,吴国军,蔡雪辉,等.猪圆环病毒和猪繁殖与呼吸综合征病毒混合感染对仔猪致病性的评估 [J].中国预防兽医学报,2007(5):336-340,493.
[15]尹业师.9株猪圆环病毒Ⅱ型流行毒株全基因组克隆及序列分析 [J].广西农业生物科学,2007,26(2):31-32.

