六株传染性支气管炎病毒的生物学特性鉴定及遗传进化分析
龚 军,郑俏伟,王建华,杨 凤,汪招雄,廖 明,任 涛
(华南农业大学兽医学院 农业部动物疫病防控重点开放实验室广东省动物源性人畜共患病预防与控制重点实验室,广东 广州 510642)
鸡传染性支气管炎(Infectious bronchitis,IB)是鸡的一种急性、高度接触性、病毒性传染病,目前该病已呈世界范围流行,成为严重危害世界养禽业的重大传染病之一[1-2]。鸡传染性支气管炎的病原是传染性支气管炎病毒(Infectious bronchitis virus,IBV),该病毒属于冠状病毒科(Coronaviridae),为有囊膜的单股正链RNA病毒[1],其主要的功能蛋白为纤突(spike,S)蛋白、膜(membrane,M)蛋白和核衣壳(nucleocapsid,N)蛋白,S蛋白包括纤突蛋白1(spike1,S1)和纤突蛋白2(spike2,S2)两个亚单位,其中S1蛋白是主要识别蛋白,与病毒的致病性相关。IBV在血清学和致病力方面都存在着差异,已报道的IBV血清型有30多个,其中包括引起呼吸道症状的血清型和肾病变的血清型,腺胃型、肠型、混合型正在研究之中[3]。这些血清型之间没有或仅有部分交叉免疫性,同时由于新的血清型不断出现,给本病的诊断和防控带来很多困难[4-6]。本研究从华南地区分离了6株IBV,并对其生物学特性进行了鉴定,最后根据分离株S1基因序列,分析IBV的遗传进化,对鸡传染性支气管炎的防控有重要的意义。
1 材料与方法
1.1 材料
1.1.1 毒株及鸡胚 各广东分离株标号为GD-09II,GD-09III,GD-10I,GD-10II,GD-10III,GD-10IV,分离株背景见表1。
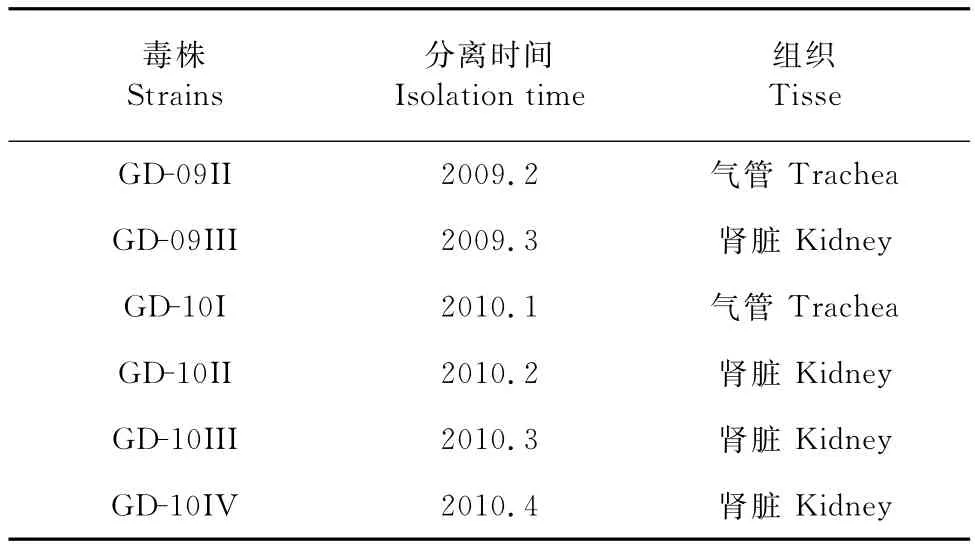
表1 分离株编号和背景Table1 Number and background of isolated strains
新城疫病毒(Newcastle disease virus,NDV)La Sota疫苗株为作者实验室保存毒株。
9日龄~11日龄无特定病原体(specific pathogen free,SPF)鸡胚购自广东永顺生物制品有限公司。
1.1.2 试剂 TRizol、M-MLV反转录酶、RNasin、dNTP,上海英潍捷基贸易有限公司产品;pMD18-T Vector、Premix Ex Taq,宝生物工程(大连)有限公司产品;胰酶、胎牛血清、M199培养基,Invitrogen公司产品。
1.2 方法
1.2.1 病毒的分离传代 将病料加入含有双抗(2000单位/mL)的灭菌生理盐水在研钵中充分研磨,并反复冻融3次,5000r/min离心15min,取上清,微孔滤膜过滤除菌后,尿囊腔接种10日龄的SPF鸡胚,每胚0.2mL,接种后置于37℃温箱孵育,弃去24h之内死胚,60h后收集尿囊液,继续尿囊腔接种10日龄的SPF鸡胚,如此盲传5代,每一代对收获的尿囊液做血凝(haemagglutination,HA)测定,并观察鸡胚病变。
1.2.2 鸡胚矮小化试验 将传代后的分离株尿囊液通过尿囊腔途径接种于9日龄~10日龄的SPF鸡胚,37℃孵育144h,观察胚体发育情况。
1.2.3 新城疫病毒干扰试验 取各IBV分离株传代后的尿囊液通过尿囊腔途径接种5枚10日龄SPF鸡胚,每胚0.2mL,接种后37℃孵育10h,然后各枚鸡胚同一部位复种NDV La Sota弱毒株0.2 mL,接种后继续孵育48h,收集尿囊液后逐胚测定其HA滴度。同时另设两个试验对照组(生理盐水及NDV La Sota株对照组),每组各5枚SPF鸡胚,其中生理盐水对照组每胚只接种生理盐水0.2mL,NDV La Sota株对照组只接种NDV La Sota株0.2 mL,于37℃孵育48h后收集尿囊液并逐胚测定其HA滴度。
1.2.4 血凝特性试验 取各分离株传代后的尿囊液毒以5000r/min离心15min后,取其上清,并分为2组,第1组经10g/L的胰蛋白酶处理,于37℃水浴3h;第2组不用胰酶处理作为空白对照。测定两组红细胞凝集价。
1.2.5 鸡胚气管环感染试验 鸡胚气管环(ex vivo tracheal organ cultures,TOCs)感染试验参照吴延功的方法[7],无菌取出18日龄~20日龄的SPF鸡胚胚体于灭菌的平皿中,剪开颈部,用无菌的镊子和眼科剪取出气管置于另一灭菌平皿中,小心剥离气管周围的结缔组织和脂肪,在含有200单位/mL双抗的Hank’s液中清洗,用枪头轻轻吹打数次,以清除气管环中的分泌物,用镊子夹住气管的一头,用眼科剪从另一头将气管剪成0.5mm~1mm的气管环,弃掉镊子夹过的部位,将剪好的气管环置于不含血清的M199培养基中清洗,挑选合适厚度的气管环置于24孔细胞培养板中,每孔1环,并加入1mL含20mL/L~30mL/L胎牛血清的M199培养液,置体积分数为5%CO2的37℃培养箱中培养24h,在倒置显微镜下观察,以气管环内上皮细胞完整和纤毛运动活泼作为用于试验的判定指标。用含20 mL/L~30mL/L胎牛血清的M199培养液将传代后的各分离株尿囊液稀释10倍,放入培养24h后合格的气管环,体积分数为5%CO2的37℃培养箱中感作1h后,倾去病毒稀释液,加入含20mL/L~30mL/L胎牛血清的M199培养液2mL,继续培养144h,每天观察并记录气管环活性及纤毛运动情况。
日粮中的蛋白质含量过多或过少均会影响到骨骼发育,然而有学者指出,日粮蛋白水平对体尺的影响不显著[3,12]。邱忠玉等[13]的研究也表明,12%~13%低蛋白日粮对蛋鸡育成期胫长发育无显著影响(P>0.05);郝文博等[14]研究蛋白水平同样对雏鸡胫长无显著影响(P>0.05)。这与本研究结果一致,本研究设定的四种日粮蛋白质水平对京红1号蛋种鸡育成期胫长影响均无显著差异(P>0.05),另外,随日粮蛋白质水平的增加对死淘率无显著差异(P>0.05),表明设定的四种日粮蛋白质水平梯度并未达到能够显著影响胫长和成活率的水平。
1.2.6 S1基因的克隆及测序 参照GenBank中已发表的IBV S1基因序列及8株IBV毒株(Beaudette、Mass41、Cal99、BJ、KQ6、GD/S14/2003、SAIBK、LX4)的全基因组序列,利用DNA Star 7.1软件进行同源性分析,应用Primer Premier 5.0软件设计特异引物,引物由上海英潍捷基有限公司合成:
S1-F:5′-TTGAAAACTGAACAAAAGACCG-3′(22bp)
S1-R:5′-TACAAAACCTGCCATAACTAACAT-3′(24bp)
RNA抽提参照宝生物工程(大连)有限公司的Trizol试剂说明书进行。RT反应体系按Invitrogen公司提供的M-MLV反转录酶的使用方法操作。50 μL PCR反应体系如下:Premix Ex Taq 25μL;上、下游引物(20pmol/μL)各0.5μL;反转录产物4 μL;无菌三蒸水20μL。循环参数为95℃3min,94℃30s,52℃30s,72℃2min,30个循环,最后72℃延伸7min。PCR产物用10g/L琼脂糖凝胶进行电泳检测分析。用宝生物工程(大连)有限公司的胶回收试剂盒对琼脂糖凝胶目的条带进行回收纯化,回收纯化后产物与pMD18-T载体16℃过夜连接,连接产物转化至DH5α感受态细胞,经鉴定的阳性重组质粒送上海英骏生物技术有限公司进行序列测定。
1.2.7 S1基因序列分析 运用 DNA Star 7.1、MEGA4等分子生物学分析软件,将本研究的6株IBV分离毒株和GenBank中登录的常用疫苗株和近年来国内的主要基因型株及国际上其他血清型的部分代表参考株(表2)的S1基因的核苷酸序列进行比对、绘制进化树和遗传进化分析。
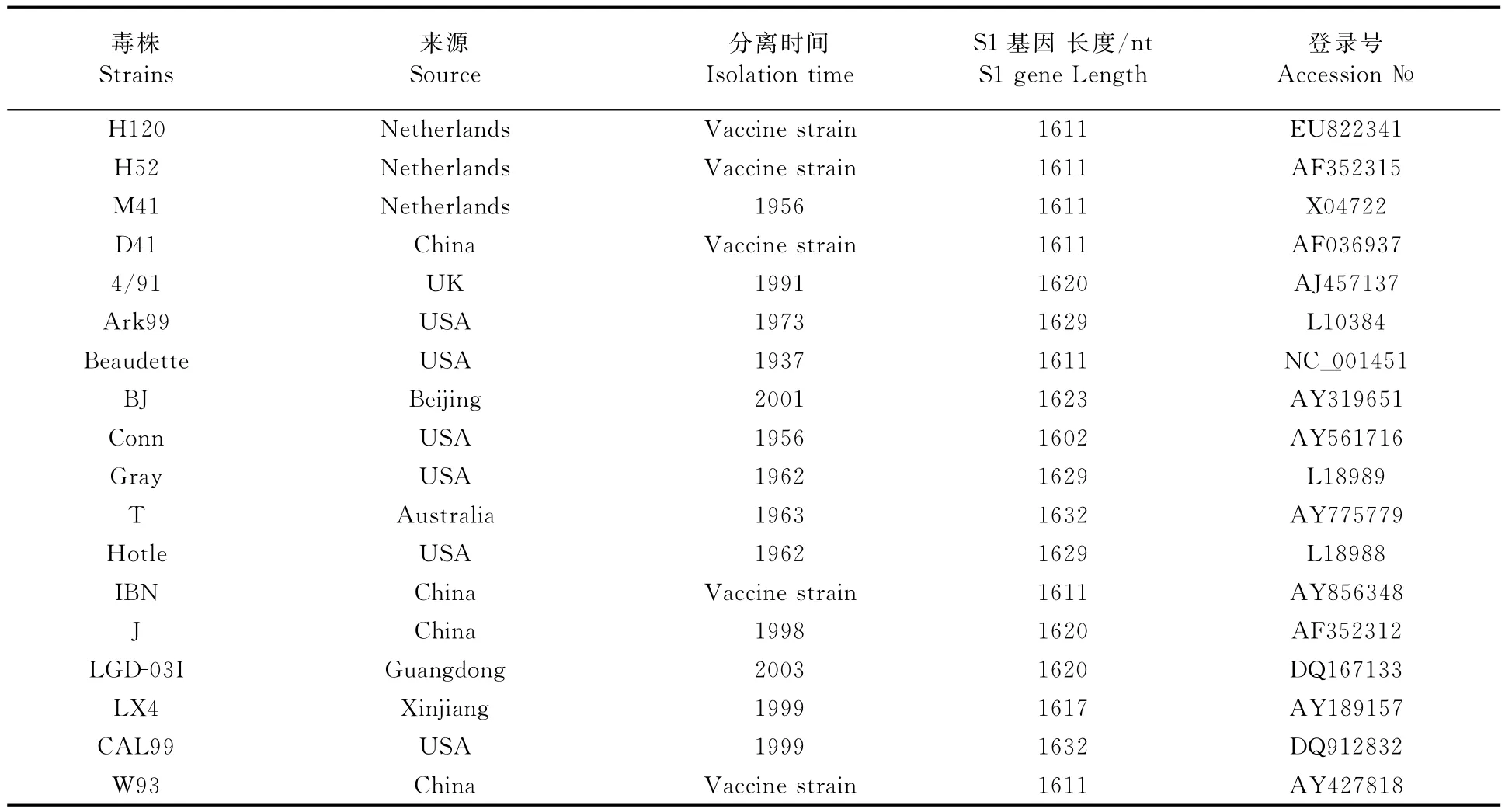
表2 IBV参考株背景信息及其登录号Table2 Background and GenBank accession numbers of IBV reference strains
2 结果
2.1 鸡胚矮小化试验
尿囊腔接种各分离株的鸡胚胚体病变明显,尿囊膜增厚,紧裹胚体、胚体不同程度充血、尿囊液增多,鸡胚发育受阻、爪趾变形抱紧头部、胚体卷曲成球形,呈现典型的侏儒胚(图1)。

图1 鸡胚矮小化试验Fig.1 Virus pathological lesions to chicken embryo
2.2 新城疫病毒干扰试验
NDV La Sota株对照组鸡胚尿囊液HA滴度均高于1∶29,生理盐水对照组无血凝性,6株分离株鸡胚尿囊液的HA滴度均小,1∶26,远小于NDV La Sota株试验组HA平均滴度,说明这6株分离株均对NDV的增殖产生明显的干扰作用。
2.3 血凝特性试验
未经胰酶处理的各分离株鸡胚尿囊液,对鸡红细胞无凝集作用;经10g/L胰酶处理的鸡胚尿囊液,对鸡红细胞的凝集价在1∶25~1∶27之间。
2.4 鸡胚气管环感染试验
正常气管环轮廓清晰,管壁略显透明,腔内无杂质,内壁上皮细胞完整,纤毛摆动活跃;攻毒后的气管环出现明显的病变,轮廓模糊,管壁颜色加深,腔内污浊,充满脱落的的上皮细胞和气泡,纤毛停止摆动(图2)。
2.5 S1基因的遗传进化分析
利用设计的引物进行RT-PCR,成功扩增出6株IBV分离株的S1基因,琼脂糖凝胶电泳在1620 bp左右有明显的亮带(图3)。
根据IBV分离株和参考株的S1基因的核苷酸序列构建的遗传进化树(图4)。遗传进化树显示,6株IBV分离株和18株参考株的S1基因整体分为两个大群。其中包括大部分疫苗株在内的16参考株和1株分离株GD-09Ⅱ位于第一大群;而5株分离株和LX4、LGD-03I位于第二大群,其中5株分离株与LX4株的关系最近。这6株IBV于近两年分离自广东不同地区,其中5株与Mass基因型亲缘关系较远,目前国内使用的主要是 Mass型的H52和H120疫苗,这些疫苗的使用导致免疫失败或免疫效果不理想,与目前流行的IBV的基因型不无关系。

图2 鸡胚气管环感染试验Fig.2 Infection of TOCs
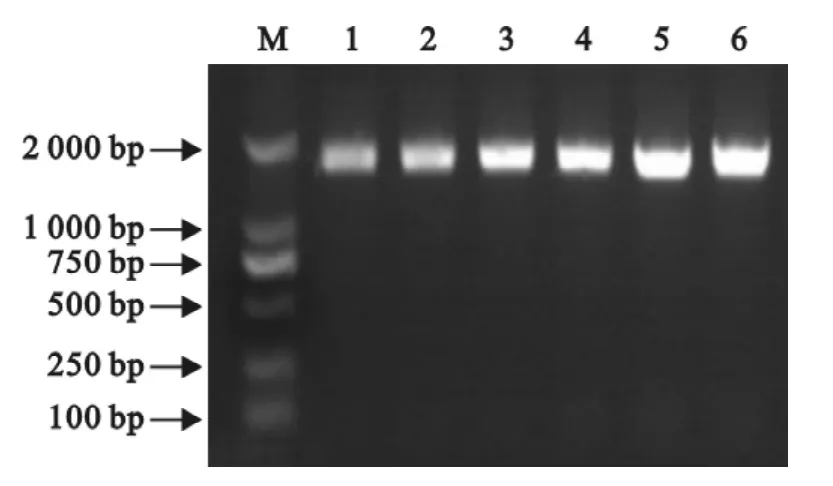
图3 IBV分离株的S1基因PCR产物电泳图Fig.3 Electrophdresis ofPCR products of S1gene of IBV isolates
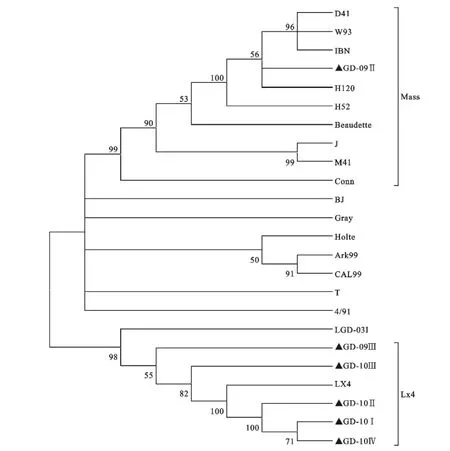
图4 根据S1基因绘制的遗传进化树Fig.4 Phylogenetic tree based on the sequence of the S1gene of the IBV isolates
3 讨论
IBV的S1基因是主要免疫原基因,其蛋白可诱导HI抗体及病毒中和抗体的产生,血清型特异抗体也主要由其诱导产生。IBV的变异主要体现在S蛋白,而S1蛋白是IBV基因组中最易发生变异的部位,S1基因的点突变、插入和缺失是造成IBV毒株变异的主要原因之一,并且S1基因重要抗原位点的变异可引起IBV新血清型的不断出现,导致了IBV的复杂的血清型。所以,对IBV的分子流行病学研究大都集中在S1基因上。
弱毒疫苗和灭活疫苗的广泛使用,使得IB得到有效的控制,但是,仍有肾型传支不断出现[6]。我国主要使用Mass血清型的H120和H52弱毒疫苗株,有些鸡群也使用嗜肾型毒株制备的灭活疫苗[8-12]。一些经过 Mass型疫苗免疫接种的鸡群持续地出现IB的暴发,导致免疫鸡群出现发病和品质下降等问题。近年来通过对中国免疫鸡群中分离到的IBV毒株的研究显示,免疫鸡群中IBV毒株的进化产生的变异株使得疫苗免疫保护效果显著下降。
本研究对2009年和2010年分离自广东地区的6株IBV进行生物学特性研究,并成功扩增出S1基因,根据GenBank中登录的参考株,绘制了S1基因遗传进化树。结果显示,6株分离株中的大部分不与疫苗株位于同一大群,而国内目前使用的疫苗为H52和H120弱毒疫苗,疫苗株和流行株的差异可能是导致免疫效果不理想的主要原因,因此,目前国内急需寻找开发一种针对中国基因型的免疫保护效果较好的疫苗株。
[1]卡尔尼克B W.禽病学[M].10版.高 福,苏敬良,译.北京:中国农业出版社,1999:653-665.
[2]殷 震,刘景华.动物病毒学[M].2版.北京:科学技术出版社,1997:675-680.
[3]Cavanagh D,Naqis A.Infectious Bronchitis[M]//Calnek B W (Ed).Diseases of Poultry.11thed.Ames,IA:Iowa StateUniversity Press,2003:101-119.
[4]杨杰华,刁有祥,于申业,等.鸡传染性支气管炎病毒变异株的分离及其S1基因序列分析[J].中国病毒学,2005,20(3):283-287.
[5]陈 峰,吴孔兴,张 齐,等.5株传染性支气管炎病毒分离株的鉴定和血清分型[J].华南农业大学学报,2005,26(4):92-95.
[6]Jackwood M W,Hilt D A,Williams S M,et al.Molecular and serologic characterization,pathogenicity,and protection studies with infectious bronchitis virus field isolates from California[J].Avian Dis,2007,51(2):527-533.
[7]吴延功.应用气管环组织培养鉴定肾型传染性支气管炎病毒[J].中国兽医杂志,1996(4):16-18.
[8]Wang H N,Wu Q Z,Huan G Y,et al.Isolation and identification of infectious bronchitis virus from chickens in Sichuan,China[J].Avian Dis,1997,41(2):279-282.
[9]任 涛,廖 明,罗开健,等.鸡传染性支气管炎病毒中国地方流行株的分离与鉴定[J].畜牧兽医学报,2002,33(4):362-365.
[10]Wu Z Q,Yang Q W,Fu C,et al.Antigenic and immunogenic characterization of infectious bronchitis virus strains isolated in China between 1986and 1995 [J].Avian Pathol,1998,27(6):578-585.
[11]Liu S G,Kong X G.A new genotype of nephropathogenic infectious bronchitis virus circulating in vaccinated and nonvaccinated flocks in China[J].Avian Pathol,2004,33(3):321-327.
[12]周继勇,沈行燕,程丽琴,等.新变异的禽传染性支气管炎病毒ZJ971毒株S基因克隆及序列分析[J].中国农业科学,2001,34(4):4452450.

