多孔二氧化硅纳米颗粒在药物释放领域中的应用进展
张瑞锐,史建国,丁 露,李雪梅,渠凤丽*
(1.曲阜师范大学化学化工学院,山东省生命有机分析重点实验室,山东曲阜273165)
(2.山东省科学院生物所,山东省生物传感器重点实验室,山东济南250014)
0 引言
多功能纳米结构不仅具有功能调控的作用,同时它的功能集成和空间局限效应使其在诸多领域上表现出卓尔不群的独特魅力。随着多孔二氧化硅尺寸、形貌以及孔径的可控制备的发展,多孔二氧化硅以其独特的结构特点及良好的生物相容性、环境稳定性、透光性、抗微生物腐蚀等优点引起了广泛关注,成为多功能纳米材料的研究热点之一。大量研究工作证明了多孔二氧化硅在吸附、催化、传感以及分离等诸多领域有着巨大的应用潜力[1~3]。近年来,多孔二氧化硅应用在生物医学方面特别是在药物载体上的研究逐渐成为新的热点[4~10],该文着重对多孔二氧化硅纳米颗粒在药物/基因输送的研究进行综述,并同时对这一研究领域的发展趋势进行展望。
1 多孔二氧化硅纳米颗粒的特点
自1992年首次报道MCM-41以来[11],多孔二氧化硅的可控制备以及修饰的研究迅速发展,多孔二氧化硅纳米颗粒尺寸在20~500 nm,孔径可在2~10 nm范围内调控,结构包括蠕虫状和六方形,而且同时具有较大的表面积和孔体积。与其它高分子药物载体相比,多孔二氧化硅具有耐热性好、机械强度高、不易降解、环境稳定性高等优势。此外,通过改变不同的硅烷试剂,水解可以得到载有不同官能团的多孔二氧化硅,而且采用合成嫁接的方法也可以赋予其更多的性能[12]。更为重要的是多孔二氧化硅纳米颗粒具有颗粒外部以及空腔两种表面结构,可以选择性的修饰不同官能团,从而达到负载和调控等多功能的目的。
2 多孔二氧化硅纳米颗粒的细胞摄取行为
多孔二氧化硅纳米颗粒具有良好的生物相容性,且在有效的浓度范围内对细胞的生长和代谢没有明显的抑制作用,为其在生物医学中的应用提供了坚实的保障[13~15]。同时二氧化硅同多种磷脂具有高度的亲和力,因此很容易吸附在细胞表面进而内在化[16]。为使得非吞噬细胞也可以更好的摄取,纳米颗粒的尺寸控制在亚微米级为佳[17]。此外,多孔二氧化硅的孔道形状对细胞摄取也有一定的影响。Lu等[14]研究了Hela细胞对大小在30 nm~280 nm的多孔二氧化硅的摄取行为,发现具有规则六方孔道的50 nm左右的多孔二氧化硅最容易进入Hela细胞。此外,对多孔二氧化硅的表面功能化修饰可以调节细胞对多孔二氧化硅吞噬的效率,研究发现修饰叶酸后的多孔二氧化硅进入细胞的能力有了显著提高[18]。另外,纳米颗粒的表面电荷对细胞吞噬作用也有一定影响[13]。
3 多孔二氧化硅纳米颗粒在药物/基因输送上的应用
药物的控制释放是减少药物用量、增强药物疗效并降低药物生物毒性的可靠方法,通过药物载体系统可以避免药物活性的提前丧失,有利于药物的贮藏和运输。多孔二氧化硅载药纳米微粒能够穿越细胞间隙通过人体最小的毛细血管及血脑屏障(BBB)被细胞组织吸收。客体分子不仅可以缓慢地从孔道中释放出来,实现药物的缓释,而且还可以在孔的开口处装以开关,实现可控释放,从而提高药效的持久性。目前,多孔二氧化硅载药纳米微粒的药物释放可分为物理形貌控制的扩散释放和化学可控制释放两大类,化学可控制释放体系又可依据机理有光化学开关释放体系、酶激活药物释放体系、氧化还原释放体系、pH控制药物释放体系及两两相互组合的双控制及多控制体系等。
3.1 物理形貌控制的扩散释放
多孔二氧化硅的物理形貌控制释放的主要动力是依靠粒子内部的药物不断地向外扩散。Vallet等[19]将 2.5 nm 和 1.8 nm 孔径的 MCM-41装载临床上广泛使用的一种止痛消炎药布洛芬(ibuprofen),模拟体内循环研究布洛芬的释放。有机分子布洛芬通过吸附作用装载到二氧化硅的孔径中,装载后的药物与MCM-41的质量比可达到30%以上,当体系浸渍在模拟人体血液循环环境中后,有机分子通过扩散释放出来,在目前通行的体外药物释放实验条件下,经过三天可实现药物分子的完全释放。研究还进一步表明,要想取得理想的装载与释药效果,所选药物分子的大小与载体的孔径必须在一定程度上相匹配,以有机分子能够在孔道中平躺进入较为适宜。Trewyn等[20]制备了不同形貌、不同多孔结构的二氧化硅,并分别使之作为载体研究了抗菌离子液体对大肠杆菌的抑制作用,结果表明六方以及圆形孔道多孔二氧化硅的释放能力要好于蠕虫状不规则的孔道。因此,多孔二氧化硅纳米颗粒应用于药物释放,颗粒稳定,对药物质量没有明显影响,释放特性基本规律。
3.2 化学可控制释放
理想的药物释放系统应该具有以下特点[5]:良好的生物相容性、较高的负载量、零早期释放、靶向性以及释放速率的可调控性。而单纯的基于药物分子扩散的物理调控机制不可避免地伴随着前期释放,且其释药速度与孔径形态及表面电荷的直接依赖性,决定了单纯的物理调控释药机制对医学靶向与定点释药的要求还存在着很大的差距。多孔二氧化硅颗粒的表面结构可以选择性修饰具有特殊功能的键或者官能团,再封以“门”(gatekeeper),通过一系列外部刺激来控制门的开关,从而达到负载和调控等多功能的目的。目前已报道的通过化学反应启动门阀,控制药物或者基因释放的多孔二氧化硅药物释放系统如图1所示。其中,绝大多数为体外溶液体系的研究,也有部分药物控制体系进行了细胞[21~22]和生物活体[23]的研究。“门”的物质有量子点[24]、金[25~26]、磁 性 纳 米 颗 粒[27]、有机分子[28]、超 分子[29~30]、聚合物和生物大分子[31]。以下就释放响应手段对多孔二氧化硅的可控制释放手段进行分类阐述。

图1 多孔二氧化硅体系研究、释放响应控制手段和可控制开关研究状况示意图Fig.1 Systems research,methods employed to control and gatekeepers applied in the release of various molecules from MSN
3.2.1 光化学开关释放系统
“光开关”顾名思义,即用光作为启动和关闭多孔二氧化硅孔径门阀的信号。通过使用一定波长的光照射,使得孔径表面的分子发生光解反应,控制门的动态变化,使得孔道中的物质得以释放。光开关的主要原理包括光异构和光扳机,如图2所示。偶氮苯分子在紫外光下发生可逆的顺反异构变化属于光异构的表现。Ferris等[32]将偶氮苯链接在多孔二氧化硅表面,由于反式偶氮苯分子会和环糊精相互识别,从而结合在多孔二氧化硅表面,起到限制孔内客体分子释放的作用。依靠光的波长控制偶氮苯分子构象转变为顺式结构,脱离环糊精空腔,进而控制环糊精分子的解离以及孔内客体分子的释放。光异构的典型示例还包括利用香豆素衍生物在光照下发生单体和二聚体转换以进行开关控制。Mal[33]合成了具有光响应性的释药体系,该体系将香豆素衍生物连接在MCM-41的孔入口处,香豆素在>310 nm波长的光照射下生成二聚体,在250 nm波长的光照射下二聚体分解,从而实现了控制性释放胆甾烷。研究还表明,MCM-41结构上拥有的独立的孔洞通道,进入其中的药物分子被堵塞在其所属的一个封闭空间中,最大的避免了在相互连通的孔道网中的另端释放。尽管该实验并未取得药物控制释放上的理想结果,但是构建该体系所提供的思路,为MCM-41作为一种新材料在控制释药领域应用开辟了很大的空间。对于光扳机而言,目前最常用的光扳机是硝基苯类光扳机。Chiyoung等[34]将邻硝基苄基酯作为光裂解连接单体用来连接多孔二氧化硅和门,其中门选用的是环糊精。在紫外光照射下,酯键断裂,环糊精从多孔二氧化硅表面脱离,孔内的客体分子释放出来。Vivero-Escoto等[26]将金外面修饰一端为巯基,另外一端为硝基苄基光响应化合物的阳离子链接体,然后通过静电作用将其组装在带有负电多孔二氧化硅表面,实现了早期零释放。在紫外-可见光照射下,硝基苄基光响应化合物与链接体之间的酯键发生断裂,从而实现可控制释放。硝基苯类扳机的吸收波长一般在紫外区,而紫外光对人体组织的穿透力不强,并且对生物体的光毒性比较大,在光控药物释放领域中的应用仍然具有一定的局限性。
3.2.2 酶激活药物释放
利用特异性酶解反应控制药物释放,真正实现体内病变器官的定点送药及细胞内释药意义重大,而且可最大程度上减少对人体的毒副作用。Patel等[35]尝试了以α-环糊精为门,利用猪肝酯酶对酯键的水解作用控制孔内药物的释放。将带有叠氮键的醚链与氨基修饰的多孔二氧化硅纳米颗粒相连,负载染料后低温引入α-环糊精,此时线状醚链和环糊精形成稳定的包合物,随后采用Cu(Ⅰ)催化带有炔基的金刚烷酯与上述叠氮键高产率反应得到三氮唑,称之为带顶扣的二氧化硅纳米容器 (Snap-top Covered Silica Nanocontainers SCSNs)(图3),其中,金刚烷起到防止环糊精脱落的作用。此种药物释放体系稳定性较好,研究表明,在不加猪肝酯酶的水解的情况下,多孔二氧化硅孔内的染料不会释放出来。随后Bein组[31]设计了表面偶联生物素的多孔二氧化硅,与其特异性结合的亲和素起到了门的作用,阻挡住药物分子从孔内扩散出来,而当加入水解亲和素的胰蛋白酶便可以实现药物分子的释放。这种大分子功能的多孔二氧化硅生物相容性更好,无毒性,且不会导致基因突变。

图2 (a)偶氮苯衍生物在UV/Vis照射下发生的顺反异构结构图(b)香豆素衍生物在光照下发生单体和二聚体变换示意图[33];(c)硝基苯类光扳机开关药物释放应用示意图[26]Fig.2 (a)Cis-trans isomerization of azobenzene substituents with UV/Vis irradiation;(b)Coumarin substituents reversibly dimerized with UV irradiation;(c)nitrobenzyl phototrigger act as gates in drug release system[26]

图3 酯键水解控制二氧化硅孔内药物释放示意图[35]Fig.3 Eesterase responsive snap-top covered silica nanocontainers[35]
3.2.3 氧化还原释放系统
3.2.3.1 基于二硫键还原的释放系统
目前研究应用最多的氧化还原释放体系是基于二硫键桥连,利用人体细胞或组织中的还原类物质作为启动信号,使二硫键断裂,释放出装载分子。 Lai等[24]用巯基乙酸功能化的CdS纳米颗粒,通过酰胺缩合和乙胺基二硫二氧化硅连接,CdS作为“门”将孔道中的药物堵住。当多孔二氧化硅纳米颗粒遇到二硫苏糖醇(DTT)、巯基乙醇(ME)等还原剂时,二硫键被打开,CdS纳米颗粒从MCM-41上解离下来,此时药物分子如万古霉素(Vancomycin)或三磷酸腺苷(ATP)等从孔道中扩散出来(图4)。Torney等[36]通过在纳米金控制的多孔二氧化硅体系外部包覆质粒DNA,实现了植物的基因和化合物的同时可控制输送,即多孔二氧化硅的空腔携有化学分子,壳外部通过二硫键连接10~15 nm的金,作为门阀以控制孔道中的开关以及基因的载体。因为植物细胞含有细胞壁,这种多功能的药物释放载体可以成功地同时输送蛋白、基因,以及小分子化合物,在植物生物技术应用中有着巨大的应用潜力。Fe3O4开关和磁定位性使得超顺磁性Fe3O4在生物医学中具有极大的潜力,近来被研究者们特别青睐。Supratim等[4,27]构建了棒状多孔 SiO2和纳米Fe3O4的药物释放纳米体系载体。Fe3O4具有开关和磁定位两种功能,在多孔二氧化硅外面修饰丙基二硫乙酸,通过酰胺缩合连接二氧化硅包覆的Fe3O4,当加入二硫叔糖醇(DTT)或者二氢硫辛酸(DHLA),作为门的Fe3O4就会从二氧化硅表面脱落下来,药物分子得以释放。最近,Liu等[37]报道了将聚丙烯酸琥珀酰胺接枝二氧化硅作为纳米药物载体,通过二硫键将聚合物链变成束状结构的聚合物网络,从而阻挡住了孔内分子,这种聚合物修饰的多孔二氧化硅具有更好的生物相容性。

图4 基于二硫键还原的二氧化硅药物释放系统[4]Fig.4 Disulfide reduction activation of snap-top mechanised silica system[4]
3.2.3.2 其他氧化还原释放体系
以Stoddart为代表的化学家基于π-π堆积相互作用,利用两亲性哑铃分子与四价阳离子百草枯环番(CBPQT4+)的模板效应合成了一些轮烷和准轮烷[38],这种模型在可控制药物释放领域有着巨大的应用前景。轮烷修饰在多孔二氧化硅表面,哑铃分子中的四硫富瓦烯(TTF)富含π电子,CBPQT4+缺电子,两者分别作为电子的给体和受体;同时,哑铃分子中带有1,5-二氧萘(DNP)结合位点,形成了化学氧化还原控制的双稳态轮烷和二氧化硅复合体系。氧化条件下,CBPQT4+向DNP运动,封闭孔内的药物分子或染料分子在还原作用下,向TTF运动,打开门阀,使得分子释放出来。两种状态类似于计算机二进制中的0和1,调控多孔二氧化硅孔内的分子释放(图5)[4,39]。
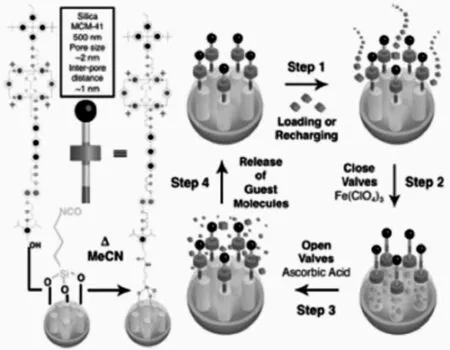
图5 基于π-π堆积相互作用的多孔二氧化硅药物释放示意图[4]Fig.5 Mesoporous silica nanoparticles drug release system based π-π stacking interaction[4]
3.2.4 pH控制药物释放体系
由于病理组织(例如发炎,感染,肿瘤组织)与正常组织的pH明显不同,通常感染、原发肿瘤及转移瘤的部位的pH都低于正常组织,因此pH控制药物释放系统在这类疾病中具有重要的应用价值。Stoddart课题组等[40~41]合成了基于氢键相互作用、以二级铵盐为轴,冠醚/葫芦脲为大环的一系列轮烷,并将其修饰于多孔二氧化硅表面,在碱性环境下,氢键破坏,作为门控的超分子解离,释放孔内药物。Chiyoung等[42]利用某些离子型聚合物链段与环糊精发生包合作用时具有明显的pH依赖性的原理,设计了聚乙烯亚胺(PEI)修饰的多孔二氧化硅,在碱性环境下,环糊精同PEI形成稳定的包合物封住孔内药物,而酸性条件下则会导致环糊精/PEI包合物的解离。如图6所示,Liu等[43]设计了pH控制的纳米药物释放载体。这种可控制纳米载体在中性pH值下,金纳米颗粒稳定地连接在多孔二氧化硅的表面,堵住孔内药物;而在酸性环境下,缩醛水解,作为孔盖的金纳米颗粒从二氧化硅表面解离下来,孔内的药物释放。由于一些含孤对电子的原子,比如N原子和O原子,可以和某些基团(如-NH,-OH,和-NH2+)上的氢原子静电吸引而形成氢键,基于这些氢键作用可以制备pH控制的药物释放体系。

图6 pH响应多孔二氧化硅药物释放体系[43]Fig.6 pH-Responsive mesoporous silica nanoparticles[43]
3.2.5 其他释放体系
多孔二氧化硅孔作为药物释放载体的独特优势在于其孔内和外部表面可以修饰不同官能团,从而实现多功能化。Zhao等[4,22]利用这一特性设计出可分级释放不同药物的多功能纳米颗粒,如图7所示。该两种药物同时输送,分层次释放的纳米颗粒给当今疾病的有效治疗提供了更为广阔的思路。研究者针对传统的葡萄糖响应刺激胰岛素的输送的缺陷(即胰岛素具有抑制细胞内腺苷酸环化酶活性作用,使环磷酸腺苷(cAMP)产生显著减少,导致糖原分解速度减慢)设计了葡萄糖响应,胰岛素和cAMP依次释放的纳米颗粒。多孔二氧化硅表面修饰硼酸后,与和葡萄糖酸修饰的胰岛素形成硼酸酯键,此时具有一定体积的大分子胰岛素充当门,在外界果糖、葡萄糖等糖类的竞争下,硼酸酯键打断,“门”即胰岛素释放,随后孔内装载的cAMP也扩散到外部环境中。cAMP不仅减少胰岛素与脂肪细胞的结合,而且能够增加贮存在细胞内钙离子水平增加而刺激胰岛素分泌。值得说明的是,cAMP不易透过细胞膜,这种通过多孔二氧化硅携带的方式可以更有效的将cAMP转运到细胞内。

图7 葡萄糖响应、胰岛素和cAMP依次释放的多孔纳米颗粒[4]Fig.7 Glucose-responsive mesoporous silica nanoparticles based delivery system for controlled release of bioactive G-Ins and cAMP[4]
3.2.6 双控制释放体系
3.2.6.1 基于pH和离子的双控制释放体系
Rosa Casasús利用多孔二氧化硅设计了pH和离子驱动控制体系,如图8所示,通过在多孔二氧化硅表面修饰聚氨类来控制运输分子的释放[44]。中性pH值下,聚合物链之间形成氢键,以有序状态垂直在纳米颗粒的表面,药物分子可以自由扩散。在酸性环境下,带正电的聚合物链之间发生库仑排斥,聚合物链的交叉混结在某种程度上阻挡住了药物分子的释放。此外,还通过引入与正电聚合物链发生静电作用的氯离子、磺酸根、磷酸根以及三磷酸腺苷来控制药物释放的速度,其研究表明,强酸性条件下,加入上述离子都可以阻止孔内小分子的释放,当pH值等于4时,只有磷酸根和三磷酸腺苷可以起到门的作用,而在中性条件下只有体积较大的三磷酸腺苷才能起到阻止孔内染料泄漏的功能。
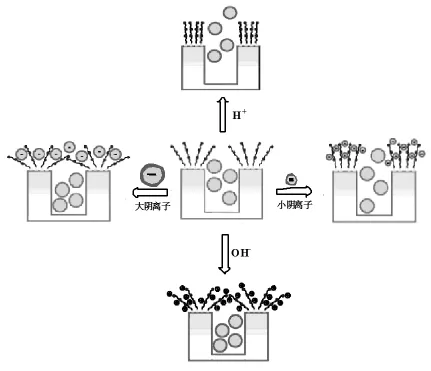
图8 pH和离子的双控制多孔二氧化硅药物释放体系[44]Fig.8 pH-and anion-driven release of guest molecules from mesoporous silica nanoparticles[44]
3.2.6.2 基于pH和光热双控制释放体系
当多孔二氧化硅孔外修饰糖类,金纳米颗粒外修饰硼酸时,由于糖和苯硼酸之间存在较强的络合能力,金纳米颗粒便会结合在二氧化硅表面(图9)[25]。该体系的阀门开关控制可以依照pH值对硼酸酯键的影响和光热效应进行调控。当pH等于3时,硼酸酯键便会水解断裂,此时金纳米颗粒便会从二氧化硅表面脱落,孔内的染料分子迅速被释放;当pH值大于5时,硼酸酯键相对比较稳定。作为门的金纳米颗粒在此体系中还扮演另外一种角色——调节器,金纳米微粒在超短激光脉冲的照射下可以产生高度局域化的光热效应[46],这种光热效应会严重影响硼酸酯的稳定性,从而打开门阀,使孔内客体分子得以释放[25]。

图9 基于pH和光热双控制多孔二氧化硅药物释放体系[25]Fig.9 pH-and Photo-switched release of guest molecules from mesoporous silica nanoparticles[25]
3.2.6.3 基于还原二硫键和光诱导的双控制体系
Liu等[47]通过在多孔二氧化硅上组装性能优异,功能奇特的超分子和聚合物来实现多响应药物释放的性能。研究者首先在多孔二氧化硅上修饰聚丙烯酸琥珀酰胺,并在聚丙烯酸琥珀酰胺的支链上以二硫键连接环糊精,随后加入具有光致异构的偶氮染料,此时由于偶氮苯染料会和环糊精自组装形成稳定的复合物,使得聚合物链成束状结构进而封住孔内的药物分子,如图10所示。对于此纳米药物,当予以紫外光照射,反式偶氮苯染料变成顺式偶氮苯从环糊精空腔内脱离,聚合物链从束状结构变为松散结构,从而使得药物分子得以释放。当加入DTT还原剂时,由于二硫键的打断,交联聚合物网络破坏更为彻底,半数以上的药物分子得以释放。进一步加入竞争性的α-环糊精后,由于α-环糊精其与偶氮苯具有更高的稳定常数系数,因此可以将偶氮苯染料从交联聚合物网络中环糊精中竞争出来。选择三种不同的激活手段实现了孔内分子不同程度的释放。
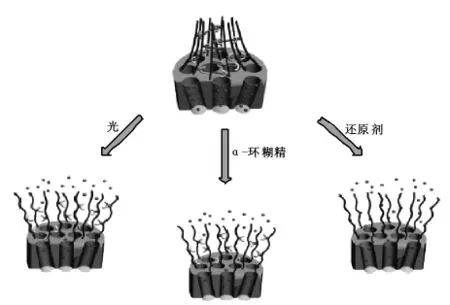
图10 基于还原二硫键和光诱导的双控制多孔二氧化硅药物释放体系[47]Fig.10 Redox-and Photo-controlled release of guest molecules from mesoporous silica nanoparticles[47]
3.2.6.4 基于还原二硫键和pH的双控制体系
香豆酸和甲基橙与环糊精的竞争能力与pH值有关。将Hoechst 33342和香豆酸装依次载于二氧化硅空腔内,并在二氧化硅孔外修饰二硫键连接的环糊精,然后加入甲基橙,甲基橙和环糊精形成包合物,起到“门”的作用来控制香豆酸和Hoechst 33342的释放。如图11所示,pH为7时,甲基橙和环糊精的包合常数较大,甲基橙和环糊精形成的“门”可以控制Hoechst 33342和香豆酸的释放,而当pH值降低到3.5时,甲基橙与环糊精的包结常数显著降低,香豆酸不断的释放到外部环境中,但是由于环糊精的阻挡作用,尺寸约为20 Å的Hoechst 33342仍然会保留在二氧化硅的孔道中,只有当遇到还原物质,二硫键打开时,环糊精从多孔二氧化硅表面脱落,Hoechst 33342才能够释放到外部环境中[45]。
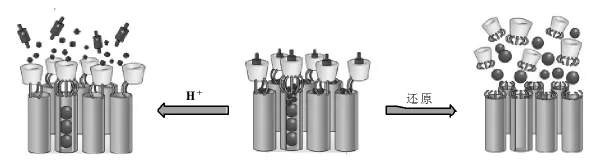
图11 基于pH和还原二硫键的双控制多孔二氧化硅药物释放体系[45]Fig.11 pH-and Redox-controlled release of guest molecules from mesoporous silica nanoparticles[45]
4 展望
多孔二氧化硅具有较低的生物毒性、良好的稳定性,且易于功能化,通过修饰聚合物、超分子或者纳米颗粒可以实现不同的医学价值,在药物输送这一领域是一个极具吸引力的平台,这也是其近期备受关注的原因。然而,对于多孔二氧化硅作为多功能药物载体以及各种功能设计的研究应用多数是先在体外环境模拟,然后将其应用于细胞及活体研究。许多构建的模型的生物可行性值得商榷,因此再进一步探测其生物毒性以及在复杂的生物环境中的动态过程,是其得到全面发展应用的关键。应该相信随着对多孔二氧化硅的组装和修饰的不断发展及在生物活体应用的不断深入研究,基于多孔二氧化硅的纳米材料在生物医学领域必将具有更广阔的应用前景。
[1]Hartmann M.Ordered mesoporous materials for bioadsorption and biocatalysis[J].Chem.Mat.,2005,17:4 577~4 593.
[2]Corma A.From microporous to mesoporous molecular sieve materials and their use in catalysis[J].Chem.Rev.,1997,97:2 373~2 419.
[3]Rao Y V S,De Vos D E,Jacobs P A.1,5,7-triazabicyclo 4.4.0 dec-5-ene immobilized in MCM-41:A strongly basic porous catalyst[J].Angew.Chem.Int.Ed.,1997,36:2 661~2 663.
[4]Cotí M E B Karla K,Monty Liong,Ambrogio Michael W,et al.Mechanised nanoparticles for drug delivery[J].Nanoscale,2009,1:16~39.
[5]Slowing I I,Vivero-Escoto J L,Wu C-W,et al.Mesoporous silica nanoparticles as controlled release drug delivery and gene transfection carriers[J].Adv.Drug Delivery Rev.,2008,60:1 278~1 288.
[6]Trewyn B G,Slowing I I,Giri S,et al.Synthesis and functionalization of a mesoporous silica nanoparticle based on the Sol-Gel process and applications in controlled release[J].Acc.Chem.Res.,2007,40:846~853.
[7]Slowing I I,Trewyn B G,Giri S,et al.Mesoporous silica nanoparticles for drug delivery and biosensing applications[J].Adv.Funct.Mater.,2007,17:1 225~1 236.
[8]Vallet-Regí M,Balas F,Arcos D.Mesoporous materials for drug delivery[J].Angew.Chem.Inter.Ed.,2007,46:7 548~7 558.
[9]Wan W K,Yang L,Padavan D T.Use of degradable and nondegradable nanomaterials for controlled release[J].Nanomedicine,2007,2:483~509.
[10]Ambrogio M W,Thomas C R,Zhao Y L,et al.Mechanized silica nanoparticles:A new frontier in theranostic nanomedicine[J].Acc.Chem.Res.,2011,44:903~913.
[11]Beck J S,Vartuli J C,Roth W J,et al.A new family of mesoporous molecular sieves prepared with liquid crystal templates[J].J.Am.Chem.Soc.,1992,114:10 834 ~10 843.
[12]Lin V S Y,Lai C-Y,Huang J,et al.Molecular recognition inside of multifunctionalized mesoporous silicas:Toward selective fluorescence detection of dopamine and glucosamine[J].J.Am.Chem.Soc.,2001,123:11 510~11 511.
[13]Slowing I,Trewyn B G,Lin V S Y.Effect of surface functionalization of MCM-41-Type mesoporous silica nanoparticles on the endocytosis by human cancer cells[J].J.Am.Chem.Soc.,2006,128:14 792~14 793.
[14]Lu F,Wu S-H,Hung Y,et al.Size effect on cell uptake in well-suspended,uniform mesoporous silica nanoparticles[J].Small,2009,5:1 408~1 413.
[15]Huang D-M,Hung Y,Ko B-S,et al.Highly efficient cellular labeling of mesoporous nanoparticles in human mesenchymal stem cells:implication for stem cell tracking[J].FASEB J.,2005,19:2 014~2 016.
[16]Mornet S,Lambert O,Duguet E,et al.The formation of supported lipid bilayers on silica nanoparticles revealed by cryoelectron microscopy[J].Nano Lett.,2004,5:281~285.
[17]Rejman J,Oberle V,Zuhorn I S,et al.Size-dependent internalization of particles via the pathways of clathrinand caveolae-mediated endocytosis[J].Biochem.J.,2004,377:159~169.
[18]Lebret V,Raehm L,Durand J-O,et al.Surface functionalization of two-photon dye-doped mesoporous silica nanoparticles with folic acid:cytotoxicity studies with HeLa and MCF-7 cancer cells[J].J.Sol-Gel Sci.Technol.,2008,48:32~39.
[19]Vallet-Regi M,Ramila A,del Real R P,et al.A new property of MCM-41:Drug delivery system[J].Chem.Mat.,2001,13:308~311.
[20]Trewyn B G,Whitman C M,Lin V S Y.Morphological control of room-temperature ionic liquid templated mesoporous silica nanoparticles for controlled release of antibacterial agents[J].Nano Lett.,2004,4:2 139 ~2 143.
[21]Pan L,He Q,Liu J,et al.Nuclear-targeted drug delivery of TAT peptide-conjugated monodisperse mesoporous silicananoparticles[J].J.Am.Chem.Soc.,2012,134:5 722~5 725.
[22]Zhao Y,Trewyn B G,Slowing I I,et al.Mesoporous silica nanoparticle-based double drug delivery system for glucose-responsive controlled release of insulin and cyclic AMP[J].J.Am.Chem.Soc.,2009,131:8 398~8 400.
[23]Tang F,Li L,Chen D.Mesoporous Silica Nanoparticles:Synthesis,biocompatibility and drug delivery[J].Adv.Mater.,2012,24:1 504~1 534.
[24]Lai C-Y,Trewyn B G,Jeftinija D M,et al.A mesoporous silica nanosphere-based carrier system with chemically removable CdS nanoparticle caps for stimuli-responsive controlled release of neurotransmitters and drug molecules[J].J.Am.Chem.Soc.,2003,125:4 451~4 459.
[25]Aznar E,Marcos M D,Martínez-Manez R,et al.pH-and photo-switched release of guest molecules from mesoporous silica supports[J].J.Am.Chem.Soc.,2009,131:6 833~6 843.
[26]Vivero-Escoto J L,Slowing I I,Wu C-W,et al.Photoinduced intracellular controlled release drug delivery in human cells by gold-capped mesoporous silica nanosphere[J].J.Am.Chem.Soc.,2009,131:3 462~3 463.
[27]Supratim G,Brian G T,Michael P S,et al.Stimuli-responsive controlled-release delivery system based on mesoporoussilica nanorodscapped with magnetic nanoparticles[J].Angew.Chem.Int. Ed.,2005,44:5 038~5 044.
[28]Casasús R,Marcos M D,Martínez-Máñez R,et al.Toward the development of ionically controlled nanoscopic molecular gates[J].J.Am.Chem.Soc.,2004,126:8 612~8 613.
[29]Nguyen T D,Tseng H-R,Celestre P C,et al,A reversible molecular valve[J].Proc.Natl.Acad.Sci.USA,2005,102:10 029~10 034.
[30]Hernandez R,Tseng H-R,Wong J W,et al.An operational supramolecular nanovalve[J].J.Am.Chem.Soc.,2004,126:3 370~3 371.
[31]Schlossbauer A,Kecht J,Bein T.Biotin-avidin as a protease-responsive cap system for controlled guest release from colloidal mesoporous Silica[J].Angew.Chem.Int.Ed.,2009,48:3 092~3 095.
[32]Ferris D P,Zhao Y L,Khashab N M,et al.Light-operated mechanized nanoparticles[J].J.Am.Chem.Soc.,2009,131:1 686~1 688.
[33]Mal N K,Fujiwara M,Tanaka Y,Photocontrolled reversible release of guest molecules from coumarin-modified mesoporous silica[J].Nature,2003,421:350~353.
[34]Chiyoung P,Kyuho L,Chulhee K.Photoresponsive Cyclodextrin-covered nanocontainers and their Sol-Gel transition induced by molecular recognition[J].Angew.Chem.Int.Ed.,2009,48:1 275~1 278.
[35]Patel K,Angelos S,Dichtel W R,et al.Enzyme-responsive snap-top covered silica nanocontainers[J].J.Am.Chem.Soc.,2008,130:2 382~2 383.
[36]Torney F,Trewyn B G,Lin V S Y,et al.Mesoporous silica nanoparticles deliver DNA and chemicals into plants[J].Nat Nano,2007,2:295~300.
[37]Liu R,Zhao X,Wu T,et al.Tunable redox-responsive hybrid nanogated ensembles[J].J.Am.Chem.Soc.,2008,130:14 418~14 419.
[38]Brough B,Northrop B H,Schmidt J J,et al.Evaluation of synthetic linear motor-molecule actuation energetics[J].Proc.Natl.Acad.Sci.USA,2006,103:8 583~8 588.
[39]Nguyen T D,Liu Y,Saha S,et al.Design and optimization of molecular nanovalves based on redox-switchable bistable rotaxanes[J].J.Am.Chem.Soc.,2007,129:626~634.
[40]Nguyen T D,Leung K C F,Liong M,et al.Construction of a pH-driven supramolecular nanovalve[J].Org.Lett.,2006,8:3 363~3 366.
[41]Sarah A,Ying-Wei Y,Kaushik P,et al.pH-responsive supramolecular nanovalves based on cucurbit[6]uril pseudorotaxanes[J].Angew.Chem.Int.Ed.,.2008,47:2 222~2 226.
[42]Chiyoung P,Kyoungho O,Sang Cheon L,et al.Controlled release of guest molecules from mesoporous silica particles based on a pH-responsive polypseudorotaxane motif[J].Angew.Chem.Inter.Ed.,2007,46:1 455~1 457.
[43]Liu R,Zhang Y,Zhao X,et al.pH-responsive nanogated ensemble based on gold-capped mesoporous silica through an acid-labile acetal linker[J].J.Am.Chem.Soc.,2010, 132:1 500~1 501.
[44]Casasus R,Climent E,Marcos M D,et al.Dual aperture control on pH-and anion-driven supramolecular nanoscopic hybrid gate-like ensembles[J].J.Am.Chem.Soc.,2008,130:1 903~1 917.
[45]Wang C,Li Z,Cao D,et al.Stimulated release of size-selected cargos in succession from mesoporous silica nanoparticles[J].Angew.Chem.Int.Ed.,2012,51:5 460~5 465.
[46]Uechi I,Yamada S.and analytical applications of gold nanoparticles and nanorods utilizing surface plasmon r Photochemical esonance[J].Anal.Bioanal.Chem.,2008,391:2 411~2 421.
[47]Liu R,Zhang Y,Feng P.Multiresponsive supramolecular nanogated ensembles[J].J Am.Chem.Soc.,2009,131:15 128~15 129.

