无标记纳米金传感显色测定五氯苯酚
姚英华,李程程,蔡青云*
(1.湖南益阳龙州中学,湖南益阳431000)
(2.湖南大学化学化工学院,化学生物传感与计量学国家重点实验室,湖南长沙410082)
0 引言
五氯苯酚(PCP)作为树木的防腐剂、杀虫剂和除草剂曾广泛应用于农业和工业[1~2]。PCP除了作为防腐剂、农药等在使用过程中进入环境外,还可以通过工业废水排放进入到水环境中,另外还可以通过在自然环境条件下,由其他物质的合成或降解生成。五氯苯酚性质稳定,在通常情况下不容易被氧化,也难水解[3],在肝、肾以及脂肪组织中累积,富集率高,能抑制生物代谢过程中氧化磷酸化作用,干扰内分泌、影响生殖发育以及导致动物肺、肝、肾脏以及神经系统的损伤和致癌等[4],对人类生命安全造成严重威胁。PCP及其代谢产物对人体或者动物体的毒性和危害不管是在组织、器官等整体水平还是细胞水平和分子水平都是很明显的[5],但是其毒性的作用机制目前还有待进一步阐明。由于其剧毒性,存在持久性,生物富集性等,PCP被美国环保局(EPA)列为优先污染物,并且被国际癌症研究协会列为第2B组环境致癌物质[6],列入持久性有机污染物 (Persistent Organic Pollutants,POPs)优先候选名单。POPs是一类具有高毒性、难降解、生物可累积性等特点的有机化合物的总称[7~8]。POPs可以通过多种环境介质(大气、水、生物体等)进行长距离迁移,对人类健康和环境造成严重危害。开发检测人体或者动物体内PCP含量的快速检测方法具有重大的现实意义。
对环境中五氯苯酚的检测以气相色谱法[9],气质联用法[10],高效液相色谱法等[11]为主要手段。这些方法具有较高的准确度和灵敏度,然而其复杂的样品预处理过程以及昂贵笨重的仪器设备,制约了其在快速现场分析方面的应用。发展PCP的快速分析技术具有现实意义。目前报道的快速分析方法主要有电化学分析法[12],化学发光分析[13],基于半导体纳米材料的光电免疫分析[14],光谱分析法[15]、免疫标记分析法[16]等。这些方法主要采用一些新型的纳米材料,如二氧化钛纳米管、金纳米粒子、量子点等,作为传感基质或敏感原件,借助于纳米材料的光、电、以及催化特性,实现在复杂环境本底中污染物的检测。
该文提出了一种简单,快速,低成本检测PCP的方法。该方法检测PCP的线性范围较宽,从 1 nmol/L 到 1 mmol/L,检测限为 0.5 nmol/L。
1 实验部分
1.1 实验仪器和试剂
仪器:BECKMAN DU-800紫外-可见分光光度计;Synergy UV Millipore超纯水仪:超声仪;恒温箱;Adventurer AR214型电子天平。
试剂:氯金酸购于国药集团化学试剂有限公司 ,NaCl、 H202、Fe(NH4)2(S04)2、 Na2HP04、KH2P04、C6H5Na3O7·2H2O均购于天津化学试剂公司。以上试剂均为分析纯。整个实验用水为美国Milli-Q系统制备的超纯水。
DNA购自上海生物工程技术有限公司,采用ULTRA PAGE 方式纯化,序列为 ssDNA(20 mer):5’-TAGCTATGGAATTCCTCGTA-3’
1.2 纳米金的合成
预处理:在制备金纳米粒子前,所有的玻璃仪器均用王水(VHCl∶VHN03=3∶1)浸泡 2 h,再用超纯水冲洗3次,然后置于干燥箱烘干备用;所有的溶液均使用超纯水配制。
Au NPs合成方法目前有很多,该文的合成方法参照文献[17],具体过程如下:在装有球形冷凝回流管的100mL三颈烧瓶中加入50mL 1 mmol/L HAuCl4溶液,搅拌加热出现逆流时,快速加入5mL 38.8 mmol/L的柠檬酸钠溶液,1 min内溶液的颜色由黄色很快变为黑色,再逐渐变为紫色,最后变成酒红色。继续加热并剧烈搅拌20 min后停止加热,移去加热装置,继续剧烈搅拌15min,然后停止搅拌,拆除装置,自然冷却至室温,用4.5 pm膜过滤,置于4℃冰箱中备用。
1.3 五氯苯酚的显色检测
在 20 μL 1 mmol/L Fe(NH4)2(S04)2中,加入 5 μL 50 mmol/L的ssDNA,加入5 μL不同浓度的五氯苯酚溶液后,再加入 20 μL 0.1 mol/L H2O2混合,搅拌均匀,室温下反应1 h,取5 μL反应液加入到100 μL Au NPs溶液中,室温下孵育2 min,再迅速加入4 μL 1 mol/L NaCl溶液,搅拌混匀。观察Au NPs溶液颜色变化,并采用紫外-可见分光光度计测定最终反应液的吸收光谱。
2 结果与讨论
2.1 测定原理
所合成的金纳米溶液的紫外-可见吸收光谱如图1所示,在520 nm处有最大吸收峰,与文献一致[17],表明合成的Au NPs粒径约为13 nm。该文实验过程中合成的Au NPs有较好的稳定性,在温度为4℃的冰箱内可以保存半年的时间而不发生任何性质的变化。
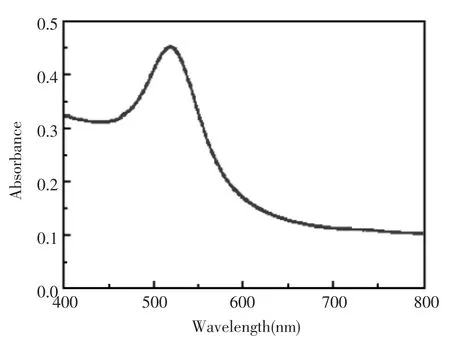
图1 Au NPs(粒径约13 nm)的紫外-可见吸收光谱图Fig.1 The UV-vis spectrum of Au NPs(~13 nm in diameter)
研究表明Au NPs的聚沉变色通常是由于其稳定性遭到破坏造成的,而影响Au NPs稳定性的主要因素是其表面电荷的静电作用。该文合成的Au NPs表面有一个双电层,使得Au NPs在溶液稳定存在。当加入一定量盐 (例如1 mol/L NaCl)后,由于溶液的离子强度增大,双电层遭到破坏,使得Au NPs间排斥作用减弱,导致Au NPs聚集变色。研究发现,ssDNA和金纳米粒子有较好的亲和力,而ssDNA带负电荷,二者的结合改变Au NPs表面的电荷结构,从而改变金纳米溶液的稳定性。这种变化可以通过颜色改变表现出来。为了考察ssDNA对Au NPs的保护作用,将1 μL 50 mmol/L的 ssDNA加入到 100 μL的 Au NPs溶液中,室温下孵育2 min,再迅速加入4 μL 1 mol/L NaCl溶液,搅拌混匀,观察Au NPs溶液颜色变化,并测定反应液的紫外-可见吸收光谱。同时做对比实验,在没有ssDNA的Au NPs溶液中加入同样浓度的NaCl,反应相同时间。结果如图2所示,含有ssDNA的Au NPs溶液在盐的作用下没有聚沉变蓝,而不含ssDNA的Au NPs溶液在盐的作用下聚沉变蓝,说明ssDNA可以保护Au NPs溶液,在一定浓度的盐作用下不发生聚集。

图2 100 μL Au NPs在 4 μL 1 mol/L NaCl作用下的紫外-可见吸收光谱,(1)不含 ssDNA;(2)含 1 μL 50 mmol/L的ssDNA;插图 为相应的显色图Fig.2 The UV-vis spectrum of 100 μL Au NPs after addition of 4 μL 1 mol/L NaCl(1)without ssDNA and(2)with 1 μL 50 mmol/L ssDNA.Inset shows the corresponding photos
由羟基自由基 (·OH)引起的氧化损伤ssDNA的原理如下:由H2O2和Fe2+发生Fenton反应所生成的·OH可以随机地将DNA切成不同长度的核酸碎片甚至是单个碱基。为了证实Fenton反应产生的羟基自由基对ssDNA的氧化损伤作用,在 20 μL 1 mmol/L Fe(NH4)2(S04)2中,加入 10 μL 50 mmol/L 的 ssDNA (20 mer), 再加入20 μL 0.1 mol/L H2O2,搅拌均匀,室温下反应 30 min。 取出 5 μL 反应液加入到 100 μL Au NPs溶液中,室温下孵育2 min,再迅速加入4 μL 1 mol/L NaCl溶液,搅拌混匀。观察Au NPs溶液颜色变化,并测定其紫外-可见吸收光谱。结果如图3所示。从图中4号线可以看出,被Fenton试剂处理过的ssDNA不能使金纳米在盐溶液中稳定存在,盐作用下溶液颜色由红色变为蓝色,在500~750 nm处有吸收。为了证明Au NPs的吸收峰及颜色改变不是由溶液中其它因素引起的,而是由Fenton反应产生的·OH氧化损伤ssDNA破坏了其对金纳米的保护功能引起的,做了相关的对照实验。在对照实验中,只加入Fe2+或H2O2,或者不加Fe2+也不加H2O2。结果表明,Au NPs溶液的颜色没有发生任何改变,仍然呈红色。只有同时加入Fe2+和H2O2处理过的ssDNA,才失去对Au NPs的保护作用,在盐的作用下,Au NPs溶液由红色变为蓝色。其吸收光谱中,除了在520 nm处的微弱特征吸收,另外在650 nm左右也出现了新的吸收峰,这是由于Au NPs的聚集所造成的。这种趋势与Au NPs在盐溶液中的吸收峰是一致的。对照实验证明加入量的H2O2或Fe2+本身对ssDNA没有影响,从而也不影响Au NPs的稳定性。

图3 1 μL 50 mmol/L 的 ssDNA+100 μL Au NPs在4 μL 1 mol/L NaCl作用下的紫外-可见吸收光谱。(1)不含 Fe2+和 H2O2;(2)含 Fe2+,不含 H2O2;(3)不含 Fe2+,含H2O2;(4)含Fe2++H2O2;插图 为相应的显色图Fig.3 The UV-vis spectrum of solution containing 1 μL 50 mmol/L ssDNA and 100 μL Au NPs after addition of 4 μL 1 mol/L NaCl(1)without Fe2+and H2O2,(2)containing Fe2+(3)containing H2O2,(4)containing Fe2+and H2O2,Inset shows the corresponding photos
自由基的清除剂能够清除自由基或阻止自由基参与氧化反应,而一些容易被氧化的物质通常可以充当自由基的清除剂或者说抗氧化剂。它们可以消耗羟基自由基从而抑制羟基自由基对ssDNA的氧化损伤,从而保护DNA的性质结构完整。该文的待检测物五氯苯酚,是持久性有机污染物的一种,由于其分子结构的独特性,可作为羟基自由基的清除剂。基于此,五氯苯酚可能具有保护ssDNA不被羟基自由基氧化损伤的能力,从而可保护金纳米粒子在盐溶液中稳定存在。首先检验了五氯苯酚与DNA有无直接作用。对照实验如下,在5 μL 50 mmol/L的ssDNA中,加入5 μL不同浓度的五氯苯酚溶液,搅拌均匀,室温下反应1 h,取2 μL反应液加入到100 μL Au NPs溶液中,室温下孵育2 min,再迅速加入4 μL 1 mol/L NaCl溶液,搅拌混匀。观察Au NPs溶液颜色变化,并测定紫外-可见吸收光谱。结果如图4所示,随着加入的PCP浓度的变化,金纳米的状态没有明显变化,最大吸收峰都在520 nm左右,说明PCP和Au NPs之间没有反应。

图4 10 μL不同浓度PCP(从1到3浓度分别为0,3 nmol/L,3 mmol/L)与 100 μL Au NPs溶液混合均匀,在室温下孵育2h,加入4 μL 1 mol/L NaCl溶液后,最终溶液的紫外-可见光谱图。插图 为相应溶液的显色图Fig.4 The UV-vis spectrum of solution containing 10 μL PCP at different concentrations(1-3 corresponds to 0,3 nmol/L,and 3 mmol/L,respectively)and 50 mmol/L ssDNA after incubating in room temperature for 2 h and then addition of 4 μL 1 mol/L NaCl.Inset shows the corresponding photos.
2.2 最佳DNA含量的确定
分别在装有100 μL Au NPs中加入不同浓度的1 μL ssDNA,搅拌均匀,2 min后,分别加入 4 μL 1 mol/L氯化钠溶液,用相机拍下颜色,如图5。在NaCl的量一定的情况下,ssDNA太少了不能起到保护Au NPs不被盐聚沉的作用;太多了浪费试剂。采用1 μL的ssDNA,当其浓度小于50 μmol/L 时,金纳米溶胶在加入 4 μL 1 mol/L 氯化钠溶液的情况下发生明显的聚沉。综合考虑,该体系选择加入 1 μL 50 μmol/L的 DNA。

图5 加入1 μL不同浓度的ssDNA于100 μL Au NPs中,再加入4 μL 1 mol/L NaCl作用后的颜色对比图Fig.5 The photos of 100 μL Au NPs containing 1 μL ssDNA at different concentrations after addition of 4 μL 1 mol/L NaCl
2.3 五氯苯酚的无标记显色检测
前面的结果证实了五氯苯酚作为一种羟基自由基的消除剂,可以保护ssDNA不被羟基自由基损伤破坏,从而在Fenton试剂存在下,ssDNA仍然可以保护Au NPs在盐的作用下不聚集。Au NPs的聚集可产生肉眼可见的颜色变化。在稳定状态下,呈红色;发生聚集时,呈蓝色。五氯苯酚的无标记纳米金检测基于此原理建立。
在 5 μL 50 mmol/L的 ssDNA 中, 加入 5 μL不同浓度的五氯苯酚溶液混合,搅拌均匀,室温下反应 1 h,取 2 μL反应液加入到 100 μL Au NPs溶液中,室温下孵育2 min,再迅速加入4 μL 1 mol/L NaCl溶液,搅拌混匀。结果显示,五氯苯酚浓度越高,Au NPs越不容易变色。由于Au NPs聚集导致在520 nm处的吸收减弱,在650 nm处的吸收增强,因此采用两处吸光度的比值(A650/A520)表征PCP的浓度。如图6所示,A650/A520和PCP的浓度对数呈线性关系,线性范围:1 nmol/L到1 mmol/L。基于三倍噪音计算的检测限为0.5 nmol/L。
3 结论
该文基于五氯苯酚对氧化损伤ssDNA的保护作用,和ssDNA对金纳米粒子的保护作用,利用金纳米粒子聚集时颜色变化,提出了一种无标记纳米金显色检测五氯苯酚的方法。方法线性范围:1 nmol/L 到 1 mmol/L,检测限:0.5 nmol/L。

图6 五氯苯酚浓度(c)与吸光度比值的关系Fig.6 The calibration curve of PCP
[1]金相灿.有机化合物污染化学-有毒有机物污染化学[M].北京:清华大学出版社,1990.
[2]Crosby D G.Environmental chemistry of pentachlorophenol[J].International Union of Pure and Applied Chemistry,1981,53:1 051~1 080.
[3]郭家钢,郑江.中国血吸虫病流行与防治 [J].疾病控制杂志,2000,4(4):289~293.
[4]张宗炳.杀虫剂的分子毒理学[M].北京:农业出版社,1987.
[5]杨淑贞,韩晓冬,陈伟.五氯酚对生物体的毒性研究进展[J].坏境与健康杂志,2005,22(5):396~398.
[6]余刚,牛军峰,黄俊,等.持久性有机污染物——新的全球性环境问题[M].北京:科学出版社,2005.1~55.
[7]Wania F,MacKay D.Peer reviewed:tracking the distribution of persistent organic pollutants[J].Environmental Science&Technology,1996,30(9):390~396.
[8]王亚韡,蔡亚岐,江桂斌.斯德哥尔摩公约新增持久性有机污染物的一些研究进展 [J].中国科学,2010,4(2):99~123.
[9]MeyerA, KleibohmerW.Determination ofpentachlorophenol in leather usding supercritical fluid extraction with in situ derivatization [J].Journal of Chromatography A,1995,718(1):131~139.
[10]Gremaud E,Turesky R J.Rapid analytical methods to measure pentachlorophenol in wood[J].Journal of Agricultural and Food Chemistry,1997,45(4):1 229~1 233.
[11]Mardones C,Palma J,Sepúlved C,et al.Determination of tribromophenol and pentachlorophenol and its metabolite pentachloroanisole in Asparagus officinalis by gas chromatography/mass spectrometry[J].Journal of Separation Science,2003,26(9-10):923~926.
[12]Wu Y H.Nano-TiO2/dihexadecylphosphate based electrochemical sensor for sensitive determination of pentachlorophenol[J].Sensors and Actuators B:Chemical,2009,137(1):180~184.
[13]Li C,Kang Q,Chen Y,et al.Electrochemiluminescence of luminol on Ti/TiO2NT electrode and its application for pentachlorophenol detection[J].Analyst,2010,135(11):2 806~2 810.
[14]Kang Q,Yang L,Chen Y,et al.Photoelectrochemical detection of pentachlorophenol with a Multiple Hybrid Cd-SexTe1-x/TiO2Nanotube Structure-Based Label-Free Immunosensor[J].Anal.Chem.,2010,82(23):9 749 ~9 754.
[15]Awawdeh A M,Harmon H J.Spectrophotometric detection of pentachlorophenol(PCP)in water using immobilized and water-soluble porphyrins[J].Biosensors and Bioelectronics,2005,20(8):1 595~1 601.
[16]Li M,Tsai S F,Rosen S M,et al.Preparation of pentachlorophenol derivatives and development of a microparticle-based on-site immunoassay for the detection of PCP in soil samples[J].Journal of Agricultural and Food Chemistry,2001,49(3):1 287~1 292.
[17]Pavlov V,Xiao Y,Shlyahovsky B,et al.Aptamer-functionalized Au nanoparticles for the amplified optical detection of thrombin[J].Journal of the American Chemical Society,2004,126(38):11 768~11 769.

