基于氧化石墨烯/金纳米粒子放大电信号的二茂铁标记型溶菌酶适体传感器
仇晓雯,夏云峰,徐清皓,甘思文,黄杉生
(上海师范大学生命与环境科学学院,上海200234)
0 引言
类似于基于蛋白质的抗体,适配体是基于核酸的分子,用于选择性地结合与其有特异性吸附的分子的识别[1~2]。然而,相对于抗体识别目标物分子而言,适配体有很多的优势,比如通过SELEX技术体外筛选、选择性合成并富集,它们容易修饰,稳定性较高,容易储存,且不易发生变异和降解,并且对于目标物分子检测种类广泛[3]。这些突出的性质使得适体成为生物检测以及临床医学应用领域中理想的蛋白识别体,通过荧光分析[4~5],比色方法[6~7],微型比重分析[8],石英微天平[9],电化学方法[10~13]等。
相对其它分析方法,电化学适体传感器制备简便,易修饰,稳定性好和结合目标范围广等。适体传感器已越来越多地运用于各种物质的检测[14~15]。
该文选择具有良好导电性和生物相容性地石墨烯作为电极的基底材料,通过简单可控的电沉积法富集金纳米粒子,在金纳米粒子共价连接带有巯基的DNA双螺旋结构,该结构中含有一根标记有二茂铁甲酸作为电活性物质的适体探针链。区别于常见的通过目标物蛋白与适配体之间的特异性集合,导致单链DNA构型的改变进而引起电活性物质与电极表面距离的改变[16],最终引起的响应电流增强或衰减。该文的特别之处在于选择二茂铁甲酸修饰在适体探针链靠近电极表面的一端,使得相应电流得到一定程度的增强,一旦目标物蛋白结合导致适体探针链打开,部分标记物离开电极,直接导致电化学信号的衰减。
1 实验部分
1.1 仪器与试剂
电化学检测在CHI660C电化学工作站(上海辰华,中国)上完成;电化学装置为传统的三电极体系:玻碳电极作为工作电极,饱和甘汞电极和铂丝电极分别用作参比电极和对电极;电极修饰层形貌的扫描电镜图用S-4800场发射扫描电镜(Hitachi,日本)测定;DNA双链的退火是用PCR仪器AG22331(Eppendorf,德国)完成。
天然石墨粉(大小≤30 μm),硝酸,硫酸,氯酸钾,乙醇,肼,过氧化氢(H2O2),由上海化学试剂公司提供;氯金酸(HAuCl4)、二茂铁甲酸(Fc)、萘酚(nafion)、Tris-HCl、Ru(NH3)6Cl3及退火 buffer购于国药集团上海分公司;1-乙基-3-(3-二甲基氨丙基)碳化二亚胺盐酸盐(EDC·HCl)、N-羟基琥珀酰亚胺(NHSS)均购于上海阿拉丁试剂;溶菌酶(Lysozyme)购于 Amresco(美国)公司;磷酸盐缓 冲 溶 液 (PBS,pH=7.4)由 0.1 mol/L KCl、Na2HPO4、NaH2PO4配制。实验中所用试剂均为分析纯,所用的水是Milli-Q18.2 MΩ水。
寡聚核苷酸序列由上海生工生物工程公司合成:
固定链序列 (comDNA):5'-GAT GAA TTC GTA GAT-SH-3'
适体探针链序列(aptDNA):5'-NH2-(CH2)6–ATC TAC GAA TTC ATC AGG GCT AAA GAG TGC AGA GTT ACT TAG-3'
1.2 实验步骤
1.2.1 石墨烯的制备及羧基化
石墨烯参照文献[17]所述方法制备。简单地说,在硝酸和硫酸的溶液中,石墨粉先用氯酸钾氧化120 h。石墨氧化后,加入过量的水至混合物中,用5%的盐酸溶液冲洗,然后重复用水冲洗直到pH值为中性。然后将氧化态的石墨分散在乙醇和水的混合溶液中,超声1 h。分层后,氧化态石墨用肼还原20 h,形成石墨烯片。最后,石墨烯片经离心、洗涤、真空干燥后,使之带有羟基和羧基。图1为成功合成的石墨烯透射电镜图。

图1 石墨烯的透射电镜图Fig.1 FE-TEM image of graphene
石墨烯的改性在文献报道的方法上稍作一些改进。石墨烯在超声协助下进行混酸处理4 h,混酸由硫酸和硝酸(体积比3∶1)组成,温度控制在70℃的水中超声,再用过氧化氢 (质量分数20%)溶液处理2 h。弃去滤液,羧基化石墨烯用水冲洗直至中性后干燥。通过傅里叶变换红外光谱分析(图2),由在1 700 cm-1波长处可以断定这种氧化处理方法可以在石墨烯表面产生—COOH基团。

图2 羧基化的石墨烯红外谱图Fig.2 FT-IR image of carboxylic graphene
1.2.2 电极的制备
玻碳电极 (Φ =3 mm)分别用 1.0、0.3、0.05 μm的氧化铝粉末抛光,直至产生一个光亮、平滑的表面。电极分别置于超纯水,无水乙醇、超纯水里超声清洗3 min后,用氮气将其表面吹干。2 mg的氧化石墨烯分散于质量分数为5%nafion溶液中,超声0.5 h,取4 μL该溶液滴涂于玻碳电极表面,在空气中晾干,形成一层氧化石墨烯萘酚复合膜,用水冲洗晾干,得到的电极记作为GO/GCE。然后将GO/GCE浸入1 mmol/L的HAuCl4溶液中,采用循环伏安法,电位设定在-0.1~-0.3 V,扫速为 0.1 V/s,电沉积 300 s,用双蒸水冲洗,得到AuNPs/GO/GCE修饰电极。
修饰电极的最后一个步骤是dsDNA的固定。 首先取 comDNA (50 μmol/L)20 μL、aptDNA(60 μmol/L)25 μL、10 μL 退火 buffer(100 mmol/L Tris+1 mol/L NaCl+0.5 mol/L EDTA pH=7.4)、45 μL水共100 μL液体置于PCR仪中,采用程序升温并退火,使其在95℃下恒温10 min,并且以1℃/min的速率降至室温,得到稳定的DNA双螺旋结构,最终comDNA及aptDNA的浓度分别为10 μmol/L、15 μmol/L,保存于 4 ℃冰箱里。
为了避免产生不稳定的中间体,我们选用二茂铁甲酸(Fc)23 mg(0,1 mmol/L)、1-乙基-3-(3-二甲基氨丙基)碳化二亚胺盐酸盐(EDC·HCl)23 mg(0.12 mmol/L)、N-羟基琥珀酰亚胺 (NHSS)32 mg(0.15 mmol/L)溶解于 10 mL无水 DMF溶液中,密封置于冰箱1 h使其充分活化。
取 6 μL dsDNA退火液滴涂于 AuNPs/GO/GCE表面,通过Au-S键将其组装至电极上,密封常温下放置 20 h,用 PBS(pH=7.4)溶液冲洗表面,以除去物理吸附的物质。然后取20 μL活化后的二茂铁甲酸DMF混液滴于电极上,密封冻存3~4 h,使二茂铁甲酸共价标记于适体探针链含氨基的5’端,再用PBS冲洗干净,最后在电极表面滴上 20 μL 10 mmol/L 的巯基己醇,0.5 h 后洗去,得到修饰成功的dsDNA/AuNPs/GO/GCE电极。基于氧化石墨烯/金纳米粒子放大电信号的二茂铁标记型溶菌酶适体传感器如图3所示。
1.2.3 目标物溶菌酶的孵化和电化学测定

图3 基于氧化石墨烯/金纳米粒子放大电信号的二茂铁标记型溶菌酶适体传感器原理图Fig.3 Schematic of aptamer based on carboxylic graphene and Au nanoparticles for detection of lysozyme
通过优化实验条件,最终选择适体DNA链和溶菌酶的特异性结合选择温度为37℃,将dsDNA/AuNPs/GO/GCE浸入在含不同浓度的溶菌酶(PBS,pH=7.4)溶液中反应约1 h时间。之后用PBS溶液洗去未发生结合的溶菌酶。
反应后的电极以底液 PBS(0.1 mol/L,含 KCl,pH7.4)进行电化学测试,示差脉冲伏安法(DPV)的测定从 0.6 V~0.0 V,脉冲广度为 0.1 V,脉冲宽度为0.05 S。此时,二茂铁甲酸的特征还原峰电位在 0.25 V 处,峰电流在 1~10 μA 范围内。
2 结果和讨论
2.1 电极表面膜的扫描电镜图
2.1.1 电极表面修饰氧化石墨烯萘酚膜的FESEM表征
以场发射扫描电子显微镜(FE-SEM)表征了在电极表面的氧化石墨烯萘酚膜的形貌 (图4)。从图4(左)中可以看出,电极表面有许多的层状的氧化石墨烯。放大至4(右)图,石墨烯单层的带有褶皱的结构清晰可见,由此说明萘酚作为溶剂对于石墨烯在电极表面的固定非常好。并且大大提高了电极的表面积,为金纳米粒子的生长提供了更多的平台。

图4 固定有氧化石墨烯萘酚膜的玻碳电极FE-SEM图(左)和放大后的氧化石墨烯层状结构FE-SEM图(右)Fig.4 FE-SEM of Oxidized grapheme-Nafion film coated on glaasy carbon electrode(left)and magnification of it(right)
2.1.2 氧化石墨烯电极沉积金纳米粒子后的FE-SEM表征
通过固定程序的伏安法将氯金酸中金离子还原为单质,电极表面形貌发生了很大变化(图5)。通过图5(左)可以看出,金纳米粒子均匀的生在于氧化石墨烯的片层表面之上,而图5(右)为放大后金纳米粒子,经过测量统计,金纳米粒子的直径在20~30 nm范围内,并形成团簇。

图5 沉积金后的氧化石墨烯电极(左)和放大后的金纳米粒子(右)Fig.5 FE-SEM of Au nanoparticles electro-deposition on GO/GCE(left)and magnification of it(right)
2.2 dsDNA/AuNPs/GO/GCE电极电化学表征
2.2.1 修饰电极的交流阻抗表征
图6描绘了不同修饰层的电化学交流阻抗图,底液选择在 10 mmol/L Fe(CN)63-/4-(0.1 mol/L KNO3)进行。 参数设置为:频率从 0.05 Hz到10 KHz,ac激发振幅为5 mV。发现当玻碳电极经氧化石墨烯萘酚膜修饰后(曲线b),阻抗由原来的裸电极 200 Ω(曲线 a)变为 1500 Ω 左右,其原因可能是萘酚作为一种有机溶剂有较大的电阻。然而萘酚的使用有利于氧化石墨烯在电极表面的固定。当金纳米粒子沉积成功后(曲线c),由于纳米金良好的导电性能以及较高的比表面积,阻值减小到80 Ω以内,导电性强于裸的玻碳电极。说明金作为一种极好的导电物质,大大促进了Fe(CN)63-/4-之间电子的迁移。当含有适体探针链的双链DNA修饰上电极之后(曲线d),阻值再次增大至 750 Ω,远大于 80 Ω,这表明 dsDNA的共价固定是成功的,并由于双链DNA自身的磷酸骨架带一定量的负电荷,阻碍了电子之间的迁移。

图6 不同修饰层电极的阻抗谱图GCE(a)、GO/GCE(b)、AuNPs/GO/GCE(c)、dsDNA/PdNPs/GO/GCE(d)在 10 mmol/L Fe(CN)63-/4-(0.1 mol/L KNO3)溶液中的电化学阻抗图Fig.6 The EIS image of different layers modified electrodes
2.2.2 计时库伦—电化学有效表面积的测定
裸玻碳电极、AuNPs/GCE、AuNPs/GO/GCE修饰电极的电化学有效表面积可以利用计时库仑法,通过Anson公式计算出来[18~19]:

上面式中,A为工作电极的电化学有效表面积,c为底物浓度,D为扩散系数,Qdl是双电层电荷(可通过背景扣除),Qads是法拉第电荷。我们将Q与t1/2线性拟合,得到斜率值。若n、c、D已知,则A值即可通过计算获得。
计时库仑法实验是在含有0.1 mmol/L K3[Fe(CN)6](0.1 mmol/L KCl)溶 液 中 进 行 的 (图7)。根据文献报道,K3[Fe(CN)6]的扩散系数为7.6×10-6cm2/s[20]。

图7 GCE、AuNPs/GCE、AuNPs/GO/GCE 在 0.1 mmol/L K3[Fe(CN)6](含有 0.1 mmol/L KCl)中的计时库仑图Fig.7 Chronocoulometry image of diferrent modified layers modified electrode

图8 GCE、AuNPs/GCE、AuNPs/GO/GCE Q 与 t1/2线性关系图Fig.8 Linear relationship image of coulomb to t1/2
通过图8并进行计算,得到裸玻碳电极、金纳米电极、金纳米氧化石墨烯电极的有效表面积大小 分别为 0.000 48 cm2、0.001 2cm2和 0.004 5 cm2。这可能是由于氧化石墨烯带有褶皱的层状结构,为金纳米粒子的生长提供了较大的表面积,而金本身有较多的活性位点,为下一步中带有巯基的双链DNA双链的固定提供了更大的效率。此外,电极的有效表面积越大,则说明电极表面修饰的物质活性越好,进而电极响应越灵敏。实验结果表明修饰氧化石墨烯和金纳米粒子成功后,电极有效表面积大大增加,电流响应和灵敏度也明显得到相应地提高。
2.3 溶菌酶检测条件的优化
溶菌酶与适体探针链的特异性结合与时间及温度密切相关。温度过低时,溶液中的溶菌酶扩散速率缓慢,需要较长的反应时间;如果温度高于DNA的解链温度时(Tm=67℃),电极上固定的dsDNA双螺旋结构会遭到破坏,则标记有活性分子二茂铁甲酸的适体探针链会相应减少,导致电化学响应信号的减弱。该实验最终选择反应温度在37℃。此外,分析测定的持续时间和灵敏度也受溶菌酶反应时间的影响,随着结合时间的推移,溶菌酶与适体探针链的特异性结合效率持续升高,直至1 h后,基本保持稳定,所以该实验选择溶菌酶反应时间为1 h。
2.4 初步应用
2.4.1 浓度信号关系曲线
dsDNA/AuNPs/GO/GCE修饰电极的DPV响应随着溶菌酶浓度的增加而持续衰减(图9)。对每一个实验点进行三次平行测定,取平均值并计算其误差,通过非线性拟合得到如图10的DPV电流相应值对目标物溶菌酶的关系图。方程为Ip.c(μА)=5.76×10-4c-0.29(c是目标物溶菌酶的浓度,mol/L;Ip.c是电极的还原峰电流,μA;),曲线的回归系数为0.997 8,该电极对于溶菌酶的检出限是6.02×10-12mol/L。
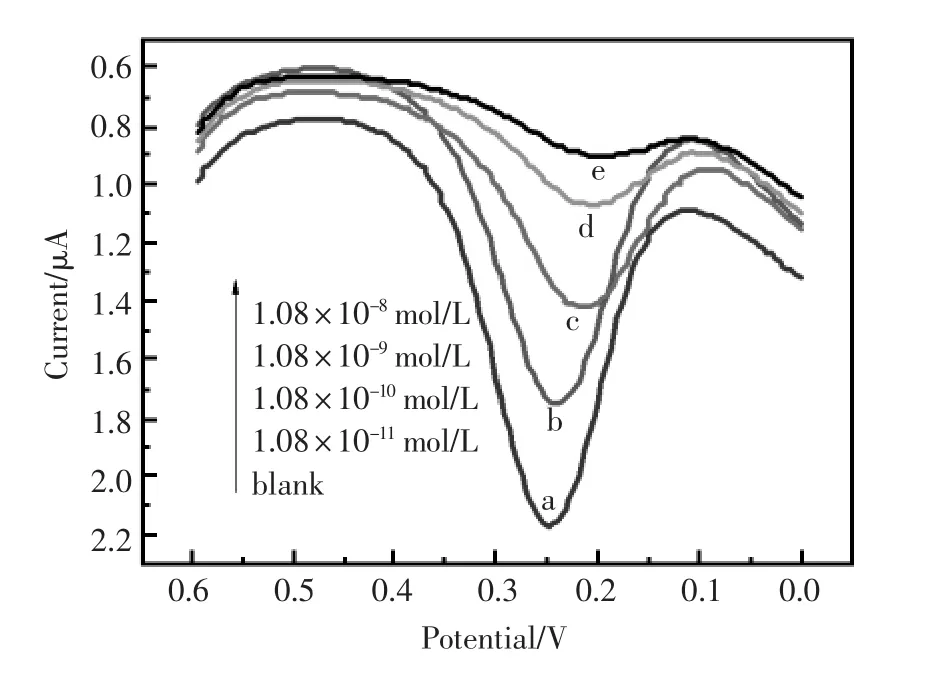
图9 dsDNA/AuNPs/GO/GCE孵化了不同浓度(mol/L)溶菌酶后的DPV响应图:(a)0(b)1.08×10-11(c)1.082×10-10(d)1.08×10-9(e)1.08×10-8Fig.9 DPV response of the dsDNA/AuNPs/GO/GCE incubated with increasing concentration of lysozyme
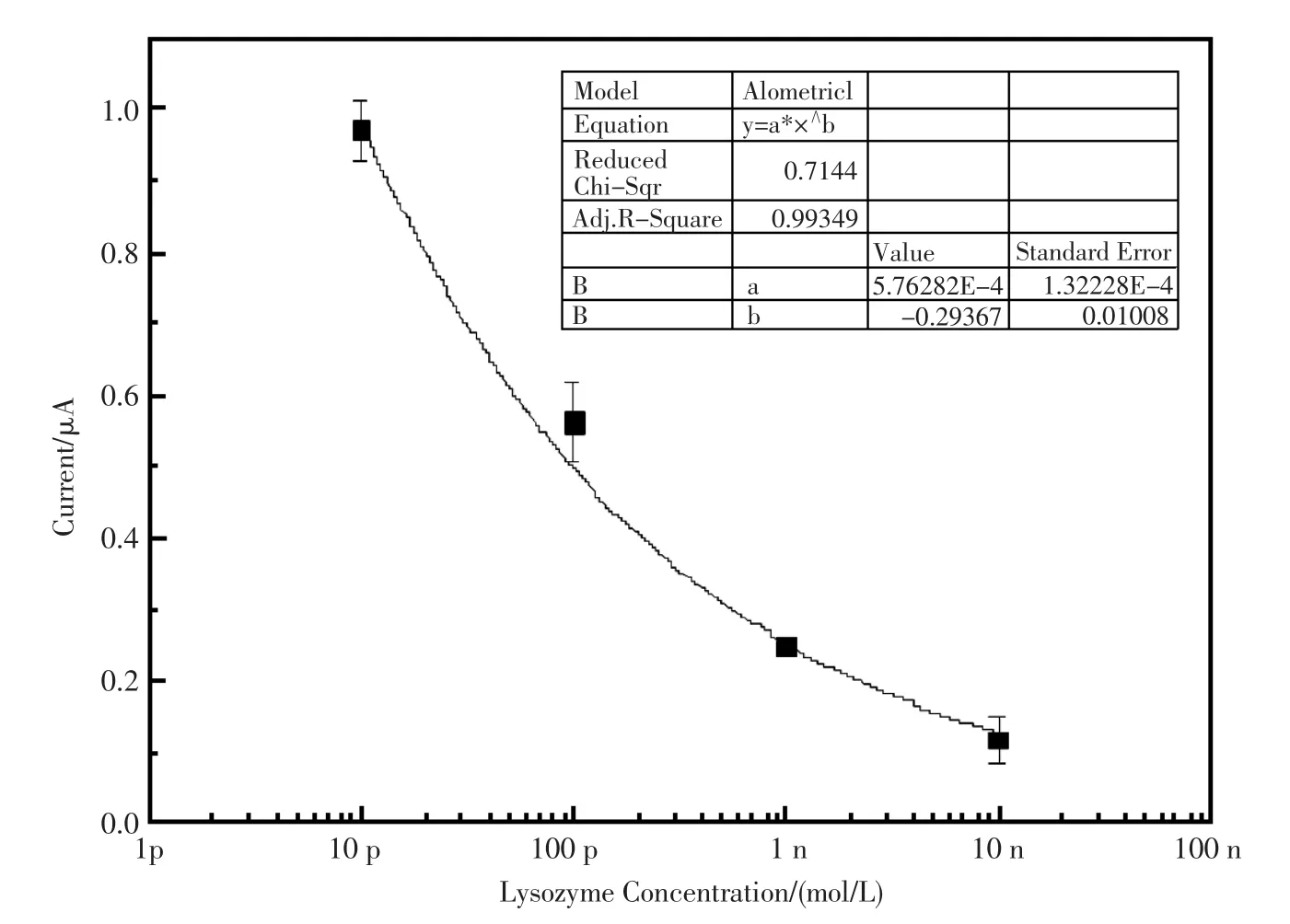
图10 DPV电流对相应溶菌酶浓度的标准非线性拟合曲线Fig.10 the nonlinear calibration curve of the aptamer
2.4.2 干扰物实验
考察了dsDNA/AuNPs/GO/GCE传感器对于溶菌酶检测的特异性,选择免疫球蛋白(IgG)、细胞色素 C(CytC)、牛血清蛋白(BSA)、牛血红蛋白(Bhb)这几种非特异性吸附的蛋白物质进行检测,与被测物溶菌酶进行比对,结果示于图11。测定的各种蛋白浓度均在相同数量级,其中C(Lysozyme)=1.08×10-8,C(IgG)=3.33×10-8,C(CytC)=1.0×10-8, C(BSA)=1.0×10-8, C(Bhb)=1.0×10-8(mol/L)。实验发现,虽然对于溶菌酶的检测存在一定程度的干扰,但是相对于其目标物本身而言,干扰物的影响并不高,因此该适体传感器的特异性较好。
3 结论

图11 dsDNA/AuNPs/GO/GCE传感器对于目标物Lysozyme及 IgG、CytC、BSA、Bhb电流衰减度比对图Fig.11 the signal suppression of the aptamer after it reacted with lysozyme and other interferents
基于氧化石墨烯为基底的金纳米粒子放大信号的标记型传感器检测溶菌酶,方法简单快捷,石墨烯的生物相容性和金纳米的出色导电性和大的表面积进一步提高了电活性物质的负载量,响应电流得到增强。该适体传感器响应快,特异性好,对于目标物的检测范围较宽,是一种高灵敏度、选择性好的溶菌酶检测方法。
[1]Ellington A D,Szostak J W.In vitro selection of RNA molecules that bind specif i c ligands[J].Nature,1990,346(6287):818~822.
[2]Tuerk C,Gold L.Systematic evolution of ligands by exponential enrichment: RNAligands to bacteriophage T4DNApolymerase[J].Science,1990,249(101126):505~510.
[3]Tombelli S,Minunni M.Analytical applications of aptamers[J].Biosens.Bioelectron.,2005,20(12):2 424 ~2 434.
[4]Yang R H,Tang Z W,Yan J L,et al.Noncovalent assembly of carbon nanotubes and single-strande DNA;An effective sensing platform for probing biomolcular interactions[J].Analytical Chemistry,2008,80(19):7 408~7 413.
[5]Dong H,Gao W,Yan F,et al.Fluorescence resonace energy transfer between quantum dots and grapehne oxide for sensing biomolculars[J].Analytical Chemistry,2010,82(13):5 511~5 517.
[6]Song Y J,Qu K G,Zhao C,et al.Grapehne oxide:Intrinsic peroxidase catalytic activity and its application to gucose detection[J].Advanced Materials,2010,22(19):2 206~2 210.
[7]Ai K L,Liu Y L,Lu L H.Hydrogen bonding recognitioninduced color change of gold nanoparticles for visual detection of melamine in raw milk and infant formula[J].J.Am.Chem.Soc.,2009,131(27):9 496~9 497.
[8]Joo J,Kwon D,Yim C,et al.Highly Sensitive Diagnostic Assay for the Detection of Protein Biomarkers Using Microresonators and Multifunctional Nanoparticles[J].ACS Nano,2012,6(5):4 375~4 381.
[9]Liss M,Petersen B,Wolf H,et al.An aptamer-based quartz crystal protein biosensor[J].Anal.Chem.,2002,74(17):4 488~4 495.
[10]Baker B R,Lai R Y,Wood M S,et al.An electronic,aptamer-based small-molecule sensor for the rapid,labelfree detection of cocaine in adulterated samples and biological f l uids[J].J.Am.Chem.Soc.,2006,128(10):3 138~3 139.
[11]Zuo X L,Song S P,Zhang J,et al.Atarget-responsive electrochemical aptamer switch (TREAS)for reagentless detection of nanomolar ATP[J].J.Am.Chem.Soc.,2007,129(5):1 042~1 043.
[12]Jin Y,Yao X,Liu Q,et al.Hairpin DNA probe based electrochemical biosen-sor using methylene blue as hybridization indicator[J].Biosens.Bioelectron.,2007,22(6):1 126~1 130.
[13]Zayats M,Huang Y,Gill R,et al.Label-free reagentless aptamer based sensors for smallmolecules[J].J.Am.Chem.Soc.,2006,128(42):13 666~13 667.
[14]Zhao J,Zhang Y,Li H.Ultrasensitive electrochemical aptasensor for thrombin based on the amplif i cation of aptamer–AuNPs–HRP conjugates[J].Biosensors and Bioelectronics,2011,26(5):2 297~2 303.
[15]Bai J,Wei H,Li B.[Ru(bpy)2(dcbpy)NHS]Labeling/Aptamer-Based Biosensor for the Detection of Lysozyme by Increasing Sensitivity with Gold Nanoparticle Amplification[J].Chem.Asian J.,2008,3:1 935~1 941.
[16]Radi A,Acero J L,nchez S.Reagentless,Reusable,Ultrasensitive Electrochemical Molecular Beacon Aptasensor[J].J.Am.Chem.Soc.,2006,128:117~124.
[17]Bo Y,Yang,H Y,et al.A novel electrochemical DNA biosensor based on graphene and polyaniline nanowires[J].Electrochimica Acta,2011,56(6):2 676~2 681.
[18]Zhang M G,Smith A,Gorski W.Carbon Nanotube-Chitosan System for Electrochemical Sensing Based on DehydrogenaseEnzymes[J].Anal.Chem.,2004,76(17):5 045~5 050.
[19]Bott A W,Heineman W R.Chronocoulometry[J].Current Separations,2004,20:121~126.
[20]Adams R N.Electrochemistry at Solid Electrodes[M].New York:Marcel Dekker,1969.220~221.

