枣树ZjAPX基因的原核表达
张晓娟 ,郝子琪 ,杨大威 ,孟玉平 ,曹秋芬
(1.山西大学生物工程学院,山西太原 030006;2.山西省农业科学院生物技术研究中心,山西太原 030031;3.山西农业大学研究生院,山西太谷 030801)
植物是一个需氧代谢的有机体,在呼吸和光合作用过程中均会导致活性氧(Reactive Oxygen Species,ROS)含量的提高。当ROS积累到一定水平便会对植物造成一定的伤害。植物为了抵御氧化胁迫,建立了相应的清除活性氧的体系。在植物叶绿体和胞质中,有一种H2O2清除系统称为抗坏血酸-谷胱甘肽(AsA-GSH)循环,其中,抗坏血酸过氧化物酶(APX)是这个循环的关键酶之一[1-3]。有研究表明,高等植物中APX在清除活性氧时,对底物抗坏血酸(ascorbic acid,ASA)有极高的专一性,且ASA在较低水平就能发挥作用[3]。
Halliwell等[4]于1976年首先发现了过氧化物酶。1981年,Nakano等[5]才正式确定其为抗坏血酸过氧化物酶。在之后30 a的研究中发现,提高植物体内抗氧化酶活性和增强抗氧化代谢水平是提高植物抗逆性的有效途径之一。APX能提高氧化耐受性的作用已在许多植物中报道,目前,多种植物的APX基因已被克隆并应用于植物转基因的研究[6]。但对于木本果树植物,因其遗传背景非常复杂,研究它们的APX基因也有很大难度,至今仅克隆到了苹果的APX基因[7]和葡萄抗白粉病的APX基因[1,3]。
枣树是我国黄土高原上古老的果树,具有耐瘠薄、抗逆性强等许多优良特性。挖掘和研究枣树的抗逆性基因对于植物的环境胁迫研究及品种改良具有十分重要的意义。因此,本研究从山西省农业科学院生物技术研究中心构建的枣树结果枝cDNA文库中筛选获得了抗坏血酸过氧化物酶基因cDNA序列,并进行了原核表达载体的构建和蛋白诱导表达的研究,旨在为枣树抗坏血酸过氧化物酶基因生物学功能的深入研究奠定基础。
1 材料和方法
1.1 材料
枣树抗坏血酸过氧化物酶基因(ZjAPX)cDNA序列从山西省农科院生物技术研究中心构建的壶瓶枣(Ziziphus jujubaMill hupingzao)结果枝cDNA文库[8]中随机筛选获得。所用载体有:克隆载体pSPORT1,原核表达载体pGEX-4T-2,大肠杆菌菌株BL21(DE3)。琼脂糖凝胶DNA回收试剂盒QIAquick购自QIAGEN公司;限制性内切酶BamHⅠ和SmaⅠ,T4 DNA连接酶,DNA Marker等均购自大连宝生物工程有限公司。氨苄青霉素、IPTG、丙烯酰胺等化学试剂购自上海生工生物工程技术服务有限公司。
1.2 方法
1.2.1 枣树抗坏血酸过氧化物酶基因(ZjAPX)cDNA的氨基酸序列分析 用序列处理在线工具包(SMS)(http://www.bio-soft.net/sms/index.html)翻译其核苷酸序列。
1.2.2ZjAPX原核表达载体的构建及鉴定 根据ZjAPX核苷酸序列选择其中648 bp(106~753 bp)设计特异性引物(引物由上海生工生物工程技术服务有限公司合成),上游引物为:5'-AT GGATCCATGCTACGCCTTGCATG-3'(下划线处为BamHⅠ位点);下游引物为:5'-ATCCCGGGT TAAGCATCAGCAAATC-3'(下划线处为SmaⅠ位点);利用PCR的方法获得其cDNA片段。PCR反应体系为:10×PCR buffer 5 μL(含 Mg2+),dNTP1μL,上下游引物各 1 μL(20 pmol/L),rTaq聚合酶 0.3 μL,模板 DNA 1 μL(1.0 μg/μL),灭菌超纯水40.7 μL,总体积50 μL。扩增条件为:95℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸1 min,共30个循环;最后 72℃延伸10 min。
将获得的cDNA片段用BamHⅠ和SmaⅠ双酶切目的基因片段及pGEX-4T-2载体,用QIAquick凝胶回收盒对双酶切产物进行纯化。
○R在T4 DNA连接酶的作用下,将目的基因定向克隆到pGEX-4T-2载体上,将重组质粒转化至大肠杆菌BL21(DE3)感受态细胞中,进行蓝白斑选择,对阳性菌落提取质粒,并用限制性内切酶对重组质粒(pGEX-4T-2-ZjAPX)进行酶切鉴定。将鉴定的含有片段的阳性菌株送往上海生工生物工程技术服务有限公司测序,验证重组质粒读码框的正确性。
1.2.3 ZjAPX蛋白的原核表达 挑取1.2.2读码框正确的pGEX-4T-2-ZjAPX菌液于37℃振荡培养过夜,第2天按1/100接菌,培养至OD600值为0.5左右,加入IPTG,至终培养液内IPTG浓度为1.0 mmol/L诱导培养,4 h后取2 mL菌液用于SDS-PAGE电泳,检测蛋白有无表达[9],以不含插入子的空载体pGEX-4T-2转化BL21(DE3)作为空白对照;设 IPTG终浓度为 0.1,0.4,0.8,1.0,1.2,1.6 mmol/L,观察不同浓度IPTG在诱导4 h后蛋白的表达量;IPTG终浓度为1.2 mmol/L条件下,分别诱导 1,2,3,4,5,6 h 取样,观察不同诱导时间下蛋白的表达量。
2 结果与分析
2.1 ZjAPX基因cDNA序列及编码的氨基酸序列特征
ZjAPX基因是从山西省农业科学院生物技术研究中心构建的壶瓶枣结果枝cDNA文库中筛选得到的抗坏血酸过氧化物酶基因,其cDNA序列及编码的氨基酸序列如图1所示。

2.2 ZjAPX原核表达载体的构建
PCR扩增后电泳观测得出,在500~750 bp之间、靠近750 bp的1条带,与所设计的扩增目的片段大小吻合。
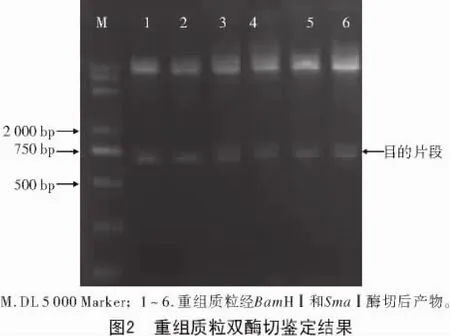
将PCR产物和pGEX-4T-2载体进行连接、酶切,鉴定结果如图2所示,双酶切片段约为750 bp,与预期结果相符。测序结果表明,该转化菌的质粒中确实含有目的片段,且读码框正确,表明重组载体pGEX-4T-2-ZjAPX构建成功。
2.3 ZjAPX基因在E.coli体内的表达
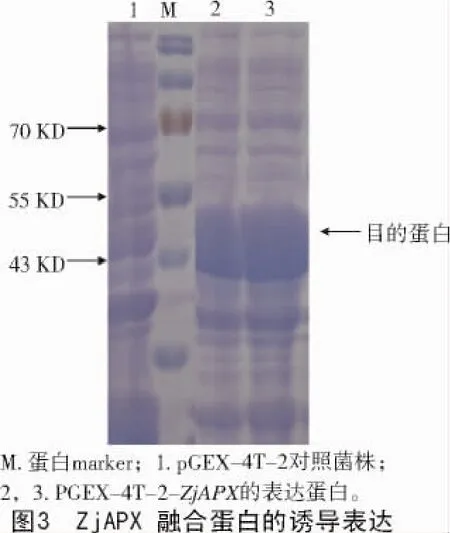
含有重组载体pGEX-4T-2-ZjAPX和空载体pGEX-4T-2的菌株过夜培养后,1.0 mmol/L的IPTG诱导4 h,观察蛋白的表达。结果(图3)表明,pGEX-4T-2-ZjAPX菌株在大约48 KD处诱导出1条较粗的蛋白条带(GST大小约26 KD,目的蛋白大小为23.62 KD),而对照菌株pGEX-4T-2没有该条带。
进一步分析不同浓度IPTG和不同诱导时间对ZjAPX蛋白表达量的影响,结果显示,分别加入 0.1,0.4,0.8,1.0,1.2,1.6 mmol/L 的 IPTG 诱导蛋白表达时,当浓度为1.2 mmol/L时,诱导蛋白的表达量最大(图4);浓度为1.2 mmol/L时,分别诱导 1,2,3,4,5,6 h 后取样进行 SDS-PAGE电泳,结果表明,诱导5 h,ZjAPX蛋白的表达效果最好(图5)。由此证明,ZjAPX蛋白在IPTG浓度为1.2 mmol/L、诱导5 h时,表达效果最好。


3 讨论
抗坏血酸过氧化物酶存在于植物、真核藻类及某些蓝细菌中[10]。另外,在家蝇[11]中也检测出APX活性。APX作为重要的抗氧化酶在清除活性氧的过程中起着重要作用。在高等植物中,APX具有4种不同细胞定位的同工酶:微体APX(mbAPX)、胞质 APX(cAPX)、叶绿体(sAPX和 tAPX)和过氧化体 APX(miAPX)[12-13]。APX催化的反应为:2AsA+H2O2→MDA(单脱氢抗坏血酸)+2H2O。APX是以抗坏血酸为电子供体,对底物AsA有极高的专一性[14],在氧化AsA的同时,将H2O2还原为H2O,是AsA的主要消耗者[15]。在APX活性提高的同时,反应底物也需要同时增加,这样催化反应才能继续,才能清除更多的活性氧。人们已从番茄、烟草、玉米、棉花、拟南芥等植物中克隆了APX基因,并进行了部分转基因植物的研究。Kornyeyev等[16]获得了转叶绿体APX基因的棉花植株,APX在植物体内过量表达,其叶片中APX活性比野生型提高了5倍,转基因棉花具有较高的PSⅡ光化学活性和抗氧化能力。Murgia等[17]研究结果表明,过量表达拟南芥tAPX基因能增加对百草枯引起的氧化胁迫的抗性。Xu等[18]获得转大麦HvAPX1的拟南芥植株,其对盐的耐性增强。Shi等[19]转自大麦的HvAPX1提高了拟南芥对高温胁迫的抗性[19]。Wang等[20]获得的转tAPX烟草植株,其APX活性明显提高,抗低温的能力也增强。Charles等[21]在研究大豆cAPXs中观察到,APX的转录、翻译和翻译后调控可能增强农作物抵抗环境胁迫的能力。
本研究从枣树cDNA文库中筛选得到了ZjAPX基因的cDNA全序列,用序列处理在线工具包(SMS)翻译出核苷酸序列;将其构建原核表达载体,成功诱导了蛋白表达,为进一步研究枣树ZjAPX基因表达蛋白奠定了基础。枣树原产于黄土高原,其体内具备适应土壤瘠薄、干旱等逆境条件的抗氧化防御系统,我们已经构建了枣树ZjAPX的植物表达载体[22],将进一步进行植物体内ZjAPX功能的探讨。
[1]赵伟.中国野生葡萄抗坏血酸过氧化物酶基因的原核表达抗体制备[D].杨凌:西北农林科技大学,2006.
[2]Welinder KG.Bacterial catalase-peroxidases are gene duplicated members of the plant peroxidase superfamily[J].Biochem Biophys Acta,1991,1080:215-220.
[3]林玲.中国华东葡萄抗坏血酸过氧化物酶基因的原核表达抗体制备[D].杨凌:西北农林科技大学,2006.
[4]Halliwell B,Foyer CH.Ascorbic acid,metal Ions and the superoxde radical[J].Biochemical Journal,1976,155(3):697-700.
[5]Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplaste[J].Plant Cell Physiol,1981,22(5):867-880.
[6]王超.白桦抗坏血酸过氧化物酶基因克隆及表达法分析[J].东北林业大学学报,2009,37(3):79-88.
[7]粟霞.苹果抗坏血酸过氧化物酶基因的克隆及其植物表达载体的构建[D].杨凌:西北农林科技大学,2007.
[8]孟玉平,曹秋芬,孙海峰,等.枣结果枝cDNA文库的构建与部分 ESTs分析[J].华北农学报,2009,24(5):102-106.
[9]张传义,孟玉平,孙海峰,等.苹果AFL1基因原核表达载体的构建及其在大肠杆菌中的表达 [J].山西农业科学,2008,36(7):14-16.
[10] Mathews M C,Summers C B,Felton G W.Ascorbate peroxidase:a novel antioxidant enzyme in insecte[J].Archive ofInsect Biochemistryand Physiology,1997,34(1):57-68.
[11]郝友进,渠晖,安春菊,等.家蝇幼虫体内过氧化物酶过氧化氢酶抗坏血酸过氧化物酶与抗药性的关系:I.H2O2对酶活性的影响[J].农业环境科学学报,2004,23(5):954-957.
[12]Mittle R,Zilinskas B A.Molecular cloning and characterization ofa gene encodingpea cytosolic ascorbate peroxidase[J].J Biol Chem,1992,267:21802-21807.
[13] Ishikawa T,Sakai K,Yoshimura K,et al.cDNAs encoding spinach stromal and thylakoid-bound ascorbate peroxidase,differing in the presence or absence of their 3′-coding regions[J].FEBSLett,1996,384:289-293.
[14]Welinder K G.Bacterial catalase-peroxidases are gene duplicated members of the plant peroxidase superfamily[J].Biochem Biophys Acta,1991,1080:215-220.
[15] Conklin P L.Recent advance in the role and biosynthesis of ascorbic acid in plants[J].Plant Cell and Envi,2001,24:383-394.
[16]Kornyeyev D,Dmytro K,Barry A,et al.Enhanced photochemical light utilization and decreased chilling-induced photoinhibition of photosystemⅡin cotton overexpression genes encoding chloroplast-targeted antioxidant enzymes[J].Physiologia Plantarum,2001,133:323-331.
[17] Murgia L,Tarantino D,Vnanini C,et al.Arabidopsis thalianaplants overexpressing thylakoidal ascoabate peroxidase show increased resistance to paraquat-induced photooxidative stress and to nitric oxida-induced cell death [J].Plant Journal,2004,38:940-953.
[18]Xu W F,Shi W M,Ueda A,et al.Mechanisms of salt tolerance in transgenicArabidopsis thalianacarrying a peroxisomal ascorbate peroxidase gene from barley[J].Pedosphere,2008,18(4):486-495.
[19] Shi W M,Muramoto Y,Ueda A,et al.Cloning of peroxisomal ascorbate gene from barly and enhanced thermotolerance by overexpressing inArabidopsis thaliana[J].Gene,2001,273:23-27.
[20] Wang W Q,Li B,Meng Q W.The sequence ofLycopersicon esculentumthylakoid-bound ascorbate peroxidase genetAPX[J].Journal of Plant Physiology and Molecular Biology,2002,28(6):491-492.
[21] Charles R,Frank J,Michael B.Identification of two cytosolic ascorbate peroxidase cDNAs from soybean leaves and characterization oftheir products byfunctional expression inE.coli[J].Planta,1998,204:120-126.
[22]郝子琪,许洪仙,孟玉平,等.枣树抗坏血酸过氧化物酶基因ZjAPX生物信息学分析及植物表达载体的构建[J].山西农业科学,2011,39(5):400-403.

