严重脓毒症患儿血小板减少原因剖析及处理对策分析
刘连凤,李 敏,于永慧,王玉娟,孙印兰,赵金芳
(山东大学附属省立医院,山东 济南 250021)
严重脓毒症是由于微生物侵入人体、机体对感染失控的应答而导致的全身炎症反应综合征,临床可表现为组织灌注变化、代谢改变、免疫功能紊乱、多器官功能障碍综合征(MODS)等[1]。其重要的病理生理学机制之一就是全身凝血系统活化,抗凝因子消耗,纤溶系统受抑,凝血功能紊乱及致死性MODS[2]。骨髓造血功能是最常受累器官之一,其重要表现为外周血小板计数(PLT)下降[3]。本文结合血常规、凝血功能检测及骨髓细胞学检查,探讨严重脓毒症患儿血小板减少的原因及其有效的处理措施。
1 资料与方法
1.1 一般资料及诊断标准
选取2010年8月至2011年9月期间收住山东省立医院小儿重症医学科的72例严重脓毒症患儿,其中男51例,女21例;最大年龄10岁,最小年龄28 d。所有患儿均符合严重脓毒症诊断标准[3]。
PLT<80×109/L,为血小板减少症;PLT<50×109/L,为重度血小板减少症[4]。凝血功能障碍早期(Pre DIC)判断标准[5]:(1)明显出血倾向;(2)PLT进行性下降;(3)凝血酶原时间(PT)较正常延长或缩短3 s以上;(4)活化部分凝血酶原时间(APTT)较正常延长或缩短10 s以上;(5)血浆D 二聚体明显升高;(6)纤维蛋白原(Fib)<1.5 g/L或进行性下降。弥漫性血管内凝血(DIC)的诊断标准[5]:(1)存在易引起DIC的基础疾病;(2)有下列两项以上临床表现:多发性出血倾向、不易以原发病解释的微循环衰竭或休克、多发性微血管栓塞的症状体征,如皮肤、皮下、黏膜的栓塞、坏死及早期出现的肾肺脑等功能不全;(3)抗凝治疗有效;(4)有下列3项以上实验室检查异常:PLT<80×109/L或进行性下降;Fib<1.5 g/L或进行性下降;PT较正常延长3 s以上或呈动态变化、APTT较正常延长10 s以上。
对PLT减少患儿给予积极处理,在积极液体复苏及强有力抗感染治疗基础上,对PLT<50×109/L同时伴有凝血功能障碍者,积极输注新鲜单采血小板,同时给予小剂量肝素抗凝治疗;PLT<50×109/L同时伴有骨髓增生低下巨核系成熟障碍者,积极输注新鲜单采血小板,同时给予大剂量丙种球蛋白(IVIG)治疗。
1.2 研究方法
患儿入院当天和入院后第3、7 d分别取外周血测定血小板计数,入院后即刻查凝血功能,包括PT、APTT、Fib、凝血酶时间(TT)、血浆D 二聚体。对外周血象有两系或三系降低者即中性粒细胞绝对值<1.5×109/L,血红蛋白<90 g/L,和/或PLT<80×109/L者,选择胸骨为穿刺点行骨髓穿刺、骨髓细胞学检查。
所有患者根据预后分为生存组及死亡组。采用描述性资料病例对照研究方法,对所有病例进行个案前瞻性资料搜集,患儿入院日为起点,放弃/死亡或治愈/好转出院为终点。研究指标为入院当天和入院后第3、7 d血小板计数、骨髓细胞学、APTT、Fib、TT、血浆D 二聚体、PT、血小板减少患儿的各脏器功能障碍情况及不同处理措施治疗后患儿预后情况等,最后录入EXCEL建立数据库进行分析。
1.3 统计学分析
应用SPSS 16.0统计软件进行统计学分析,计量资料以(±s)表示,组间采用t检验,以α=0.05作为检验标准进行统计学分析。
2 结果
2.1 一般资料
72例严重脓毒症患儿中,治愈/好转58例(80.56%),其中伴有PLT减少21例(36.21%);放弃/死亡14例(19.44%),其中PLT<80×109/L 8例(51.74%),PLT<50×109/L 6例(42.86%)。14例放弃/死亡患儿中,因PLT重度减低/DIC所致重要脏器出血死亡6例,占死亡人数42.86%。
2.2 严重脓毒症患儿血小板动态变化
死亡组与存活组相比较,入院时血小板计数比较差异有统计学意义(P<0.05)。给予积极输注新鲜单采血小板治疗后3 d,两组患儿血小板计数都上升至正常范围,两组间比较差异无统计学意义(P>0.05)。在入院后7 d,死亡组患儿血小板计数呈现持续进行性下降,与存活组比较差异有统计学意义(P<0.05),见表1。
表1 72例严重脓毒症患儿血小板计数的动态变化(×109/L ±s)
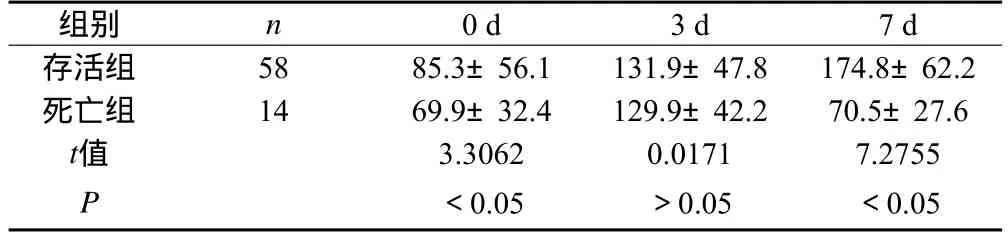
表1 72例严重脓毒症患儿血小板计数的动态变化(×109/L ±s)
组别 n 0 d 3 d 7 d存活组 58 85.3±56.1 131.9±47.8 174.8±62.2死亡组 14 69.9±32.4 129.9±42.2 70.5±27.6 t值 3.3062 0.0171 7.2755 P<0.05 >0.05 <0.05
2.3 血小板减少患儿入院时受累脏器及预后情况
血小板<80×109/L 29例患儿,入院时受累器官数目≥3个者19例(65.52%),死亡8例(27.59%);而血小板<50×109/L 13例患儿受累器官数目≥3个10例(76.92%),死亡6例(46.15%)。其中因PLT重度减低/DIC所致重要脏器出血死亡6例,占死亡人数42.86%。
2.4 凝血功能检测、骨髓细胞学检查及血小板减少原因剖析
72例严重脓毒症患儿发生Pre DIC 46例(63.89%);发生DIC 13例(19.70%),其中致重要脏器出血死亡6例(46.15%)。
72例患儿中有28例行骨髓细胞学检查。结果显示,粒细胞增生明显活跃者伴有中毒颗粒者11例(39.29%),粒系增生减低或明显减低6例(21.43%);巨核系成熟障碍、产板巨明显减少9例(32.14%);红系增生减低或明显减低15例(53.57%),红系增生停滞1例(3.57%),小细胞低色素性贫血2例(7.14%);巨核系及红系均受累2例(7.14%)。
血小板<80×109/L患儿29例,其中伴有Pre DIC/DIC 20例(68.97%),骨髓细胞学检查显示骨髓巨核系成熟障碍、产板巨明显减少9例(31.03%)。
2.5 不同处理措施预后分析
P LT<50×109/L 13例,给予积极处理的患儿11例(84.62%),其中PLT纠正7例(63.64%),死亡4例(36.36%)。因各种原因未能积极处理患儿2例(15.38%),死亡2例(100%)。
3 讨论
由全身感染促发的严重脓毒症并MODS是小儿重症监护病房主要死亡因素,其中40%~60%的脓毒症患儿可出现血小板减少。越来越多的研究证实,血小板是介导严重脓毒症患儿凝血和炎症反应的关键因素,是联系内源性和获得性免疫应答的桥梁,脓毒症发病过程中的多种因素促发血小板与内皮细胞的相互作用[6],最终导致造血功能等多脏器功能受累[7]。本文72例严重脓毒症患儿中,29例(40.28%)患儿血小板<80×109/L ,13例(18.06%)血小板<50×109/L;14例放弃/死亡患儿中8例血小板<80×109/L,占死亡人数的51.74%,提示伴有血小板减少的脓毒症患儿病死率高。故在临床工作中应高度重视脓毒症外周血小板的动态检测,早期预测患儿预后。
死亡组与存活组相比,入院当天及入院后第7 d患儿血小板计数差异有统计学意义(P<0.05)。PLT<80×109/L 29例患儿中,入院时受累器官数目≥3个的患儿19例(65.52%),死亡8例,病死率27.59%; PLT<50×109/L 13例患儿中入院时受累器官数目≥3个10例(76.92%),死亡6例,病死率达46.15%,提示严重脓毒症并血小板明显减少的患儿入院时受累脏器多,病情重,血小板持续进行性下降提示预后差。同时本研究发现,13例血小板重度减低患儿中有6例(46.15%)发生重要脏器出血而死亡;且全部放弃/死亡14例患儿中,因血小板重度减低/DIC所致重要脏器出血死亡6例,占死亡人数42.86%。提示血小板重度减低/DIC是导致严重脓毒症患儿死亡的重要原因。已有研究证实,血小板能够正确、敏感地反映患者的病情和预后,可作为危重患者的一个可靠检测指标[8]。故临床工作中对严重脓毒症患儿应高度重视动态监测血小板变化,及时给予恰当的对症处理,以减少死亡事件的发生。
本研究进一步结合血常规、凝血功能检测及骨髓细胞学检查剖析血小板降低的原因,发现29例血小板减少患儿中有9例(31.03%)出现骨髓增生低下,骨髓巨核系成熟障碍并伴有产板巨明显减少,20例(68.97%)伴有凝血功能障碍,发生Pre DIC/DIC。故分析严重脓毒症患儿血小板减少的原因主要有以下两方面因素:(1)全身感染导致骨髓造血功能受抑,巨核系成熟障碍、产板巨减少而导致血小板生成减少[9];(2)严重感染致机体凝血功能障碍、大量微血管形成、血小板过度消耗,导致血小板减少。二者的处理措施不同,大量研究已证实,PLT<50×109/L时,其止血功能即呈指数性下降,导致全身凝血过度激活,且贯穿脓毒症的整个过程,从而导致出血倾向明显增加[10],欧洲指南建议将该类患者的血小板维持在100×109/L以上[5]。本研究中,对PLT<50×109/L患儿,伴骨髓增生低下、巨核系成熟障碍的患儿在积极输注新鲜单采血小板基础上,给予静脉注射免疫球蛋白(IVIG)治疗;对血小板减少伴凝血功能障碍20例患儿,则积极给予小剂量肝素抗凝治疗,同时可输注新鲜冰冻血浆(FFP)快速补充凝血因子。
13例PLT<50×109/L患儿中,11例患儿经上述积极对症治疗,有4例(36.36%)死亡,而因各种原因未能积极处理患儿2例全部死亡。提示严重脓毒症并重度血小板减少的患儿,根据其血小板减少的原因,及时给予新鲜单采血小板输注等对症处理,可迅速纠正机体PLT低下状态,防止DIC/致命性出血事件的发生。故在严重脓毒症中,对血小板明显减少的患儿应剖析其发生的根本原因,针对其不同病因施以及时有效的对症处理,可防止因各脏器微血栓形成而致MODS,或因重要脏器出血而导致死亡事件的发生。
[1]邵 敏,刘 宝,王锦权,等.脓毒症患者CD4+CD25+调节性T细胞检测的临床意义[J].湖南中医药大学学报,2011,31(4):8-10.
[2]林 霞,于永慧.蛋白C通路在严重脓毒症炎症 凝血交叉对话中的作用及临床对策[J].中华急诊医学杂志,2010,19(11):1 228-1 230.
[3]赵祥文.脓毒症的诊断与治疗[J].实用儿科临床杂志,2008,232(18):1 397-1 399.
[4]Gunter OL Jr,Au BK,Isbell JM,et al.Optimizing outcomes in damage control resuscitation:identifying blood product ratios associated with improved survival[J].J Trauma,2008,65(3):527-534.
[5]Levi M,Toh CH,Thachil J,et al.Guidelines for the diagnosis and management of isseminated intravascular coagulation[J].Br J Haematol,2009,145(1):24-33.
[6]Blit PH,McClung WG,Brash JL,et al.Platelet inhibition and endothelial cell adhesion on elastin-like polypeptide surface modif i ed materials[J].Biomaterials, 2011,32(25):5 790-5 800.
[7]Karapinar B, Yilmaz D, Balkan C, et al. An unusual cause of multiple organ dysfunction syndrome in the pediatric intensive care unit:hemophagocytic lymphohistiocytosis [J]. Pediatr Crit Care Med,2009, 10(3): 285-290.
[8]李 敏,于永慧.严重脓毒症血管致内皮细胞损伤与临床对策研究[J].中华儿科杂志,2011,49(8):603-606.
[9]W Faviere,T Boechat.Sepsis: thrombocytopenia is bad,not recovering thrombocytopenia is too bad[J].Critical Care,2011,15(1):440.
[10]Levi M.The coagulant response in sepsis and inflammation[J].Hamostaseologie,2010,30(1):10-12.

