盐酸特比萘芬胶囊在比格犬体内的药物动力学及生物利用度研究
王 昂,丁焕中,高 艳,高国峰,曾振灵
(1华南农业大学兽医学院,广东省兽药研制与安全评价重点实验室,广东广州510642;2南京仕必得生物技术有限公司,江苏南京211106)
盐酸特比萘芬为第2代烯丙胺类衍生物,通过特异性的抑制角鲨烯环氧化酶的活性而减少麦角固醇的合成,从而引起菌体细胞壁破裂而起到杀菌作用,具有最小抑菌浓度低、与血浆蛋白结合率高(99%)、体内分布广、半衰期长、耐受性好、不良反应少等特点[1].自特比萘芬在美国上市以来,销量一直稳居前列,成为抗浅部真菌的首选药物,虽然它还未被批准应用于宠物,但国内外兽医经常用其治疗犬和猫的真菌感染性皮肤病,并具有显著的疗效[2-5].本试验旨在探讨比格犬口服盐酸特比萘芬胶囊的药物动力学(简称药动学)特征及生物利用度,为其临床应用提供给药方案,提高用药的有效性和安全性.
1 材料与方法
1.1 试验药品与试剂
盐酸特比萘芬原料药(质量分数为99.5%),批号1003002,浙江东亚药业有限公司提供;盐酸特比萘芬对照品(质量分数为100%),批号100563—200301,为中国药品生物制品检定所产品;盐酸特比萘芬胶囊(400 mg/粒,含特比萘芬150 mg),批号201008121,为南京仕必得生物技术有限公司产品.磷酸、硫酸、三乙胺、异丙醇、正己烷均为分析级,乙腈为色谱级.
1.2 主要仪器
Acquity UPLC system液相色谱仪,为Waters公司产品;电子分析天平(AUX120型,SHIMADZU),酸度计(PHS-2C型)为上海精密科学仪器有限公司产品;可调微量移液器(Eppendorfer research型,20~200 μL、10 ~ 1 000 μL).
1.3 试验动物和给药
8只健康比格犬,雌雄各半,2~3岁龄,体质量(14.85±1.37)kg,由广东省医药研究总院提供.采用单剂量双周期交叉试验设计,8只健康比格犬随机分为2组:一组静脉注射自制盐酸特比萘芬溶液,另一组口服盐酸特比萘芬胶囊,给药剂量均为10 mg·kg-1,1周后交叉替换另一种给药途径.试验前12 h及给药后4 h期间禁食,仅自由饮水.
1.4 血样采集
给药前(0 h)采空白血,给药后于0.083、0.25、0.5、0.75、1、1.5、2、2.5、3、4、6、8、12 h 前肢静脉采血约2 mL,置于含肝素的离心管中,混匀,3 000 r·min-1离心10 min,分离血浆,-20℃条件保存至测定.
1.5 血药质量浓度测定及方法学考察
1.5.1 血浆样品的前处理 取犬血浆0.5 mL,置于10 mL离心管中,加入4 mL正己烷,200 r·min-1水平震荡20 min后5 000 r·min-1离心10 min,转移正己烷层至新的离心管中,重复提取1次,合并2次正己烷层,加入1 mL 0.5 mol·L-1的 硫酸-异丙醇溶液(体积比为85∶15),震荡 15 min,5 000 r·min-1离心5 min,弃去上层正己烷,取下层硫酸-异丙醇溶液进行HPLC检测,进样量为20 μL.
1.5.2 色谱条件 色谱柱:Hypersil BDS C18柱(4.6 mm ×250 mm,5 μm);流动相:乙腈 -0.1% 三乙胺(体积分数,磷酸调节pH至3.5)(体积比为50∶50);检测波长224 nm;柱温24℃ ;流速 1.0 mL·min-1;进样量 20 μL.
1.6 数据处理
采用Winnolin 5.2.1程序,利用非房室模型分析血药质量浓度-时间数据,获得特比萘芬单剂量经静注和内服给药在比格犬体内的药动学参数与生物利用度.
2 结果与分析
2.1 方法学研究
在选定的色谱条件下,测定血浆中的特比萘芬准确性高、分离度好、峰形良好、无干扰峰出现,特比萘芬的保留时间为10 min,特比萘芬在血浆中的色谱图见图1~3.

图1 比格犬空白血浆色谱图Fig.1 Chromatogram of blank plasma of beagle dogs

图2 比格犬空白血浆添加特比萘芬(0.5 μg·mL-1)色谱图Fig.2 Chromatogram of blank plasma added with terbinafine(0.5 μg·mL-1)
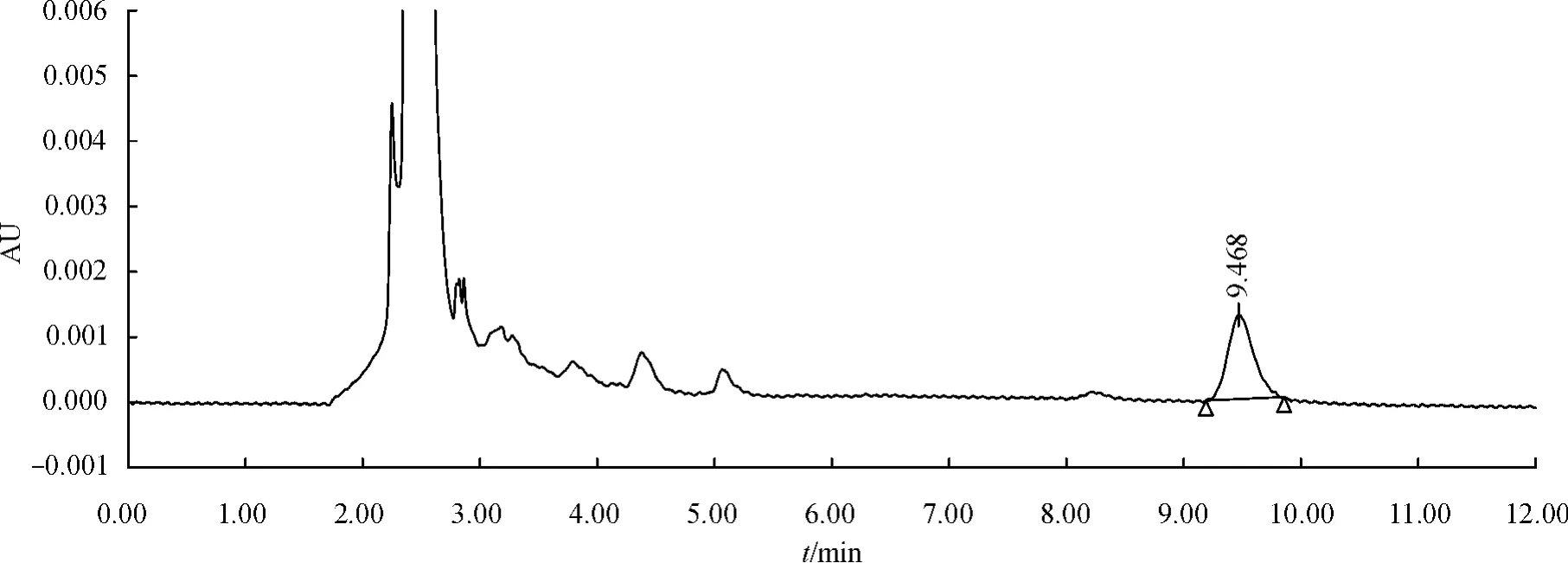
图3 受试比格犬口服特比萘芬胶囊后45 min(0.25 μg·mL-1)的色谱图Fig.3 Chromatogram of plasma at 45 min(0.25 μg·mL-1)after oral administration in beagle dogs
2.1.1 标准曲线的制备 取空白血浆置于10 mL的离心管中,加入盐酸特比萘芬标准液适量制得血浆中药物质量浓度分别为 0.05、0.10、0.20、0.50、1.00、2.00、5.00、10.00 g·mL-1.按“1.5.1”方法操作,并进行色谱分析.以特比萘芬标准对照品的峰面积(y)对血药质量浓度(x)进行线性回归,得血浆标准曲线方程为:y=124 516x+248.5,r2=0.999 8,表明本试验条件下特比萘芬在0.05~10.00 μg·mL-1范围内线性关系良好,血浆中特比萘芬的检测限(S/N≥3)和定量限(S/N≥10)分别为 0.03和 0.05 μg·mL-1.
2.1.2 绝对回收率和精密度的测定 在空白血浆中加入特比萘芬标准液适量,配制成低、中、高(0.1、0.5、8.0 μg·mL-1)3 个质量浓度的特比萘芬血浆样品,按“1.5.1”中血浆样品的处理操作,进行高效液相色谱测定,每个质量浓度做5个重复,共3批.结果表明,3个添加质量浓度的绝对回收率均在78.76% ~80.67%范围内,批内变异系数在3.15% ~4.25%之间,批间变异系数在3.37% ~4.63%之间.
2.2 药动学参数分析
采用Winnolin 5.2.1程序利用非房室模型分析血药质量浓度(C)-时间数据得到比格犬静注和口服特比萘芬的平均药时曲线图见图4,主要药动学参数见表1.

图4 比格犬静注(10 mg·kg-1)和口服(10 mg·kg-1)特比萘芬的血浆质量浓度(C)与时间曲线(n=8)Fig.4 Plasma concentration-time curves of terbinafine after intravenous(10 mg·kg-1)and oral(10 mg·kg-1)administration in beagle dogs(n=8)

表1 比格犬静注、口服特比萘芬后的主要药动学参数(n=8)1)Tab.1 Main pharmacokinetic parameters determined following intravenous(10 mg/kg)and oral(10 mg/kg)administration terbinafine in beagle dogs(n=8)
3 讨论与结论
本研究采用 Denouël等[6]所采用的提取方法,并在此基础上改为正己烷提取2次,处理后的血浆样品无杂质干扰,提高了特比萘芬的回收率,灵敏度与特异性均较高,通过对血浆或组织样本的HPLC测定方法精密度、回收率的测定,说明本法具有专属性、准确性、灵敏度高的特点,适合特比萘芬生物样品含量的测定.
本研究报道了比格犬静注特比萘芬后的药动学特征及口服给药的绝对生物利用度,血药质量浓度-时间数据表明,比格犬静注特比萘芬后,采用非房室模型分析,其Vss=(2.55±0.89)L·kg-1,t1/2=(3.02±1.70)h,表明其在比格犬体内分布广泛,消除快,口服盐酸特比萘芬胶囊后,Vd/F=(35.17±6.58)L·kg-1,t1/2=(1.69±0.74)h,表观分布容积与国外报道相一致,但是其消除半衰期要远远短于盐酸特比萘芬片剂的研究报道结果(8~16 h)[1,7-9],这可能与药物的不同剂型有关,可能片剂在体内有缓释效果,而胶囊剂型则瞬间崩解,不具有缓释作用.
比格犬口服盐酸特比萘芬胶囊的生物利用度仅为(12.54±3.43)%,这可能与该药物口服具有首过效应有关[9-10].虽然特比萘芬的生物利用度很低,但是已有文献表明它具有较强的脂溶性,能够广泛分布于毛发,皮肤,角质层和甲等[11-12].
目前关于抗真菌药物疗效的药动学参数(t>MIC,AUC/MIC或Cmax/MIC)还并没有建立,而且这些参数是否能用于抗真菌药物还并未得知,因此我们还不知道特比萘芬的杀菌机制是浓度依赖型还是时间依赖型.由于特比萘芬在人、犬和兔子中的血浆蛋白结合率大于99%[1],而对于血浆中游离浓度小于20%的药物而言,组织或细胞中的浓度更适合用来进行药物疗效和剂量的推测[13].对于像特比萘芬这种对组织亲和性很强的药物,在感染部位的药物浓度要比血浆中的浓度显得更有意义,因此进行特比萘芬在犬体内的多次给药的药动学研究以及在组织部位的浓度非常有必要.
本文试验所用的犬为比格犬,体外研究表明,比格犬纯化的肝微粒体对异丙酚的代谢要快于灰犬的肝微粒体[13-15],而灰犬与杂种犬并没有表现出代谢速度的不同,这说明比格犬能够较快地代谢异丙酚.安替比林为进行药物代谢的细胞P450酶的探针底物,也是评价药物分布到总体液的程度的一个标志物.KuKanich等[16]进行了安替比林在比格犬和灰犬体内的比较药动学,结果表明,比格犬对安替比林的CL为 13.42 mL·min-1·kg-1,而灰犬为 8.33 mL·min-1·kg-1;Vd在 比 格 犬 体 内 为 613 mL·kg-1,在灰犬体内为760 mL·kg-1;比格犬对安替比林的t1/2为0.55 h,灰犬为1.09 h.安替比林在杂种犬的CL为9.1 mL·min-1·kg-1,Vd为640 mL·kg-1,t1/2β为 1.13 h[17].安替比林在杂种的 CL和t1/2β与灰犬相似,而与比格犬则明显不同.安替比林在 浣 熊 犬 的 CL、Vd和 t1/2β分 别 为:6.2 mL·min-1·kg-1、668 mL·kg-1和 1.24 h[18],由此看来,比格犬对由细胞色素P450氧化酶介导的大多数药物的代谢要不同于其他犬种.
[1]NEWLAND J G,ABDEL-RAHMAN S M.Update on terbinafine with a focus on dermatophytoses[J].Clin,Cosmet Investig Dermatol,2009,2(2):49-63.
[2]金艺鹏,林德贵.盐酸特比萘芬对犬猫皮肤病的疗效观察[J].中国兽医杂志,2003,3(6):21-23.
[3]陆桂平.盐酸特比萘芬和复方酮康唑对犬真菌病的临床疗效观察[J].养犬,2008,1:17-18.
[4]王庆华,金艺鹏,孙艳争,等.口服盐酸特比萘芬在猫毛发中的药物浓度分布[J].中国兽医杂志,2011,47(7):60-61.
[5]MANCIANTI F,PEDONESE F,MILLANTA F,et al.Efficacy of oral terbinafine in feline dermatophytosis due to microsporum canis[J].J Feline Med Surg,1999,1(1):37-41.
[6]DENOUËL J,KELLER H P,SCHAUB P,et al.Determination of terbinafine and its desmethyl metabolite in human plasma by high-performance liquid chromatography[J].J Chromatog B Biomed Appl,1995,663(2):353-359.
[7]BECHERT U,CHRISTENSEN J M,POPPENGA R,et al.Pharmacokinetics of orally administered terbinafine in African penguins(Spheniscus demersus)for potential treatment of aspergillosis[J].J Zoo Wildl Med,2010,41(2):263-274.
[8]BECHERT U,CHRISTENSEN J M,POPPENGA R,et al.Pharmacokinetics of terbinafine after single oral dose administration in red-tailed hawks(Buteo jamaicensis)[J].J Avian Med Surg,2010,24(2):122-130.
[9]WILLIAMS M M,DAVIS E G,KUKANICH B.Pharmacokinetics of oral terbinafine in horses and Greyhound dogs[J].J Vet Pharmacol Ther,2011,34(3):232-237.
[10]HUMBERT H,CABIAC M D,DENOUËL J,et al.Pharmacokinetics of terbinafine and of its five main metabolites in plasma and urine,following a single oral dose in healthy subjects[J].Biopharm & Drug Dispos,1995,16(8):685-694.
[11]FAERGEMANN J,ZEHENDER H,DENOUËL J,et al.Levels of terbinafine in plasma,stratum corneum,dermisepidermis(without stratum corneum),sebum,hair and nails during and after 250 mg terbinafine orally once per day for four weeks[J].Acta Derm Venereol,1993,73(4):305-309.
[12]YEGANEH M H,McLACHLAN A J.Determination of terbinafine in tissues[J].Biomed Chromatogr,2000,14(4):261-268.
[13]TOUTAIN P L,DEL CASTILLO J R,BOUSQUETMÉLOU A.The pharmacokinetic-pharmacodynamic approach to a rational dosage regimen for antibiotics[J].Res Vet Sci,2002,73(2):105-114.
[14]COURT M H,HAY KRAUS B L,HILL D W,et al.Propofol hydroxylation by dog liver microsomes:Assay development and dog breed differences[J].Drug Metab Dispos,1999,27(11):1293-1299.
[15]HAYKRAUSBL, GREENBLATTDJ, VENKATAKRISHNAN K,et al.Evidence for propofol hydroxylation by cytochrome P4502B11 in canine liver microsomes:Breed and gender differences[J].Xenobiotica,2000,30(6):575-588.
[16]KUKANICH B,COETZEE J F,GEHRING R,et al.Comparative disposition of pharmacologic markers for cytochrome P-450 mediated metabolism,glomerular filtration rate,and extracellular and total body fluid volume of greyhound and beagle dogs[J].J Vet Pharmacol Ther,2007,30(4):314-319.
[17]GUGLER R,LAIN P,AZARNOFF D L.Effect of portacaval shunt on the disposition of drugs with and without first-pass effect[J].J Pharmacol Exp Ther,1975,195(3):416-423.
[18]GURLEY B J,BARONE G W,YAMASHITA K,et al.Extrahepatic ischemia-reperfusion injury reduces hepatic oxidative drug metabolism as determined by serial antipyrine clearance[J].Pharm Res,1997,14(1):67-72.

