附子不同炮制品提取物急性毒性的比较研究
谢晓芳,彭成,易进海,胡海燕,唐正伟
附子为毛茛科(Ranunculaceae)植物乌头Aconitum carmichaelii Debx.的子根加工品,始载于《神农本草经》,是四川道地药材之一。附子味辛、甘,性大热,有毒,归心、肾、脾经,具有回阳救逆、补火助阳、散寒止痛等功效,堪称“回阳救逆第一药”。自古以来附子的毒性为医家所重视,并具有久煎、炮制、配伍、控制用量等多种传统制毒方法。本课题组在前期实验中通过现代研究方法证实了附子煎煮时间、用药剂量、配伍的传统控制方法的科学性[1~2]。当前附子的炮制品多达十余种,其中以黑顺片和白附片的临床使用最为广泛。因此,本课题选用此两种常用炮制品及泥附子的标准水提物和醇提物,比较6个提取物的急性毒性,为全面揭示附子毒性和指导临床安全用药提供依据。
1 材料
1.1 样品
黑顺片水提物(每g相当于生药2.294 g)、黑顺片醇提物(每g相当于生药8.621 g)、白附片水提物(每g相当于生药2.305 g)、白附片醇提物(每g相当于生药6.192 g)、泥附子水提物(每g相当于生药1.523 g)、泥附子醇提物(每g相当于生药4.386 g)。以上均由四川省中医药科学院中药研究所易进海教授提供,按《中国药典》2010版附子项下双酯型生物碱的含量测定以上6个提取物含次乌头碱的量分别为0.003%、0.025%、0.002%、0.025%、0%、0.013%。临用时各药用蒸馏水配成刚好能通过12号灌胃针的浓度或其他所需浓度。
1.2 动物
昆明种小鼠,SPF级,雌雄各半,体重18~22 g;SD大鼠,SPF级,雌雄各半,体重180~220 g,均由成都中医药大学实验动物研究中心提供(动物质量合格证号:SCXK(川)2008-11)。实验环境:成都中医药大学国家中医药管理局中药药理科研三级实验室(TCM-2009-315)。
1.3 主要仪器
PA2003型电子分析天平,上海天平仪器厂。
2 方法
2.1 附子不同炮制品醇提物灌胃小鼠半数致死量(LD50)试验
经预试,泥附子、黑顺片和白附片醇提物灌胃小鼠均可引起动物全部死亡,故采用改良的Bliss法进行LD50测定[3~4]。通过反复预试验确定3种醇提物灌胃小鼠的100%致死量(Dm)和0%致死量(Dn)。正式试验时取健康、合格SPF级昆明种小鼠50只,适应环境后按体重随机分为5组,各组10只,雌雄各半。按下式求出剂量比(r)以确定各组给药剂量。

上式中r指相邻两组间剂量比值,N指正式试验的组数,即5。结果按此法算得黑顺片醇提物、白附片醇提物、泥附子醇提物的组间剂量比r值分别为0.88、0.80、0.90。以Dm为最高剂量、Dn为最低剂量,按r值计算出中间3个剂量。3个醇提物各组给药剂量见表1~3。实验前小鼠禁食不禁水14 h,按40 mL.kg-1分别灌胃相应浓度药液,然后密切观察小鼠的反应并及时记录。从第2 d起常规饲养,每天观察2次,连续14 d,记录动物的反应和死亡情况。死亡动物进行剖检,肉眼观察脏器变化。未死亡动物至14 d实验结束后脱颈椎处死,剖检肉眼观察脏器变化。
2.2 附子不同炮制品水提物灌胃小鼠最大耐受量试验
经预试,黑顺片、白附片和泥附子的水提物灌胃昆明种小鼠虽可引起毒性反应,甚至引起个别动物死亡,但不能引起动物全部死亡,故均进行最大给药量测定[5]。正式试验时3个提取物分别试验。取健康、合格SPF级昆明种小鼠40只,适应环境后按体重随机分为空白对照组和给药组,每组20只,雌雄各半。实验前禁食不禁水14 h,然后空白对照组小鼠灌胃蒸馏水40 mL.kg-1,给药组灌胃相应药液40 mL.kg-1,黑顺片水提物、白附片水提物和泥附子水提物的给药浓度按原生药计分别为1.222、1.475、1.160 g.mL-1,黑顺片水提物和白附片水提物24 h内灌胃1次,泥附子水提物24 h内灌胃2次,两次给药间隔12 h,空白对照组给药次数与相应给药组一致。给药后密切观察两组小鼠的一般状态和反应。然后各组小鼠常规饲养14 d,逐日观察小鼠的精神活动、进食、大小便、自发活动、被毛、四肢活动等并详细记录可能出现的毒性表现及其开始和消失时间,于给药后第1、7、14 d称体重。实验结束后将动物脱颈椎处死,剖检肉眼观察脏器变化。
2.3 附子不同炮制品水提物灌胃大鼠急性毒性试验
根据预试,黑顺片、白附片和泥附子水提物灌胃大鼠无法测得LD50,故进行最大给药量测定。正式试验时3个提取物分别试验。取健康、合格SPF级SD大鼠40只,适应环境后按体重随机分为空白对照组和给药组,每组20只,雌雄各半。实验前禁食不禁水14 h,24 h内灌胃2次,两次给药间隔12 h,给药体积20 mL.kg-1,3个提取物的给药浓度同小鼠最大耐受量试验,空白对照组灌胃等体积蒸馏水。给药后密切观察两组小鼠的一般状态和反应。各组小鼠常规饲养14 d,逐日观察小鼠的精神活动、进食、大小便、自发活动、被毛、四肢活动等,并详细记录可能出现的各种毒性表现及其开始和消失时间,于给药后第1、7、14 d称体重,第1、3、4、7、14 d测定摄食量,第3、14 d各组分别取10只大鼠处死,剖检肉眼观察脏器变化,并取心、肝、脾、肺、肾、脑、胸腺、肾上腺称重,计算脏器系数[脏器系数=脏器湿重(g)/动物体重(g)×100%]。
2.4 结果统计
实验数据资料用SPSS 17.0统计软件形成数据库后,LD50的计算采用Curvilinear Regression进行统计分析;其它数据采用独立样本t检验进行组间比较分析。
3 结果
3.1 附子不同炮制品醇提物灌胃小鼠毒性试验结果
3.1.1 LD50及95%可信区间测定结果 黑顺片醇提物灌胃小鼠的LD50为49.853 g生药.kg-1(相当于提取物5.783 g.kg-1),95%可信区间为(45.804~54.636)g生药.kg-1;白附片醇提物灌胃小鼠的LD50为42.550 g生药.kg-1(相当于提取物6.872 g.kg-1),95%可信区间为(38.221~47.828)g生药.kg-1;泥附子醇提物灌胃小鼠的LD50为22.16 g生药.kg-1(相当于提取物5.054 g.kg-1),95%可信区间为(21.043~23.513)g生药.kg-1。可见,泥附子醇提物的LD50值最小。结果详见表1~3。
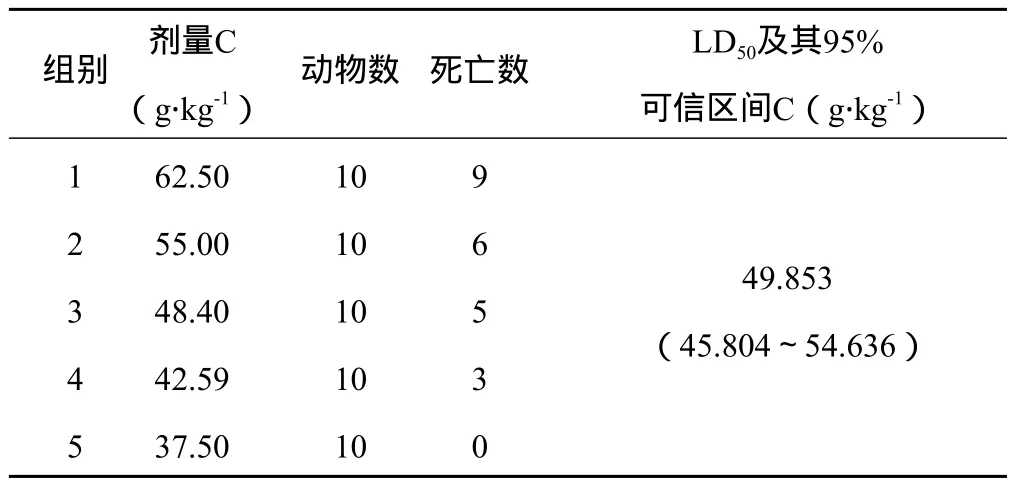
表1 黑顺片醇提物灌胃小鼠LD50试验结果
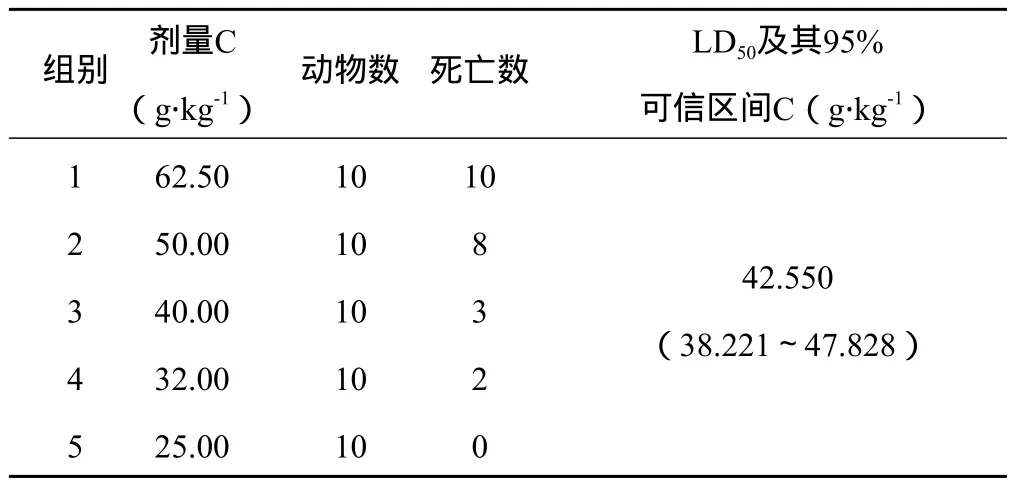
表2 白附片醇提物灌胃小鼠LD50试验结果
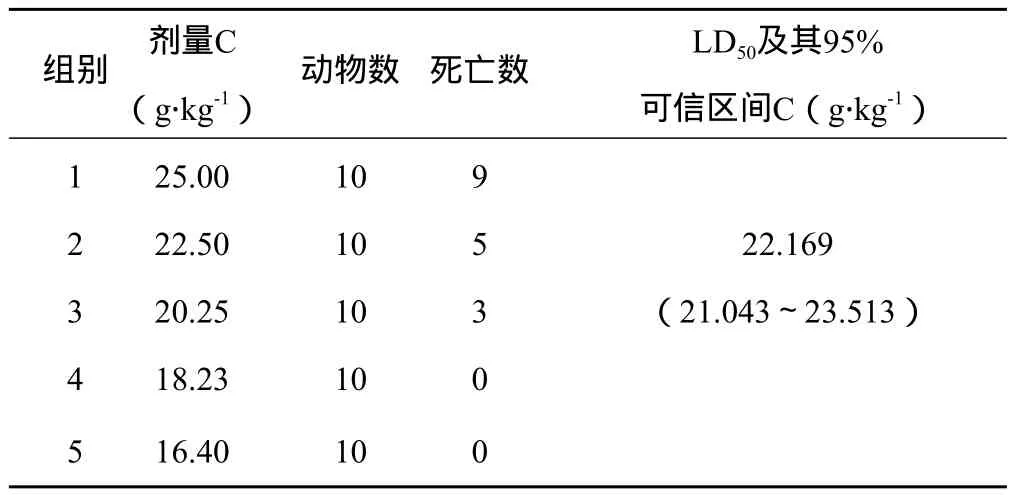
表3 泥附子醇提物灌胃小鼠LD50试验结果
3.1.2 毒性反应 3个醇提物灌胃小鼠后,均可引起动物死亡,但毒性反应在不同剂量时稍有区别。在最大剂量时,小鼠灌胃后即出现活动减少、扎堆、耸毛,5 min内出现呼吸困难,口周流涎或口吐白沫,张口呼吸,继之出现跳跃、抽搐,多在30 min内死亡,其中泥附子醇提物高剂量给药10 min即可致小鼠死亡。对死亡动物立即剖检见心脏充血,胸腔无明显液体,胃内大量残留药液,肠壁充血,肠管充盈内有大量肠液,其余脏器均未见异常。该毒性反应多出现于泥附子醇提物。在中、小剂量时灌胃后动物即出现活动减少、扎堆、耸毛,5~10 min出现口周流涎或张口呼吸,30 min后部分动物出现大、小便失禁致肛周污秽,1 h后伏地不能站立,精神极度萎靡,反应迟钝,多在3~24 h内安静死亡。死亡动物尸体解剖发现心尖部颜色变淡,胃内大量残留药液,肠管无充盈,管壁呈瘀血状,其余脏器均未见明显异常。该毒性反应主要见于黑顺片和白附片醇提物。存活动物在给药后亦出现上述类似毒性反应,但随后缓解,多在灌胃后24 h内毒性反应消失,观察14 d一般状态、进食、体重等均正常,实验结束剖检各脏器无明显病理变化。总体而言,泥附子醇提物毒性反应出现最早,表现最严重。
3.2 附子不同炮制品水提物灌胃小鼠毒性试验结果
3.2.1 最大耐受量测定结果 黑顺片、白附片和泥附子水提物灌胃小鼠后观察14 d,虽均出现一定毒性反应,但不引起动物死亡,最大给药量分别为48.80 g生药.kg-1,(相当于提取物21.273 g.kg-1)、59.00 g生药.kg-1(相当于提取物25.597 g.kg-1)、92.80 g生药.kg-1(相当于提取物60.932 g.kg-1)。
3.2.2 毒性反应 黑顺片水提物和白附片水提物灌胃后,小鼠出现少动、扎堆、耸毛、活动减少,部分动物在给药5~10 min出现呼吸困难,30 min后出现大便失禁,或口周流涎,精神逐级萎靡,反应迟钝,但多在2~4 h内毒性反应消失。随后观察14 d一般状态、进食等均正常,实验结束剖检各脏器无明显病理变化。泥附子水提物给予24 h内灌胃2次,在第1、2次灌胃后动物均出现少动、扎堆、耸毛、活动减少,无明显呼吸困难、口周流涎、二便失禁等其他毒性表现,且多在2~4 h内恢复正常。实验结束剖检各脏器无明显病理变化。
与空白对照组比较,黑顺片水提物在实验第7、14 d体重较空白对照组降低,泥附子水提物对小鼠体重有降低趋势,白附片水提物在给药后第1、7、14 d对小鼠体重无明显异常。结果见表4。
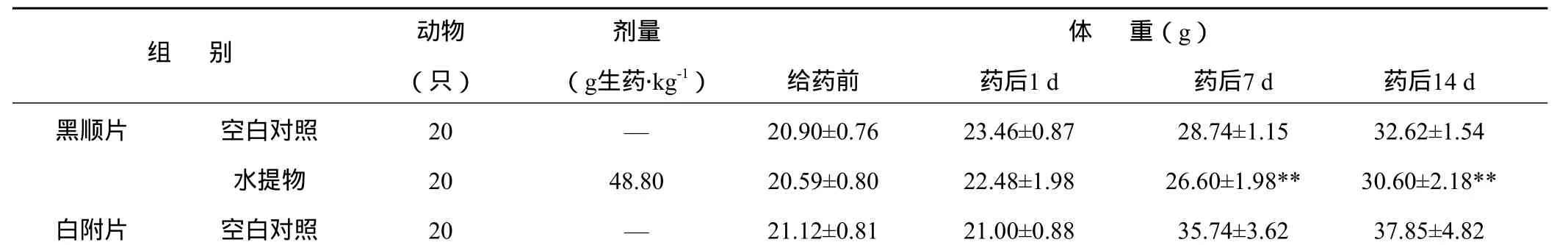
表4 附子不同炮制品水提物灌胃对小鼠体重的影响(x±s)

?
3.3 附子不同炮制品水提物灌胃大鼠急性毒性试验
3.3.1 对一般体征的影响 附子3个炮制品的水提物灌胃大鼠后均可引起大鼠少动、扎堆、耸毛、活动减少等反应,其中黑顺片水提物和白附片水提物可致部分动物呼吸困难,或大便溏稀,多在给药后2 h内毒性反应逐级减弱,24 h基本恢复正常。3个水取物中以泥附子水提物的毒性反应最轻;同一水提物灌胃大鼠的毒性表现较灌胃小鼠轻。
3.3.2 对大鼠体重和摄食量的影响 黑顺片水提物和白附片水提物灌胃大鼠后第1 d体重较空白对照组显著下降,白附片水提物使大鼠摄食量在第1 d也呈明显降低趋势。随后黑顺片水提物和白附片水提物组大鼠体重和摄食量变化与空白对照组一致。泥附子水提物灌胃后大鼠体重变化与空白对照组保持一致,摄食量变化与空白对照组比较无明显异常。结果见图1、图2。
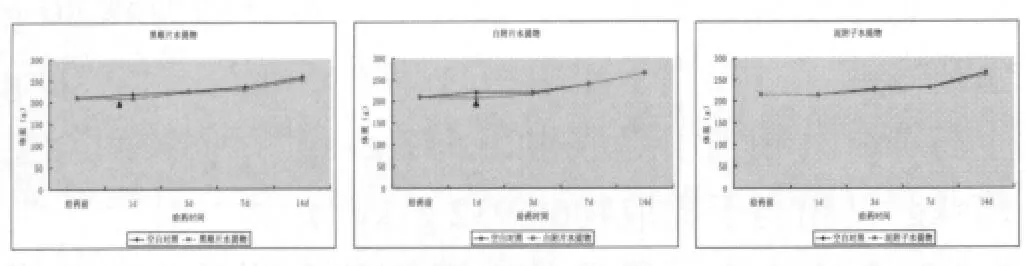
图1 附子不同炮制品灌胃大鼠急性毒性试验对大鼠体重的影响
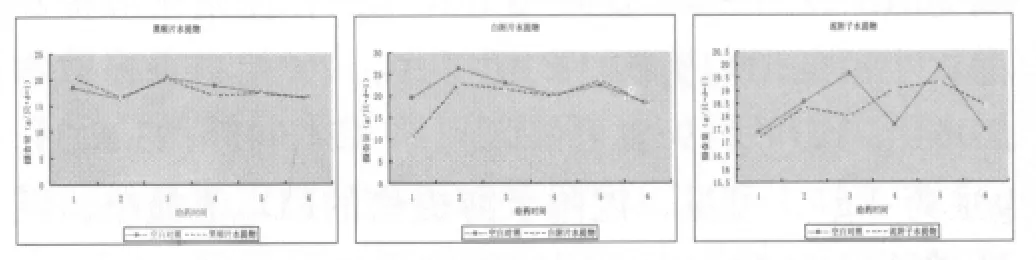
图2 附子不同炮制品灌胃大鼠急性毒性试验对大鼠摄食量的影响
3.3.3 对大鼠重要脏器系数的影响 各组大鼠在给药后第3 d和第14 d分别取10只大鼠脱颈椎处死后剖检,肉眼观察见胸腺和腹腔内无积液、积血等异常,各脏器解剖位置、大小、色质等均无明显异常。剖取心、肝、脾、肺、肾、脑、胸腺、肾上腺称重计算脏器系数。由表5、表6可见,黑顺片水提物在给药第3 d使大鼠胸腺系数减小,至第14 d无异常;白附片水提物在给药后第3 d使大鼠肝脏系数明显降低,第14 d心脏系数明显降低;泥附子水提物在给药后第3 d对上述脏器系数无明显影响,仅在第14 d致心脏系数升高。
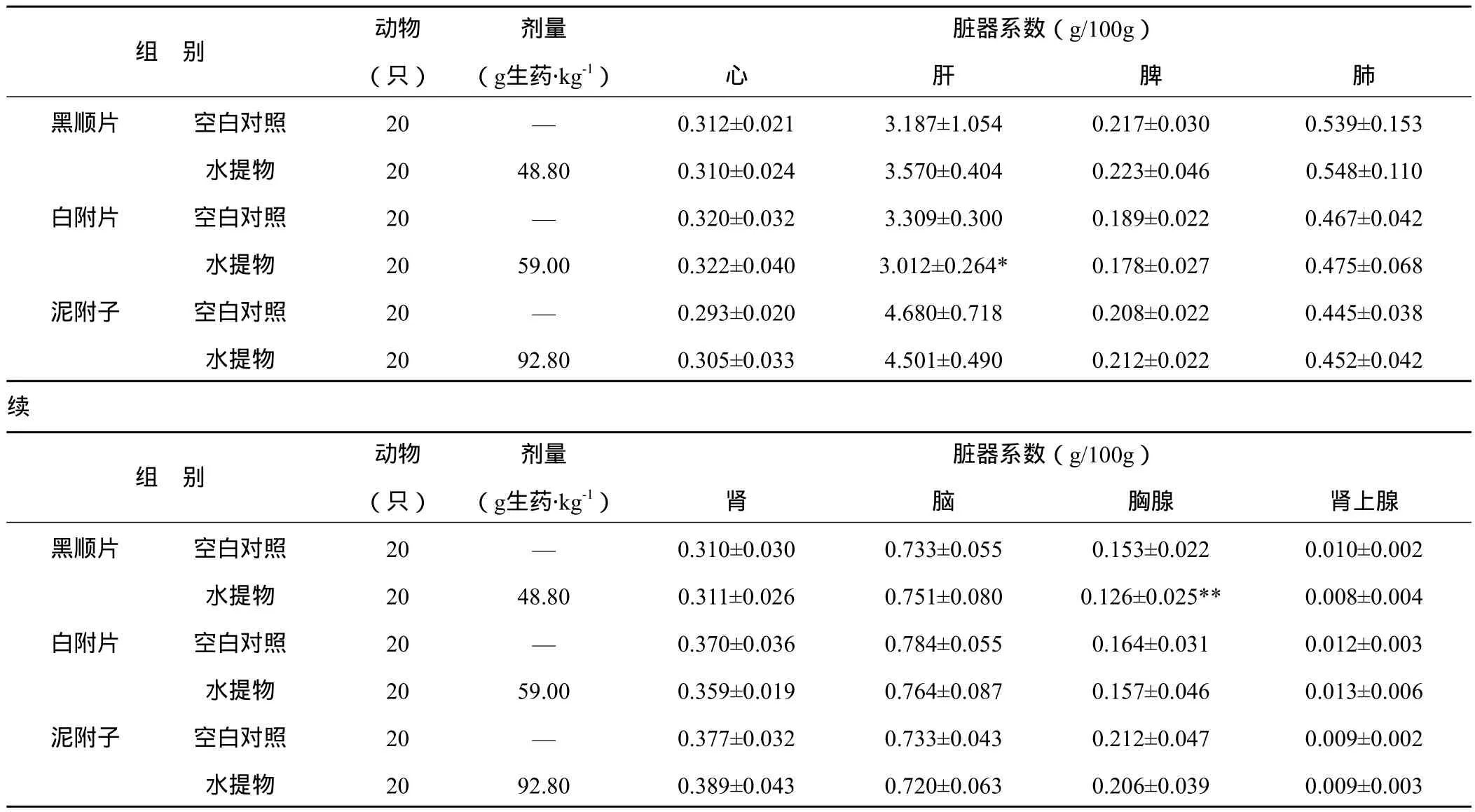
表5 附子不同炮制品水提物灌胃大鼠急性毒性试验第3 d对大鼠重要脏器系数的影响(x±s)
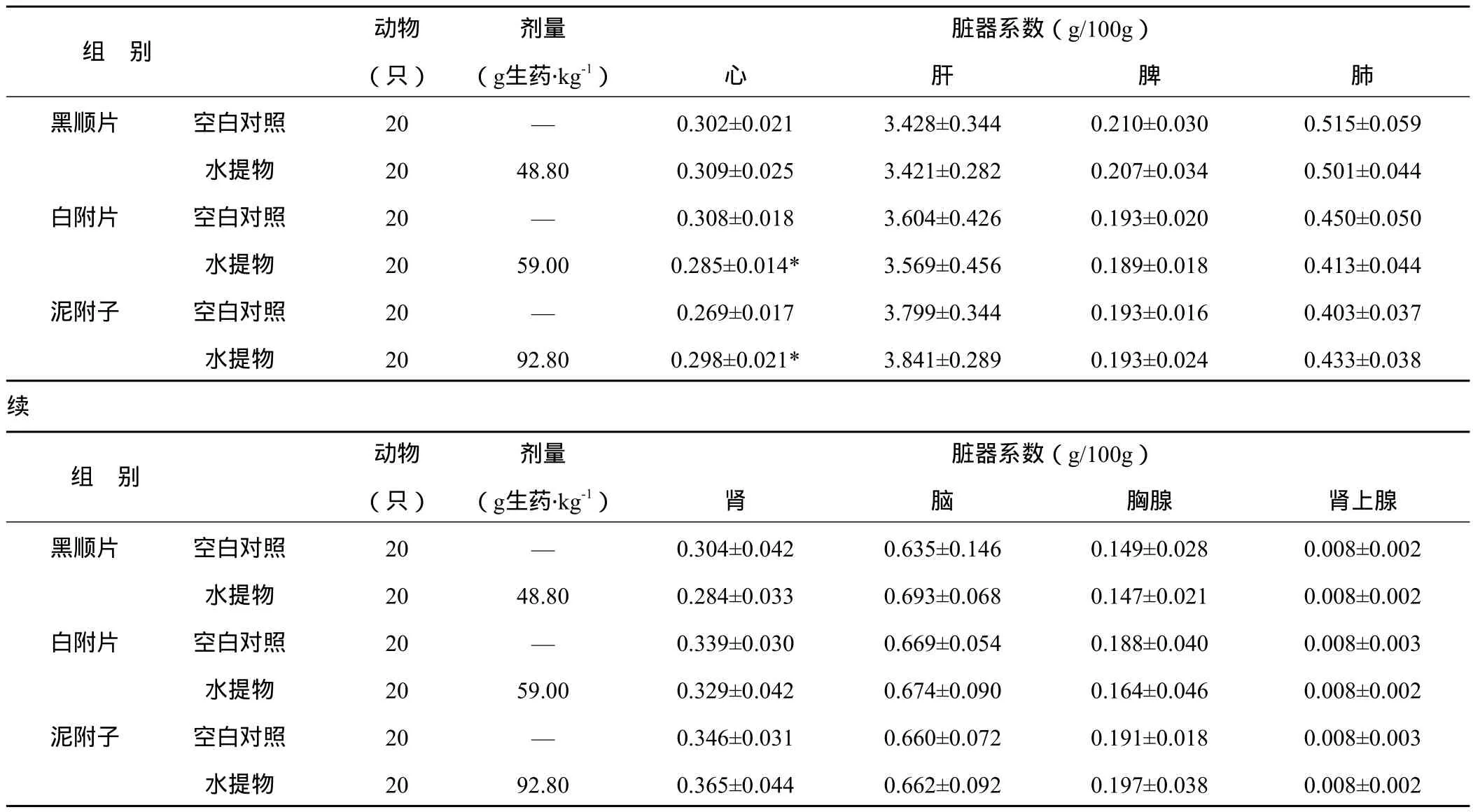
表6 附子不同炮制品水提物灌胃大鼠急性毒性试验第14 d对大鼠重要脏器系数的影响(x±s)
4 讨论
附子的毒性物质基础较为清楚,主要是其所含脂溶性双酯型生物碱,包括乌头碱(aconitine)、新乌头碱(mesaconitine)和次乌头碱(hypaconitine)等。乌头碱内服0.2 mg即可引起中毒,3~4 mg即可引起死亡。本研究显示,三种附子炮制品的醇提物毒性均较水提物毒性大,这与附子毒性部位在脂溶性部位的既往研究成果一致。
附子中的二萜双酯类生物碱是由氨基醇类衍生的酯型生物碱,亲脂性较强,不稳定,在加热和酸碱条件下水解为苯甲酰单酯型生物碱,毒性降低,然后可进一步于C14位的苯甲酰基水解成亲水性的氨基醇类生物碱,毒性更低。因此使用蒸法和煮法对附子进行炮制后附子毒性明显降低。有研究报道白附片、黑附片的总生物碱含量下降为原生药的1/6~1/9,而双酯型乌头碱类生物碱的含量只相当于原药的1/100左右,盐附子总生物碱与上述附片类似,而双酯型生物碱含量明显高于白附片、黑附片[6]。本研究显示,附子3个炮制品的醇提物灌胃小鼠的LD50按生药量算从小到大分别是泥附子(22.169 g.kg-1)、黑顺片(49.853 g.kg-1)和白附片(42.550 g.kg-1),以泥附子的毒性反应出现最快,表现最强烈,可在给药后3 min即引起呼吸困难,口吐白沫,最快10 min即引起死亡。实验结果提示,泥附子醇提物毒性最大,黑顺片和白附片醇提物毒性相对较小,这与炮制后黑顺片、白附片中二萜双酯型生物碱减少有关。
附子不同炮制品水提物急性毒性试验显示,黑顺片水提物、白附片水提物和泥附子水提物分别按生药量分别以48.80、59.00、92.80 g.kg-1灌胃小鼠和48.80、59.00、46.40 g.kg-1灌胃大鼠,观察14 d均不引起动物死亡,为其最大给药量。3个水提物均可引起小鼠、大鼠少动、扎堆、耸毛、活动减少等毒性反应,其中黑顺片水提物和白附片水提物可致部分动物呼吸困难,或大便溏稀,且使小鼠、大鼠给体重明显降低。相对而言泥附子水提物灌胃毒性反应较轻,对大鼠体重无明显影响,说明黑顺片水提物48.80 g.kg-1(相当于人临床日用量的195.2倍)和白附片水提物59.00 g.kg-1(相当于人临床日用量的236.0倍)灌胃小鼠、大鼠的急性毒性较泥附子水提物92.80 g.kg-1(相当于人临床日用量的371.2倍)灌胃小鼠和46.40 g.kg-1(相当于人临床日用量的185.6倍)灌胃大鼠的毒性大。
附子是目前少有的毒性研究较为全面的有毒中药,已报道的毒性靶器官主要是神经系统、心脏和消化系统,其主要毒性成分乌头碱对心肌细胞[7]、大脑皮质神经元[8]、睾丸支持细胞的间质细胞[9]、结肠ICC细胞[10]、肝脏细胞[11]、肾小管上皮细胞[12]等均有细胞毒性。乌头类有毒中药引起的不良反应及现代医学研究显示,附子的中毒症状以神经系统、循环系统、消化系统为主[13~14]。我们的研究显示,3种水提物灌胃大鼠对脾、肺、肾、肾上腺、脑的脏器系数无明显影响,对心和肝脏系数有一定影响,其中黑顺片水提物灌胃3 d可引起大鼠胸腺系数明显下降,提示胸腺亦可能是其急性毒性靶器官,在以后的研究中可结合病理和免疫功能检测等探讨。
综上表明,附子的醇提部位较水提部位毒性大,是其主要的毒性部位。3个醇提物比较,泥附子毒性最大,黑顺片和白附片醇提物毒性相对较小。3种炮制品的水提物毒性虽明显低于醇提物,但仍有急性毒性,在临床应用黑顺片和白附片时应从控制煎煮方法、把握给药剂量、掌握适应病证和合理配伍等多途径控制毒性,发挥疗效。
[1] 刘瑶,彭成.川乌煎煮时间和给药剂量与毒性的相关性研究[J].时珍国医国药,2008,19(8):1803.
[2] 杨明,刘小彬,黄庆德.附子甘草配伍减毒增效机理探析[J].时珍国医国药,2003,14(4):197.
[3] 陈奇.中药药理实验方法学,第2版 [M].北京:人民卫生出版社,2006:108.
[4] 李伟荣,刘睿,黄天来,等.天然冰片小鼠急性毒性的时间毒理学研究[J].时珍国医国药,2011,22(8):1805.
[5] 国家食品药品监督管理局.中药、天然药物急性毒性研究指导原则[S].2005.
[6] 赵保文.附子、川乌、草乌的炮制加工及药理作用比较[J].首都医药,2000,7(4):33.
[7] Dhein S.Pharmacology of gap junctions in the cardiovascular system[J].Cardiovasc Res, 2004,62 (2) :287.
[8] Cheng Peng, Tao Zheng, Fan Yang, et al.Study of Neurotoxic Effects and Underlying Mechanisms of Aconitine on Cerebral Cortex Neuron Cells [J].Arch Pharm.Res,2009,32(11):1533.
[9] 张建军,王衍堂,王金勇,等.乌头碱对大鼠睾丸支持细胞的毒性研究[J].现代预防医学,2007,34(7):1221.
[10] 雷怀成,易建华,刘涛.乌头碱中毒肝细胞凋亡的观察[J].卫生毒理学杂志,2004,18(3):199.
[11] Peng Cheng, Wang Lan, Wang Yanhong, et al.The toxicity of aconitine,emodin on ICC cell and the anagonist effect of the compatibility[J].European Journal of Drug Metabolism and Pharmacokinetics, 2009,34(3, 4):213.
[12] 雷怀成,易建华.乌头碱中毒肾小管上皮细胞凋亡的观察[J].工业卫生与职业病,2005,31(2):83.
[13] 李宗浩.现代急救医学,第1版[M].杭州:浙江科学出版社,1993:408.
[14] 杨小欣.浅谈附子的毒性反应及防范措施[J].辽宁中医学院学报,2003,5(2):162.

