排空强饲法测定鸡饲料表观代谢能值的变异程度及其来源
米宝民赵 峰谭会泽任立芹赵江涛张宏福杨 琳
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193;2.华南农业大学动物科学学院,广州 510642;3.广东温氏食品集团有限公司生产技术部,云浮 527300)
排空强饲法已作为国家标准(GB/T 26437—2010)成为评定鸡饲料代谢能值的统一方法。然而,该国标法并未对其重现性与再现性作任何说明。为了进一步探讨该国标方法的测试精度,系统研究排空强饲法中主要因素的批间与批内变异情况非常重要。在生物学法测定鸡饲料代谢能值的发展中,目前,国际上普遍采用3种方法,即传统全收粪法[1-3]、排空强饲法[4]和欧洲建议方法[5]。这些方法都是基于“准确投喂和无丢失收集排泄物为手段”的原则获得待测饲料的鸡代谢能值。在代谢能值测定的重现性上,Bourdillon等[6]报道了7个实验室间测定饲粮代谢能测值的再现性变异系数为2.92%。在代谢能值测定各处理过程对测试结果方差的贡献上,Alfonso等[7]报道,饲料样品总能值测定的方差(变异)对代谢能值(氮校正真代谢能,TMEn)方差的贡献占48%,饲料样品氮含量的测定方差(变异)对代谢能值(TMEn)方差的贡献占44%。在排除这些化学成分分析方法测试精度的影响外,试验动物个体差异对真代谢能值方差的贡献中,强饲鸡个体间排泄物质量、排泄物能量含量的方差对代谢能值方差的贡献分别为1.9%和71.7%,绝食对照组个体间排泄物能量含量的方差对真代谢能值方差的贡献为26.4%。由此可见,生物学法测定家禽饲料代谢能值的变异来源中,强饲鸡排泄物质量与能量含量的变异、绝食鸡内源性基础代谢排泄量的变异是分析排空强饲法测定鸡饲料代谢能值变异来源的主要因素。因此,分析这些因素的批内与批间变异系数,以及它们对代谢能值变异的贡献,将为规范国标法测定鸡饲料代谢能值的测试精度及试验设计中关键的控制因素提供试验依据。
1 材料与方法
1.1 试验设计与试验动物
采用单因素完全随机设计,分批次测定试验鸡的代谢体重变化、粪能排泄量和淀粉饲粮的表观代谢能(AME)值。试验动物选用平均体重(2.77±0.13)kg无怪癖的健康成年黄羽肉鸡公鸡48只,随机分成2组,每组6个重复,每个重复4只鸡。在代谢试验中,体况恢复期为14 d,预试期为3 d,试验鸡的饲养管理按动物营养学国家重点实验室常规程序进行。正试期中,试验鸡的管理按照48 h排空-强饲-48 h排泄物收集(GB/T 26437—2010)的操作过程进行。代谢室的温度维持在25℃左右。自然通风、光照,自由饮水。
国标法(GB/T 26437—2010)规定的强饲量为60 g,而能量饲料中淀粉的最大含量通常在66%以下(如玉米),按60 g强饲量折算淀粉为40 g左右,而配合饲料中淀粉的含量一般在40%左右,按60 g强饲量折算淀粉为25 g左右。为此,本试验中强饲量设2个处理水平,即40和25 g,随机分配到2组试验鸡中,每个处理重复测定4个批次。
1.2 试验饲粮组成及营养水平
配制玉米-豆粕型配合饲粮,用于满足代谢试验中预试期、体况恢复期试验鸡的营养需要。待测饲粮由玉米淀粉、维生素、微量元素配制,用于检测代谢试验中该饲粮表观代谢能值的批内与批间变异。
1.3 代谢能值测定方案
代谢能测定过程参照国家标准《强饲法测定鸡饲料表观代谢能技术规程》(GB/T 26437—2010)进行。具体过程为:预试期3 d,饲喂配合饲粮(表1),第3天的最后1次喂待测饲粮;禁食排空48 h后准确强饲40或25 g(精确到0.000 2 g)待测饲粮,排泄物收集期为48 h;试验鸡体况恢复期为14 d,期间饲喂配合饲粮(表1)。排泄物的制备:排泄物收集完毕后立即在65℃下烘干至恒重,室温回潮24 h后将每个重复4只鸡的风干排泄物总量称重记录,迅速配备粪样后同步测定其干物质含量(GB/T 6435—2006),获得干物质的排泄量。待整个代谢试验结束后,根据ISO 9831:1998的规定测定排泄物的总能,并同步测定其干物质含量。

表1 饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of diets(air-dry basis) %
1.4 数据处理与统计分析
数据统计分析按照单因素完全随机设计,利用SAS 9.0中的MEANS模块对基本统计量进行分析,GLM模块进行方差分析,平均值间差异的显著性采用Duncan氏多重比较,结果以平均值±标准差表示。各统计量的变异系数按下面公式计算:

式中:Yij表示第i个批次的第j个观测值;表示第i个批次的均值;表示样本总均值;G表示组数;N表示样本总数;Ni表示第i个组样本量;μ表示总平均值;αi表示组间效应;εij表示随机误差。
2 结果与分析
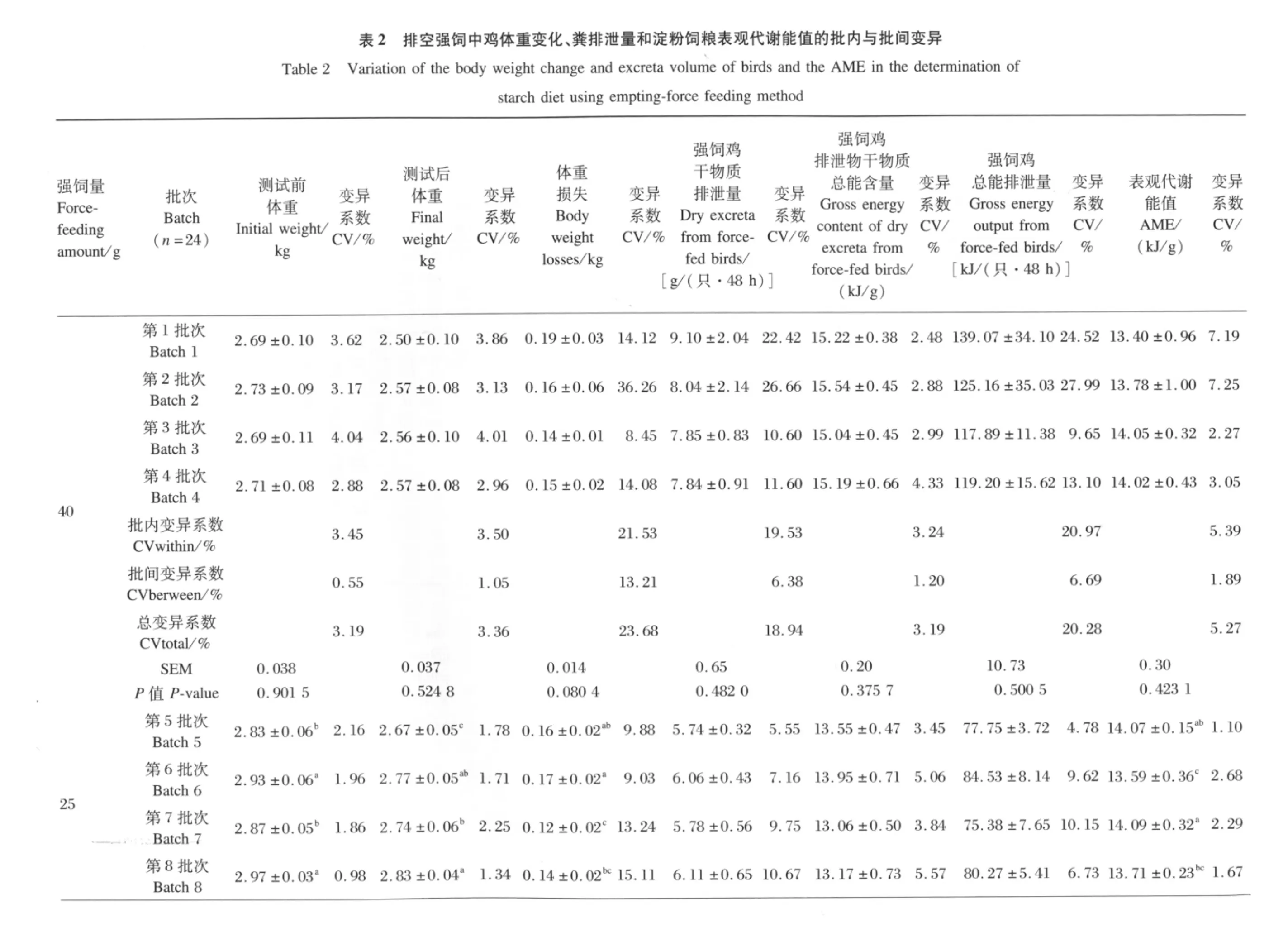
2.1 排空强饲中鸡体重损失、排泄物质量及代谢能值的批内与批间变异
当淀粉强饲量为40 g时(表2),4个测定批次间试验鸡的测试前体重、测试后体重、体重损失、强饲鸡干物质排泄量、强饲鸡泄物总能含量、强饲鸡总能排泄量和表观代谢能值都无显著差异(P>0.05),在批内、批间和总变异系数上,以体重损失、强饲鸡干物质排泄量和强饲鸡总能排泄量相对较大,三者的批内变异系数分别为21.53%、19.53% 和 20.97%,批 间变 异 系数 分 别 为13.21%、6.38% 和 6.69%,总变异系数分别为23.68%、18.94% 和 20.28%,其他测定指标的批内变异系数在3.24% ~5.39%,批间变异系数在0.55% ~1.89%,总变异系数在 3.19% ~5.27% 。
当淀粉强饲量为25 g时(表2),4个测定批次间试验鸡的体重变化(测试前体重、测试后体重和体重损失)有显著差异(P<0.05),其中第5批次和第7批次在测试前体重上显著地低于第6批次和第8批次的相应值(P<0.05),而第6批次与第8批次、第5批次与第7批次差异不显著(P>0.05);测试后,第5批次的体重显著地低于第6、7、8批次的相应值(P<0.05);第7批次显著地低于第8批次的相应值(P<0.05),但与第6批次的差异不显著(P>0.05);在体重损失上,第6批次显著地高于第7批次和第8批次的相应值(P<0.05),而与第5 批次差异不显著(P >0.05);第 5批次与第8批次、第7批次与第8批次差异不显著(P>0.05)。在表观代谢能值上,第6批次显著地低于第5批次和第7批次的相应值(P<0.05),而与第8批次差异不显著(P>0.05);第5批次与第7批次、第6批次与第8批次差异不显著(P>0.05)。在强饲鸡干物质排泄量、强饲鸡排泄物总能含量和强饲鸡总能排泄量上,4个批次都无显著差异(P>0.05)。在批内、批间和总变异系数上,以体重损失、强饲鸡干物质排泄量和强饲鸡总能排泄量相对较大,三者的批内变异系数分别为10.12%、8.13%和 7.93%,批间变异系数分别为11.73%、2.64% 和 4.23%,总变异系数分别为14.93%、7.88% 和 8.39%,其他测定指标的批内变异系数在1.70% ~4.32%,批间变异系数在1.53% ~2.58%,总变异系数在 2.36% ~4.71% 。
在强饲40 g与25 g淀粉饲粮的差异上(表2),强饲量为25 g时,试验鸡的体重损失、强饲鸡干物质排泄量、强饲鸡总能排泄量和表观代谢能值批内、批间和总变异系数均比强饲量为40 g的相应变异系数低;同时,试验过程中也观测到强饲25 g饲粮时试验鸡的粪便为正常的黄黑色,而强饲量为40 g时,粪便可见明显的白色未消化淀粉。这表明强饲25 g淀粉对黄羽肉鸡而言是在其碳水化合物水解消化的正常范畴内。
2.2 代谢能值测定中方差来源的剖析
参照Beers[8]的方法,将表观代谢能值的方差剖分如下:

式中:X表示强饲量;EMC表示强饲鸡排泄物总能含量;Y表示强饲鸡排泄物干物质量;i表示第i个重复(处理)。
?

?
在表观代谢能值测定中(表3),对淀粉饲粮表观代谢能值方差贡献最大的是强饲鸡的干物质排泄量的变异,其次是排泄物总能含量的变异,最小的是强饲量的变异。当强饲量为40 g时,试验鸡干物质排泄量的变异对表观代谢能值方差的贡献为96.46%,排泄物总能含量的变异对表观代谢能值方差的贡献为3.23%,强饲量的变异对表观代谢能值方差的贡献为0.30%。当强饲量为25 g时,试验鸡干物质排泄量的变异对表观代谢能值方差的贡献为67.72%,排泄物总能含量的变异对表观代谢能值方差的贡献为24.51%,强饲量的变异对表观代谢能值方差的贡献为7.76%。
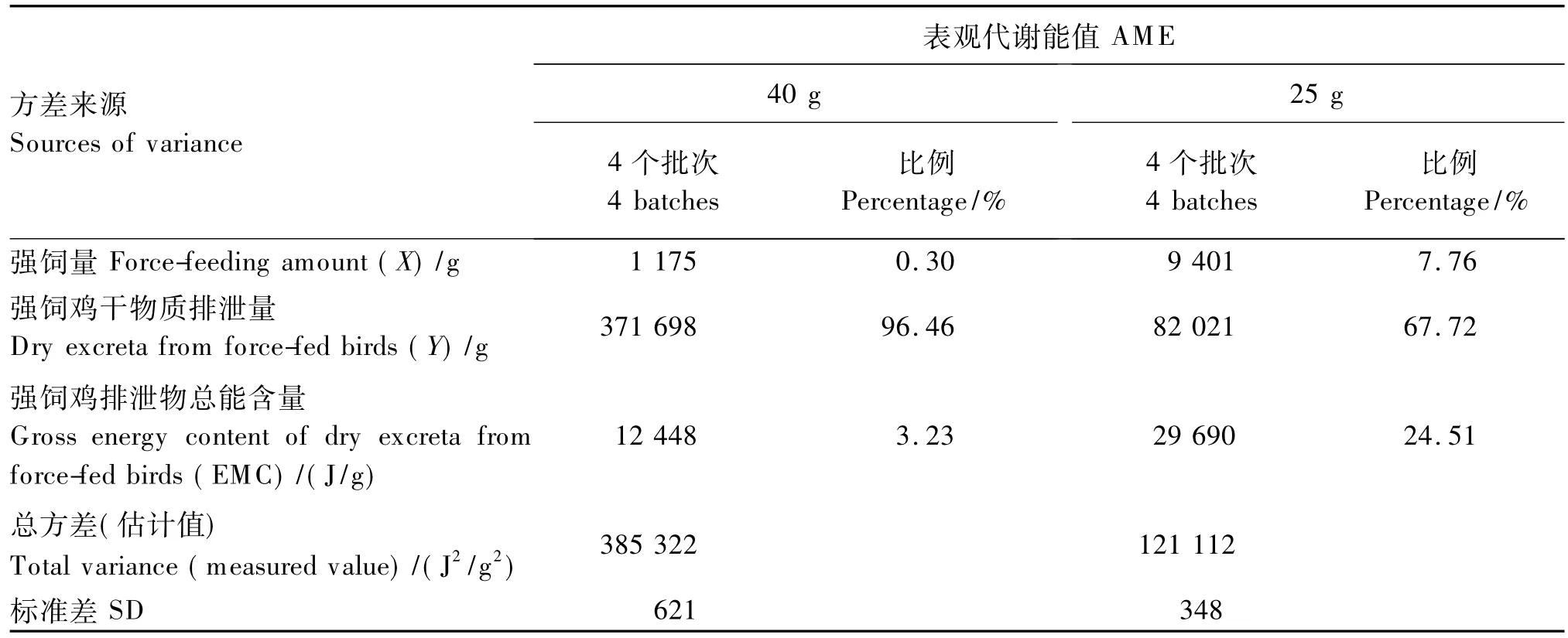
表3 测定表观代谢能值时方差的来源Table 3 Sources of variance in the determination of AME
3 讨论
3.1 生物学法测定家禽饲料代谢能值的变异情况
在生物学法测定家禽饲料表观代谢能值的过程中,需要多次测定样品的干物质含量和总能含量,且动物个体间也存在一定程度的变异,因此,生物学法测定的表观代谢能值的变异系数理论上比干物质及总能等测定方法的变异系数大。Bourdillon等[6]报道,欧洲7个实验室在自由采食-全收粪法条件下测定4个肉仔鸡饲粮的氮校正表观代谢能(AMEn)值的再现性变异系数为2.92%。这一变异系数比干物质、粗蛋白质、粗脂肪的重现性变异系数高,比干物质的再现性变异系数低(表4)。这表明,Bourdillon等[6]报道的肉仔鸡饲料表观代谢能值测定的生物学法与概略养分测定方法有类似的测试精度。
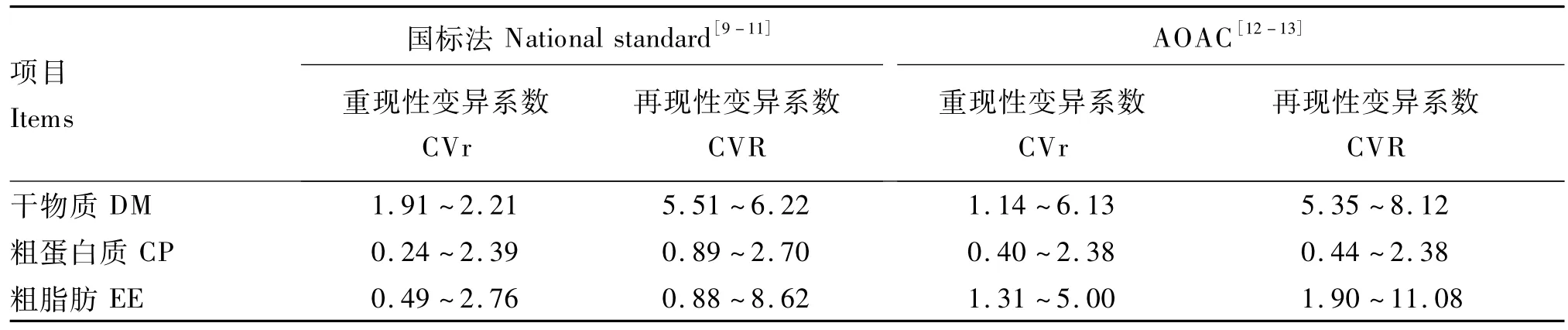
表4 国标法和AOAC测定配合饲粮、能量和蛋白质饲料原料常规营养成分的精度Table 4 The precision of the methods from national standard and AOAC for measuring the proximate nutrient contents in compound feed,energy and protein feed ingredients %
在本研究中,当淀粉饲粮的强饲量为40 g时,4个测定批次的表观代谢能值的批内变异系数为5.39%,批间变异系数为1.89%(表2)。当淀粉饲粮的强饲量为25 g时,4个测定批次的表观代谢能值的批内变异系数为1.97%,批间变异系数为1.53%(表2)。在强饲量为25 g的前提下,淀粉饲粮表观代谢能值的批内与批间变异均低于强饲量为40 g的相应值。且强饲量为25 g时,淀粉饲粮表观代谢能值的批内变异系数与干物质、粗蛋白质、粗脂肪的重现性变异系数类似,而批间变异系数相对比概略养分测定的再现性变异系数低。这表明,淀粉饲粮在强饲量为25 g时,测定结果相对稳定。此外,在2种强饲量条件下,生物学法测定的淀粉饲粮表观代谢能值的批内变异系数大于批间变异系数,这表明该方法中组内动物个体间的差异较大,而组间动物的群体差异不大,从而可能导致测试结果的重现性相对较差,而再现性相对较好现象的产生。这一现象与化学分析方法(如概略养分分析)中重现性变异系数较低,而再现性变异系数较大的现象相反。
3.2 代谢试验中主要影响因素对代谢能值变异的贡献
在代谢试验中,影响代谢能值测定的变异因素包括:饲料总能的测定、试验鸡排泄物质量的变异、排泄物总能的变异等[7,14]。Alfonso 等[7]以小麦为例,得出小麦总能值测定的方差(变异)对TMEn方差的贡献占48%,饲料样品氮含量的测定方差(变异)对TMEn方差的贡献占44%。这表明,该研究中饲料总能与氮含量的测定方法的误差较大。在排除这些化学成分分析方法测试精度的影响外,强饲鸡个体间排泄物质量、排泄物能量含量的方差对代谢能值方差的贡献分别为1.9%和71.7%,绝食对照组个体间排泄物能量含量的方差对真代谢能值方差的贡献为26.4%。这表明在小麦代谢能的测定中,重复测定间排泄物能量含量的差异是代谢能值变异的主要来源。
在本试验表观代谢能值测定中(表3),对淀粉饲粮表观代谢能值变异贡献最大的是强饲鸡的干物质排泄量的变异,其次是排泄物总能含量的变异,最小的是强饲量的变异。在这些因素对表观代谢能值变异的贡献中,强饲鸡干物质排泄量的变异对表观代谢能值变异的贡献均比排泄物总能含量的变异对表观代谢能值变异的贡献大,这表明试验鸡个体间排泄物质量的差异是导致表观代谢能值测定变异的主要因素,而粪样中总能含量的差异对代谢能值变异的贡献相对较少。这个结论与 Alfonso等[7]的试验结果相反,其主要原因可能是两者间在总能测定的精度上差异较大。
4 结论
①在鸡代谢能的测定中,淀粉饲粮的强饲量为40 g时,表观代谢能值的变异较大;强饲量为25 g时,表观代谢能值的变异较小。
②在鸡饲料表观代谢能值测定的变异来源中,排泄物质量的变异是主要因素。
[1]HALLORAN H R,ALMQUIST H J.Metabolizable energy determinations of safflower meals for turkeys[J].Poultry Science,1973,52:1674 -1676.
[2]MATEOS G G,SELL J L.Influence of carbohydrate and supplemental fat source on the metabolizable energy of the diet[J].Poultry Science,1980,59:2129 -2135.
[3]陈雪秀,张子仪.常用鸡饲料的真代谢能与表观代谢能值比较[J].中国畜牧杂志,1983,6:2 -4.
[4]SIBBALD I R.A bioassay for true metabolizable energy in feedstuffs[J].Poultry Science,1976,55:303 -308.
[5]BOURDILLON A,CARRE B,CONON L,et al.European reference method for the in vivo determination of metabolisable energy with adult cockerels:reproducibility,effect of food intake and comparison with individual laboratory methods[J].British Poultry Science,1990,31(3):557 -565.
[6]BOURDILLON A,CARRE B,CONON L,et al.European reference method of in vivo determination of metabolisable energy in poultry:reproducibility,effect of age,comprison with predicted values[J].British Poultry Science,1990,31(3):566 -576.
[7]ALFONSO T H D,MANBECK H B,ROUSH W B.Partitioning of variance in true metabolizable energy determinations:an example using wheat data[J].Ani-mal Feed Science and Technology,1999,80:29 -41.
[8]BEERS Y.Introduction to the theory of error[M].New York:Addison Wesely Publishers,1990.
[9]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员.GB/T 6435—2006饲料中水分和其他挥发性物质含量的测定[S].北京:中国标准出版社,2006.
[10]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员.GB/T 5511—2008谷物和豆类 氮含量测定和粗蛋白质含量计算[S].北京:中国标准出版社,2008.
[11]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员.GB/T 5512—2008粮油检验 粮食中粗脂肪含量测定[S].北京:中国标准出版社,2008.
[12]AOAC.Official methods of analysis[S].17th ed.Washington,D.C.:Association of Official Analytical Chemists,2002.
[13]AOAC.Official methods of analysis[S].18th ed.Washington,D.C.:Association of Official Analytical Chemists,2006.
[14]SIBBALD I R.Measurement of bioavailable energy in poultry feedingstuffs:a review[J].Canadian Journal of Animal Science,1982,62:983 -1048.

