酒精培养C3A细胞NOTCH信号通路的表达*
谢 俏 李汇华 李 鑫 徐有青
本实验研究了Notch 信号通路在酒精培养C3A细胞中的表达以及Notch 信号通路抑制剂3,5-二氟苯乙酰-L-丙氨酰-S 苯基甘氨酸 t-丁酯(DAPT)对细胞增殖的影响。
材料与方法
一、试验细胞 C3A 细胞系本实验室保存。
二、试剂 高糖DMEM 培养基、噻唑蓝(MTT)、95%乙醇购自中国医学科学院细胞中心;胎牛血清购自美国 GIBICO 公司;DAPT 购自Sigma-Aldrich 公司;DMSO 购自 Bio-Tech 公司;兔抗人NICD1 购自加拿大Epitomics 公司;兔抗人HES-1 购自Millipore 公司;抗β-actin 抗体购自美国 Santa Cruze 公司;鼠抗兔IgG 购自美国 Cell Signaling 公司;Trizol 购自美国 Invitrogen 公司;发光液购自美国Millipore 公司。
三、细胞培养和处理 取C3A 细胞和CYP2E1 细胞,加入含体积分数为10%胎牛血清的DMEM培养基,置于37℃、5% CO2 和饱和湿度的细胞培养箱中培养,2~3d 换液,5d 传代。收集对数生长期细胞,离心(1000rpm,5min)后弃上清,用1mlDMEM完全培养基重悬、计数。根据文献[8]的描述,选取100mM为酒精作用浓度,24 小时为酒精作用时间,来模拟体外酒精性肝病模型。用封口膜封住细胞培养皿和96 孔板,以防酒精挥发。细胞在加酒精刺激前用不含胎牛血清的培养基培养(饥饿)24h。DAPT 组用 10μmol/L DAPT 预处理 C3A 细胞和CYP2E1 细胞24 小时,然后再加入酒精处理。
四、MTT 法检测细胞增殖 取约3×104细胞,接种于96 孔板中,细胞贴壁后处于对数生长期时,按分组情况在培养基中加酒精和DAPT 共培养24h,吸弃培养基,每孔加入 MTT(5.0g/L)20μL,继续培养4h,吸弃上清,每孔加入DMSO150μL,避光振荡15min,应用全自动酶标仪检测490nm 处各孔的吸光度A490nm,实验重复3 次,通过公式计算细胞存活率,即细胞存活率=A 对照组/A 实验组×100%
五、Western-blot 检测Notch 下游蛋白NICD1和HES1 的表达 取约2.6×107细胞,悬于细胞裂解液中冰浴30min,裂解细胞,离心(12 000rpm,15min),提取蛋白质,定量后取90μg 蛋白与5×加样缓冲液混匀,100℃变性5min,冷却后上样。恒压电泳2h,4℃下将样品转移到 PVDF 膜上,TBST 洗涤 3次,5 分钟 /次。加入兔抗人 NICD1(1:1000)和抗人HES-1(1:500),4℃过夜,TBST 洗涤 3 次,5 分钟 /次,加入抗兔二抗(1:3000),室温振荡孵育2h,TBST 洗涤3 次,5 分钟 /次。加入化学发光液,暗室中显影2min,TBST 洗涤,晾干。以β-actin 作为内参照。
六、RT-PCR 检测Notch1mRNA 水平 在冰上吸弃种有细胞的60mm 培养皿中的培养基,PBS 洗涤3 次,每个培养皿中加入1ml Trizol,冰上裂解提取总RNA,将RNA 溶于DEPC 中,按照反转录试剂盒中的说明进行反转录,按照引物(表1)设计的温度将20μL 的cDNA 以及Mix、dNTP、无酶ddH2O在PCR 仪中进行扩增,设定35 个循环。扩增产物用含溴化乙啶的琼脂糖凝胶电泳鉴定。以GAPDH 作为内参照。
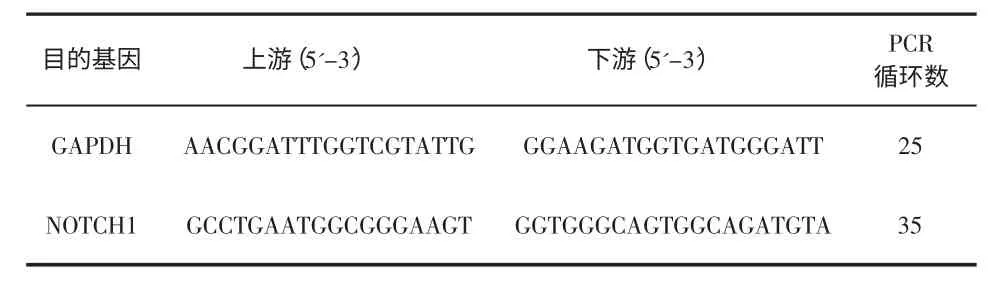
表1 引物序列
七、统计学方法 使用SPSS17.0 统计学软件处理,采用单因素方差分析,P<0.05 为有统计学意义。
结果
一、酒精和DAPT 对CYP2E1 细胞存活率的影响 CYP2E1 细胞分别经酒精、DAPT、DAPT+酒精和空白处理后,检测发现酒精处理组细胞存活率明显低于空白组,DAPT 组较空白组略低,DAPT+酒精组细胞存活率明显高于酒精组(P<0.05),提示酒精对细胞有明显的损伤作用,而DAPT 可以缓解这种作用。
二、酒精对Notch 下游蛋白NICD1 和 HES1 表达的影响 C3A 细胞和CYP2E1 细胞在无血清培养基中饥饿培养24h 后,检测发现C3A 细胞NICD1 和HES1 有少量表达,加入100mM 酒精刺激24h 后,C3A 细胞 NICD1 和 HES1 表达无明显变化,而CYP2E1 细胞 NICD1 和 HES1 表达明显增强(图1)。
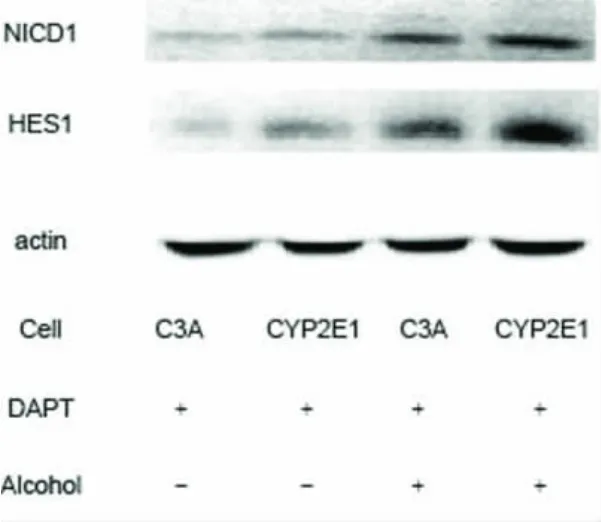
图1 C3A 和CYP2E1 细胞Notch1 及其下游靶基因HES1 的表达 经Western blot 检测发现C3A 和CYP2E1 细胞本身有少量NICD1 和HES1 表达,在加入100mM 酒精刺激24 小时后,两者在CYP2E1 细胞表达明显增强
三、酒精对细胞Notch1mRNA水平的影响 C3A细胞和CYP2E1 细胞几乎检测不到Notch1。在加入100mM酒精培养1h后,可见CYP2E1细胞Notch1RNA 水平显著升高(图2)。
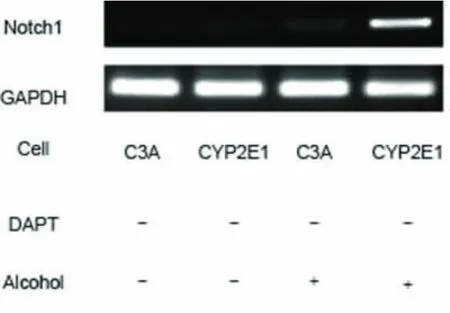
图2 C3A 和CYP2E1 细胞Notch1mRNA 水平变化 经PCR 法检测发现C3A 和 CYP2E1 细胞本身有低水平的Notch1mRNA,在加入100mM 酒精刺激1 小时后,CYP2E1细胞Notch1mRNA 水平明显增高
四、DAPT 对酒精诱导的细胞NICD1 和HES1变化的影响 在DAPT 预处理C3A 和CYP2E1 细胞24h 后,加入酒精刺激,结果C3A 和CYP2E1 细胞NICD1 和HES1 表达水平较未经DAPT 预处理细胞明显减少,表明DAPT 可以有效地抑制酒精刺激后细胞Notch 信号通路的激活(图3)。
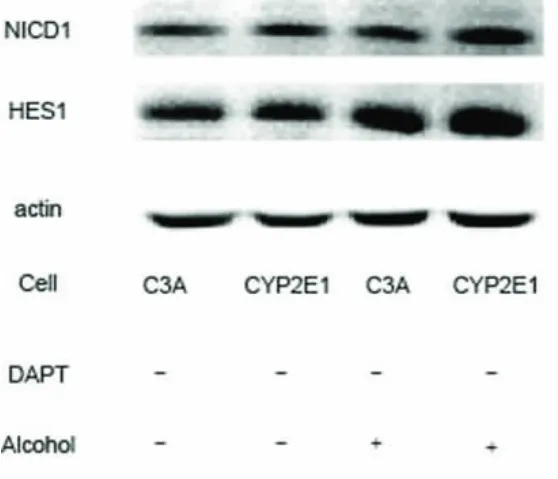
图3 DAPT 对 C3A 和 CYP2E1 细胞 NICD1 和 HES1 表达的影响 用 DAPT(10μM,24h)预处理两种细胞,用Western blot 检测NICD1 和HES1 表达。与无DAPT 处理比较,DAPT 处理的 C3A 和 CYP2E1 细胞 NICD1 和 HES1 表达明显增强
讨论
Pratheesh 发现 Notch 信号通路的配体Jag-1mRNA 是酒精敏感性miRNA 中的靶基因之一,这些发现说明Notch 信号通路在基因水平与生物体对酒精的敏感性相关[1~3]。在此基础上,我们发现酒精可以在代谢过程中产生氧化应激诱导Notch信号通路高表达,Notch 信号通路进一步导致酒精性肝损伤[4~6]。Notch 受体在细胞膜被 γ 内分泌酶切割释放活化的胞内域NICD1,NICD1 与细胞核的共转录因子结合后激活其下游靶基因HES1[7,8]。因此,NICD1 和HES1 表达升高可代表Notch 信号通路的激活[9]。本实验以NICD1 和HES1 为检测指标,从蛋白水平证明了酒精代谢产生的氧化应激可以上调Notch 的表达。γ 分泌酶抑制剂DAPT 是Notch 信号通路的阻断剂,DAPT 可以有效地阻断Notch 信号通路的活化,从而抑制NICD 的生成。本研究中证明在酒精性肝病体外模型中应用DAPT 能有效地抑制NICD 的生成以及Notch 信号通路下游靶基因的活化[10~12]。
酒精性肝病的发病机制有很多,例如酒精的代谢产物乙醛对肝细胞的直接损伤,诱发氧化应激和脂质过氧化紊乱、内毒素血症和铁沉积[13]等。本实验发现酒精激活了Notch 信号通路,从而引起肝细胞损伤。近年来,由于Notch 信号通路在包括T 淋巴细胞白血病、胰腺癌、结肠癌等许多癌症细胞中的表达升高[14],关于Notch 信号通路阻断剂的研究越来越多。已有研究表明抑制Notch 信号通路可以抑制癌症细胞增殖,从而缓解癌症的进展。那么,抑制Notch 信号通路是否可以缓解酒精对肝细胞的直接损伤?我们用MTT 法证明了DAPT 预处理酒精性肝病体外模型后,酒精对肝细胞的直接损伤导致的肝细胞存活率下降得到了明显的改善,表明DAPT 可以缓解酒精对肝细胞的毒性作用,其作用机制可能与Notch 信号通路的抑制有关,但尚需进一步实验证实。
[1]Lieber CS.Microsomal ethanol-oxidizing system (MEOS): the first 30 years(1968-1998)—a review.Alcohol Clin Exp Res,1999,23(6):991-1007.
[2]Lieber CS.Cytochrome P-4502E1:its physiological and pathological role.Physiol Rev,1997,77(2): 517-543.
[3]Wang TY,Zhu D,Xu YQ,et al.The amelioration of AH by abstinence and the attenuation of oxidative stress.Hepatogastroenterology,2012,59(113):73-76.
[4]肖莉.Notch 信号通路与肝脏疾病的关系.中外医学研究,2010,10(8):17-19.
[5]Nijjar SS,Crosby HA,Wallace L,et al.Notch receptor expression in adult human liver: A possible role in bile duct formation and hepatic neovascularization.Hepatology,2001,34(6):1184-1192.
[6]Ishimura N,Bronk SF,Gores GJ.Inducible nitric oxidate synthase up-regulates Notch-1 in mouse cholangiocytes:Implications for carcinogenesis.Gastroenterology,2005,128 (5):1354-1368.
[7]Xu Y,Leo MA,Lieber CS.Lycopene attenuates arachidonic acid toxicity in HepG2 cells overexpressing CYP2E1.Biochem Biophys Biochem Biophys Res Commun,2003,303(3):745-750.
[8]Xu Y,Leo MA,Lieber CS.Lycopene attenuates alcoholic apoptosis in HepG2 cells expressing CYP2E1.Biochem Biophys Res Commun,2003,308(3):614-618.
[9]Dai Y,Rashba-Step J,Cederbaum AI.Stable expression of human cytochrome P4502E1 in HepG2 cells:characterization of catalytic activities and production of reactive oxygen intermediates.Biochemistry,1993,32(27):6928-6937.
[10]Mumm JS,Kopan R.Notch signaling:From the outside.Dev Biol,2000,228(2):151-165.
[11]Ruan Y,Tecott L,Jiang MM,et al.Ethanol hypersensitivity and olfactory discrimination defect in mice lacking a homolog of Drosophila neuralized.Proc Natl Acad Sci USA,2001,98(17):9907-9912.
[12]Sathyan P,Golden HB,Miranda RC.Competing interactions between micro-RNAs determine neural progenitor survival and proliferation after ethanol exposure:Evidence from an ex vivo model of the fetal cerebral cortical neuroepithelium.J Neurosci,2007,27(32):8546-8557.
[13]冀杨,张亚楠,徐有青,等.多烯磷脂酰胆碱在酒精性肝损伤铁过度沉积中的作用.实用肝脏病杂志,2010,13(5):335-338.
[14]Meng RD,Shelton CC,Li YM,et al.Gamma-secretase inhibitors abrogate oxaliplatin-induced activation of the Notch-1 signaling pathway in colon cancer cells resulting in enhanced chemosensitivity.Cancer Res,2009,69(2):573-582.

