复方苦参注射液联合化疗对人胰腺癌的抑制作用
杨 向,张华茂(都江堰市医疗中心外二科,四川都江堰 611830)
胰腺癌居肿瘤死因第4位,确诊时往往已经发生转移,中位生存期不到6个月,是预后最差的肿瘤之一[1]。胰腺癌诊断明确时,超过80%的患者已属中晚期,失去了手术的机会。即使手术切除者,总的5年生存率也仅为l8%,局部复发及远处转移比例仍居高不下[2]。对于无法手术切除与术后复发以及远处转移的患者,化疗成为肿瘤治疗的有效方法,有利于延长患者生存时间、改善患者生活质量,因此寻找有效的化疗药及提高疗效成为胰腺癌治疗的重要研究内容。本研究观察中药复方苦参注射液对恶性肿瘤细胞是否有直接抑制作用及其联合化疗对于恶性肿瘤的疗效,现报道如下。
1 材料与方法
1.1 实验材料
人胰腺癌细胞SW1990株购于中科院上海细胞库,MTT、二甲基亚砜(DMSO)购自 Sigma公司,优级胎牛血清购自Invitrogen公司,二甲亚砜及MTT购于南京探求生物技术公司,复方苦参注射液由山西振东制药股份有限公司提供,其余所用试剂均为国产分析纯市售商品,化疗药选择氟尿嘧啶(5-FU),按Limburg和 Heckman公式:Cmax=D(mg)/5 000×2×103 μg·mL-1(血浆),计算并配制出药物的工作浓度,5-FU 浓度为 1 000 μg·mL-1。
1.2 实验方法
1.2.1 胰腺癌细胞株培养:胰腺癌SW1990细胞株复苏后接种于含10%胎牛血清及青霉素、链霉素各100 U·mL-1的DMEM培养液中,在37℃、5%CO2培养箱中培养,细胞呈单层贴壁生长后每2 d换液1次,生长密度达90%时用0.25 g·L-1的胰酶消化传代。
1.2.2 实验分组:实验设空白组(加培养液200 μL)、对照组(单细胞悬液100 μL+培养液100 μL)、实验组(单细胞悬液100 μL+各种处理药物溶液100 μL)。实验组又分苦参碱联
合化疗组、单纯化疗组。
1.2.3 胰腺癌细胞生长抑制率测定:采用MTT法,弃去培养基后,用PBS液洗涤2次,加入0.25%胰酶和0.02%EDTA,消化5 min后吸弃,用含10%血清的DMEM培养基终止反应,吹散、混匀、计数,以3×105个/mL密度接种于96孔板中,置于CO2培养箱中(5%CO2、95%空气、37℃)培养,每孔加入单细胞悬液 100 μL、药物 100 μL,分别培养 24、48、72 h 后,每孔加入40 μL MTT液(5 mg·mL-1),继续培养4 h后,吸取上清液。每孔加入DMSO 100 μL,振荡10 min,使MTT还原产物完全溶解,用酶标分析仪在490 nm下测定各孔吸光度。按公式:细胞抑制率(IR)=1-(药物组吸光值/对照组吸光值)×100%,计算各组细胞抑制率。
1.3 统计学方法
2 结果
2.1 苦参碱直接对人胰腺癌细胞的增殖抑制率
5%、10%、20%、30%浓度的苦参注射液在体外分别作用于人胰腺癌细胞72 h后,重复测试4次,测得其对人胰腺癌细胞的增殖抑制率,结果显示其抑制作用和对照组相比,差异有统计学意义,且与药物溶度呈正相关性,见表1。
2.2 单纯化疗及联用苦参碱对人胰腺癌细胞的抑制作用
单纯化疗组使用的1倍PPC(1PPC)的5-FU,联用组应用1PPC的5-FU加5%、10%、20%、30%浓度的苦参注射液,重复测试4次,测定其抑制率,2组相比、不同时间相比有明显差异,见表2(不同药物浓度组与5%浓度组比较,P<0.05)。
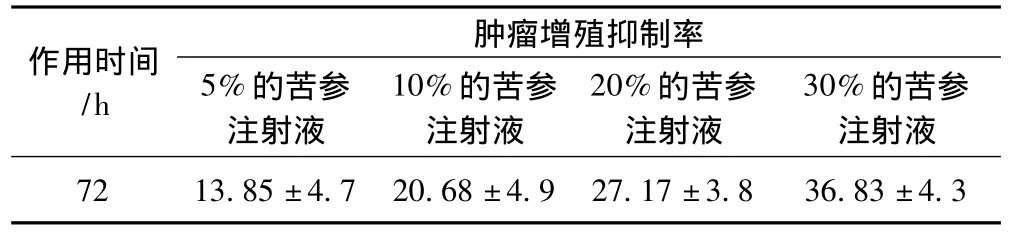
表1 苦参碱直接对人胰腺癌细胞的增殖抑制率(%)Tab 1 In-vitro inhibition ratios(%)of human pancreas cancer cell line SW1990 treated with Compound Matrine Injections
3 讨论
目前,大部分胰腺癌患者就诊时已属晚期,手术切除率低[3],即使能够手术切除的病例,其术后复发率也很高。胰腺癌的这种低切除率和高复发率决定了化疗在其综合治疗中仍占十分重要的地位。遗憾的是,目前胰腺癌的化疗效果仍不十分理想,胰腺癌的天然性和获得性耐药是化疗失败的主要原因[4-6]。
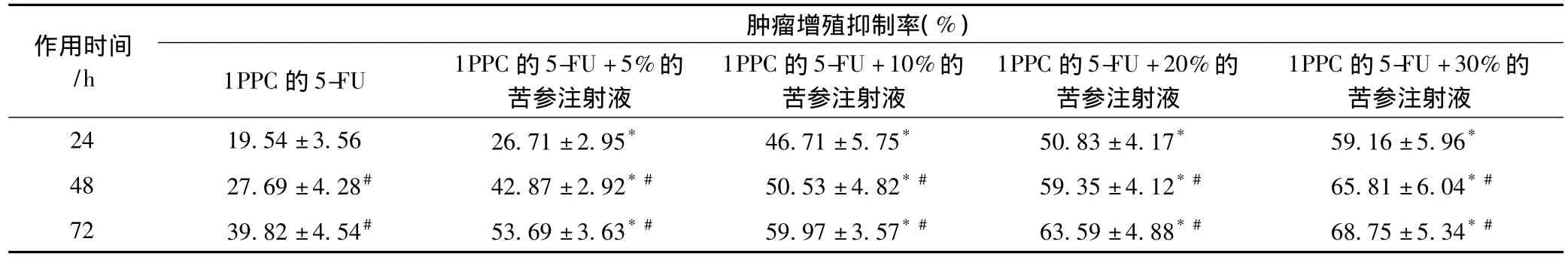
表2 单纯化疗及联用苦参碱对人胰腺癌细胞的增殖抑制率(%)Tab 2 In-vitro inhibition ratios(%)of human pancreas cancer cell line SW1990 treated with chemotherapy alone or in combination with Compound Matrine Injections
鉴于胰腺癌化疗效果差,寻找有效的化疗药、提高化疗效果成为胰腺癌治疗的重要研究内容。科学试验和临床实践均证明中药具有较好的抗肿瘤作用,利用其与化疗联合应用,以提高化疗效果,是有价值的研究方向[7]。复方苦参注射液是以苦参、白土茯苓为原料,经科学提炼而制成的中药注射剂,含苦参碱>18 mg·mL-1。苦参清热燥湿,白土茯苓清热解毒。实验研究证明,苦参碱、氧化苦参碱、脱氢苦参碱等不仅对肿瘤细胞有直接杀伤作用,而且可诱导某些肿瘤细胞向正常细胞分化和促进凋亡[8]。因此,研究苦参碱和5-FU的联合化疗并与单纯化疗作对照,可有效观察其对化疗的协同疗效,对临床的抗肿瘤治疗有指导意义。
本实验观察了不同溶度的苦参注射液在体外对人胰腺癌细胞SW1990细胞生长的抑制作用,结果表明,不同浓度的苦参注射液对人胰腺癌细胞SW1990均有体外直接抑制作用,且抑制程度和药物溶度呈正相关,不同浓度药物作用相比差异显著(P<0.05)。本研究还观察了体外化疗药与不同浓度的苦参碱联合化疗对体外人胰腺癌细胞SW1990细胞生长的影响,结果表明,苦参碱和5-FU的联合化疗的抑制率明显高于单用化疗药,提示苦参碱和化疗药之间有协同作用。本文研究结果为临床应用苦参注射液治疗胰腺癌提供了实验室依据,该药除具有体外直接抑制肿瘤细胞增殖、增强5-FU的抗肿瘤作用外,同时能增强机体的免疫功能状态特别是细胞免疫功能,间接发挥对肿瘤细胞的抑制和杀伤作用。从这个意义上讲,复方苦参注射液可作为中医药中的生物反应调节剂,成为中晚期恶性肿瘤的有效治疗手段之一。
[1]Takhar AS,Palaniappan P,Dhingsa R,et al.Recent developments in diagnosis of pancreatic cancer[J].BMJ,2004,329(7467):668.
[2]Cameron JL,Riall TS,Coleman J,et al.One thousand consecutive pancreaticoduodenectomies[J].Ann Surg,2006,244(1):10.
[3]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2008[J].CA Cancer J Clin,2008,58(2):71.
[4]Müerköster S,Wegehenkel K,Arlt A,et al.Tumor stroma interactions induce chemoresistance in pancreatic ductal carcinoma cells involving increased secretion and paracrine effects of nitric oxide and interleukin-1beta[J].Cancer Res,2004,64(4):1331.
[5]Banerjee D,Mayer-Kuckuk P,Capiaux G,et al.Novel aspects of resistance to drugs targeted to dihydrofolate reductase and thymidylate synthase[J].Biochim Biophys Acta,2002,1587(2-3):164.
[6]Kang HC,Kim IJ,Park JH,et al.Identification of genes with differential expression in acquired drug-resistant gastric cancer cells using high-density oligonucleotide microarrays[J].Clin Cancer Res,2004,10(1 Pt 1):272.
[7]付斯瑜,李顺维.岩舒注射液联合化疗治疗晚期大肠癌的临床观察[J].中国医院用药评价与分析,2007,7(1):64.
[8]王 兵,王国俊,徐 钧.氧化苦参碱对肿瘤诱导血管内皮细胞增殖的抑制作用[J].实用肿瘤杂志,2000,15(5):297.

