鹿蹄橐吾多糖LW21的分离纯化及其结构分析
刘春兰,杜 宁,徐桂云,黄 潇,阿西娜
(1.中央民族大学生命与环境科学学院,北京 100081;2.中国科学院化学研究所, 北京 100080)
鹿蹄橐吾多糖LW21的分离纯化及其结构分析
刘春兰1,杜 宁1,徐桂云2,黄 潇1,阿西娜1
(1.中央民族大学生命与环境科学学院,北京 100081;2.中国科学院化学研究所, 北京 100080)
目的:确定鹿蹄橐吾多糖LW21的结构,为探讨鹿蹄橐吾多糖的药理活性,合理利用鹿蹄橐吾这种植物资源提供依据。方法:水提取醇沉获得鹿蹄橐吾水溶性粗多糖LW,经酸性乙醇分级和DEAE-SephdexA-25纯化得多糖LW21。纸层析、醋酸纤维薄膜电泳和Sepharose CL-4B柱层析进行纯度鉴定,LW21结构分析采用高碘酸氧化、Smith降解、甲基化分析及IR、NMR、GC和GC-MS等方法。结果表明:LW21为均一多糖,相对分子质量约为1.1×106。其单糖组成为鼠李糖(Rha)、阿拉伯糖(Ara)、甘露糖(Man)、葡萄糖(Glc)、半乳糖(Gal),物质的量比为7.4:11.9:25.7:40.0:14.9。多糖LW21为有分枝结构,主链由Glc和Man构成,其中其中Man主要以β(1→2)和β(1→6)糖苷键连接,β(1→2)糖苷键在3-O处和6-O处有分枝,β(1→6)糖苷键在2-O和4-O处有分枝,Glc也主要以β(1→2)及β(1→6)糖苷键连接,β(1→2)糖苷键在6-O处有分枝,β(1→6)糖苷键连接,在2-O处有分枝。分子支链由Ara、Rha、Gal构成。末端残基为Gal、Ara、Rha、Glc。结论:鹿蹄橐吾多糖LW21是一新结构多糖,为首次从鹿蹄橐吾中分离得到。
鹿蹄橐吾;多糖;甲基化分析;结构分析
橐吾属 (Ligularia Cass.)为菊科(Compositae)千里光族,全属约有130种。该属药用植物较多,许多种类的根及根茎作为藏药、维药和民间草药使用,有很长的药用历史[1]。鹿蹄橐吾,别名滇紫菀,是菊科植物鹿蹄橐吾(Ligularia hodgsonii)的干燥全草,分布于我国四川东部、湖北、湖南等省。其根及根茎收入云南省药品标准,药理研究表明醇溶物中具有祛痰镇咳、杀菌消炎和抗肿瘤的活性[2-3]。鹿蹄橐吾的化学成分包括倍半萜类、生物碱、多羟基类小分子等[4]。刘春兰等[5]对大黄橐吾水溶性多糖进行了研究,证明其具有清除自由基的功能。目前国内外对鹿蹄橐吾多糖结构的研究还未见报道。多糖的多种生物活性与它的化学结构密切相关,活性多糖的化学结构是其生物活性的基础。因此本文选用鹿蹄橐吾为原料,对鹿蹄橐吾水溶性多糖提取、分离纯化并测定其结构,为进一步探讨鹿蹄橐吾多糖的药理活性,合理利用鹿蹄橐吾资源提供依据。
1 材料与方法
1.1 材料与试剂
鹿蹄橐吾(Ligularia hodgsonii)全草,采自四川阿坝,由中国科学院植物研究所陈艺林研究员鉴定。
NaBH4美国Sigma-Aldrich公司;DEAE-SephdexA-25、Sephrose CL-4B 瑞典Pharmacia公司;乙醇、乙醚、乙酸乙酯、醋酸、苯酚、高碘酸、碘甲烷、二甲基亚砜等均为分析纯。
1.2 仪器与设备
DB-5MS石英毛细管(30m×0.25mm,0.25μm) 美国GE公司;FC-95A馏分自助收集器 上海青浦沪西仪器厂;8002型电热恒温水浴锅 天津市中环实验电炉有限公司;LD4-8型离心机 北京医用离心机;Qp2010A型气相色谱质谱(GC-MS)联用仪、Specord型红外光谱仪日本岛津公司;AVANCE400型超导核磁共振波谱仪 瑞士Bruker公司。
1.3 方法
1.3.1 鹿蹄橐吾粗多糖LW的提取[6]
称取5g干燥的鹿蹄橐吾,加入体积分数95%的乙醇回流脱脂后,按料液比1:12(m/V)在85℃水浴提取3h,再加入4倍体积的95%乙醇沉淀,静置过夜,3000r/min离心10min,回收上清乙醇,沉淀用无水乙醇、乙醚洗涤后真空干燥后得粗品鹿蹄橐吾多糖LW。
1.3.2 鹿蹄橐吾纯化多糖LW21制备
将粗多糖LW配成2g/100mL溶液,采用链酶蛋白酶与Sevag法联合脱蛋白[7-8]。用pH2.5的酸性乙醇分级得LW2。LW2经DEAE-Sephdex A-25(2.5cm×90cm)柱层析,用0.5mol/L NaCl溶液洗脱,流速0.75mL/min,每支试管接洗脱液2mL,苯酚-硫酸法显色。根据苯酚-硫酸法检测的结果合并收集相同峰位的组分,流水透析24h,去离子水透析24h,减压浓缩至适当体积,加入4倍体积的95%乙醇沉淀,常规干燥制备得多糖LW21。
1.3.3 多糖LW21纯度鉴定
1.3.3.1 纸层析法[9-10]
用新华1号中速滤纸(15cm×40cm)进行层析,溶剂系统为乙酸乙酯-醋酸-水(体积比为4:1:1),苯胺-邻苯二甲酸试剂显色。
1.3.3.2 醋酸纤维薄膜电泳法
采用 0.025mol/L硼酸盐为电极缓冲液(pH12.5),电压250V,电泳时间30min,用0.5%甲苯胺蓝乙醇溶液染色。
1.3.3.3 柱层析法[10]
取5mg多糖配成10mg/L溶液,取0.5mL Sephrose CL-4B(1.5cm×90cm)柱层析上样,0.1mol/L NaCl溶液洗脱,流速0.45mL/min,每管收集2mL,根据苯酚-硫酸法测定多糖,绘制层析图谱,观察结果。
1.3.4 鹿蹄橐吾水溶性多糖LW21的相对分子质量测定
用0.5mL水溶解5mg标准葡聚糖上样,以Sepharose CL-4B(90cm×1.5cm)层析,0.1mol/L NaCl洗脱,流速为0.22mL/min,苯酚-硫酸法测多糖分布,用标准葡聚糖已知相对分子质量的(MW分别为1.0×107、5.0×106、2.0×106、7.0×105、1.0×104)相对分子质量对数值为纵坐标,以洗脱体积(Ve)为横坐标,绘制lgMw-Ve标准曲线[11-12]。
同样条件下测定LW21的洗脱体积,与标准曲线对照,求出相对分子质量。
1.3.5 单糖组成分析
取2mol/L H2SO4完全水解后进行纸层析[13]。
取1mg粗多糖,溶解于3mL三氟乙酸水溶液(2mol/L)中,120℃保温1h,氮气除去三氟乙酸水溶液。加入硼氢化钠50mg氮气流保护酸水解,加吡啶4mL,90℃水浴10min,加4mL乙酸酐90℃水浴20min,乙酰化上样,后进行GC分析[14-15]。
GC条件:OV-210毛细管柱(30m×0.32mm,0.25μm);柱温100℃升高到250℃,程序升温5℃/min;载气为氢气;流速为1.5mL/s;检测器:FID。
1.3.6 LW21的结构分析
1.3.6.1 红外光谱(IR)分析与核磁共振谱分析
取1mg多糖LW21与10mg KBr研磨混合后压片,红外光谱仪在500~4000cm-1扫描[16]进行IR分析。称取10mg多糖LW21,溶于重水(D2O),进行核磁共振波谱分析[17]。
1.3.6.2 高碘酸氧化与Smith降解分析
准确称取50mg样品按文献[19-20]进行高碘酸氧化、Smith降解,透析。透析后对袋内外产物GC分析。GC条件同1.3.5节。
1.3.6.3 LW21的甲基化糖制备
取6mg LW21,用二甲基亚砜、固体氢氧化钠粉、碘甲烷按文献[17]进行甲基化,IR检测确证甲基化完全后,将甲基化产物用4mol/L三氟乙酸,100℃水解4h,氮气吹干,经乙酰化制成乙酰化衍生物[21-23],GC-MS定性和定量分析。
GC条件:柱室初始温度120℃,以5℃/min升至250℃,保持10min,检测器和进样器均为250℃。载气为氦气,线速41cm/s。
MS分析条件:EI源,离子源温度250℃,离子化电势70eV。
样品用二氯甲烷溶解直接进样。根据色谱的各峰面积计算各种连接方式的物质的量比,根据各峰的保留时间和质谱碎片峰,确定其连接方式。
2 结果与分析
2.1 鹿蹄橐吾水溶性多糖的提取及分离纯化
鹿蹄橐吾经水提醇沉后得粗多糖LW,提取率为4.78%。LW为灰白粉末状固体,溶于水,不溶于乙醇、乙醚等有机溶剂。粗多糖经分离纯化得多糖LW21。LW21为浅棕色粉末状,易溶于水,不溶于丙酮、乙醇等有机溶剂。
2.2 鹿蹄橐吾水溶性多糖LW21的纯度鉴定
LW21经Sephrose CL-4B柱层析,苯酚-硫酸法检测得单一对称峰(图1),醋酸纤维薄膜电泳呈单一谱带(图2),纸层析呈单一斑点。说明LW21为相对分子质量及极性均一的纯化多糖[18]。用凝胶洗脱法与标准葡聚糖对照测LW21的相对分子质量约为1.1×106。

图1 多糖LW21的Sepharose CL-4B柱层析谱图Fig.1 Chromatogram of LW21 on Sepharose CL-4B

图2 多糖LW21的醋酸纤维薄膜电泳谱带Fig.2 Cellulous acetate electrophoresis of LW21
2.3 鹿蹄橐吾水溶性多糖LW21的组成分析
LW21经纸层析和气相色谱GC分析结果见图3。经与标准谱图(谱图略)比较,结果表明,其单糖组成为:鼠李糖(Rha)、阿拉伯糖(Ara)、甘露糖(Man)、葡萄糖(Glc)、半乳糖(Gal),物质的量比为7.4: 11.9: 25.7: 40.0: 14.9。LW21是由5种单糖残基组成的杂多糖。

图3 多糖LW21的GC谱图Fig.3 GC chromatogram of LW21
2.4 鹿蹄橐吾水溶性多糖LW21的结构分析
2.4.1 鹿蹄橐吾水溶性多糖LW21的IR、NMR分析

图4 多糖LW21的红外谱图Fig.4 IR spectrum of LW21
由图4可知,在3417、2941、1100cm-1附近处出现多糖的特征吸收峰,1000cm-1附近有3个吸收峰,说明LW21可能含有吡喃环和呋喃环。890cm-1处的吸收峰说明多糖LW21有β型糖苷键。810cm-1处的吸收峰说明多糖LW21也有α型糖苷键[10,15-16]。

图5 LW21甲基化产物GC谱图Fig.5 GC-MS of Chromatogram of LW21
多糖LW21以AVANCE400型核磁共振谱分析仪测定1H NMR,由图5可知,在1H NMR谱中δ4.8~5.5范围有5个C1上质子的信号,化学位移δ值大于5.0的有1个,小于5.0的有5个,说明多糖LW21中存在α型和β型两种[19],与红外分析结果相符。
2.4.2 高碘酸氧化和Smith降解
LW21进行高碘酸氧化,经紫外光谱在223nm检测反应完全后,测得每摩尔己糖消耗0.99mol IO4-,大于释放甲酸量(0.40mol)的2倍,表明其除1→末端及1→6糖基外,尚有可被高碘酸氧化但不产生甲酸的1→2或1→4糖基,即可氧化糖基占70.30%,不可氧化糖基占29.70%[20]。
LW21经Smith降解,对蒸馏水透析。袋内、袋外产物进行GC分析,结果如表1所示。
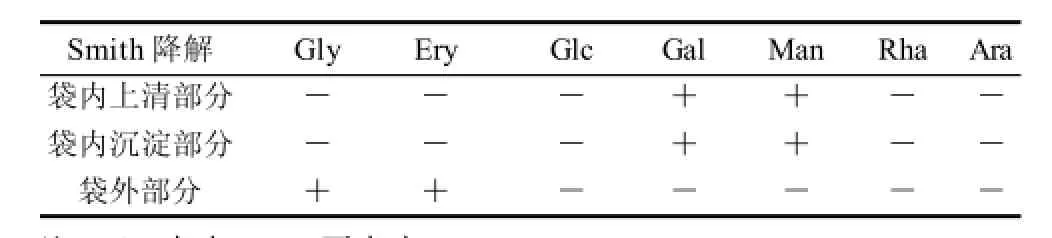
表1 Smith降解结果分析Table 1 Smith degradation analysis
由表1可知,袋内上清和沉淀部分均检出Gal和Man,袋外部分检出赤藓糖(Ery)和甘油(Gly)。根据高碘酸选择性氧化的规则,说明多糖LW21中Gal和Man有不被高碘酸氧化的键型。袋外检出赤藓醇、甘油,说明多糖LW21中存在1→4、1→4,6、1→末端、1→2、1→6、1→2,6键型。
2.5 LW21的甲基化及其产物分析
为确定糖苷键的位置,对甲基化的多糖LW21经水解、还原、乙酰化后的产物作气相色谱-质谱分析[21],结果列于表2。
根据其衍生物的气相色谱相对保留值和每个组分的质谱图可分析各组碎片峰,可确定甲基、乙酰基在衍生物分子上的位置,从而可确认多糖中单糖组成和糖苷键连接位置[22]。
由表1中LW21甲基化产物GC-MS分析可知,LW21单糖组成为Rha、Ara、Man、Glc、Gal,与PC和GC分析结果一致。含有β(1→2)糖苷键的Man的物质的量比为15.0,在多糖LW21中所占比例最大,构成多糖LW21的主链之一,且在3位和6位上有分支,由物质的量比可计算出平均每15个糖残基有7个分枝。含有β(1→6)糖苷键的Man的物质的量比为14.0,也构成主链,且在2位和4位上有分枝,由物质的量比可计算出平均每2个糖残基有1个分枝。含有β(1→2)糖苷键的Glc的物质的量比为12.0,在多糖LW21中所占比例较大,构成多糖LW21的主链之一,且在6位上有分支,由物质的量比可计算出平均每3个糖残基有2个分枝。含有β(1→6)糖苷键的Glc的物质的量比为7.0,也构成多糖LW21的主链之一,且在2位上有分枝,由物质的量比可计算出平均每11个糖残基有4个分枝。支链由Ara、Rha、Gal构成,其中Ara以1→2,1→4或1→5连接,Rha以1→2,1→5连接,Gal以1→6,1→2,3或1→4, 6连接,与高碘酸氧化Smith降解时在袋内未检出Rha、Ara、Man,袋内检出Gal的分析结果一致。Gal、Ara、Rha、Glc都有一部分构成分子的末端残基[23]。
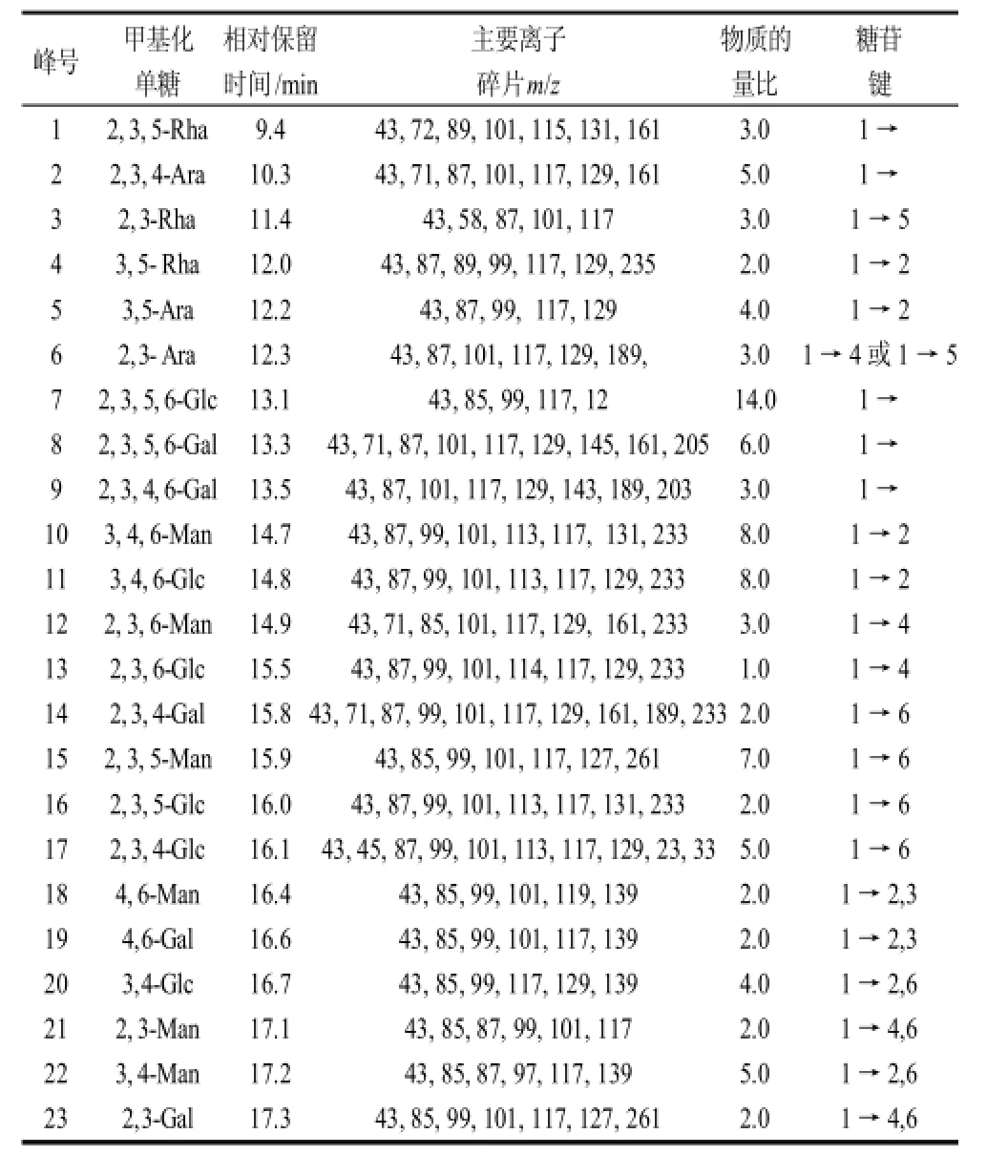
表2 LW21甲基化产物的GC-MS分析Table 2 GC-MS analysis of methylated LW21
3 结 论
鹿蹄橐吾经提取分离纯化得均一多糖LW21,相对分子质量约为1.1×106。经高碘酸氧化、Smith降解、甲基化分析、IR分析、NMR波谱分析,结果均一致。证明LW21的基本结构为Glc和Man构成主链,其中Man主要以β(1→2)和β(1→6)糖苷键连接,β(1→2)糖苷键在3-O处和6-O处有分枝,β(1→6)糖苷键在2-O和4-O处有分枝;Glc也主要以β(1→2)及β(1→6)糖苷键连接,β(1→2)糖苷键在6-O处有分枝,β(1→6)糖苷键连接在2-O处有分枝。分子支链由Ara、Rha、Gal构成,其中Ara以1→2、1→4或1→5连接,Rha以1→2、1→5连接,Gal 以1→6、1→2, 3或1→4, 6连接。末端残基为Gal、Ara、Rha、Glc。LW21是多分支结构复杂的中性多糖。
鹿蹄橐吾多糖LW21为首次从四川天然鹿蹄橐吾中分离得到的均一多糖并测定其一级结构。对于此多糖的构效关系还有待于进行后续工作。
[1]刘守金, 戚欢阳, 齐辉, 等. 中国西北地区真吾属植物的种类及药用资源[J]. 中国中药杂志, 2006, 13(1): 28-32.
[2]赵显国, 王峥涛, 马继元, 等. 中药山紫菀类研究[J]. 中草药, 1999, 30(1): 35-36.
[3]云南省药材公司. 云南中药资源名录[M]. 北京: 科学出版社, 1993: 577.
[4]王文蜀, 卢鹏, 赵坤, 等. 鹿蹄橐吾化学成分研究[J]. 辽宁中医药大学学报, 2009, 11(7): 176-177.
[5]刘春兰, 周博, 杜宁, 等. 大黄橐吾水溶性多糖的初步纯化及清除自由基活性研究[J]. 中央民族大学学报: 自然科学版, 2007, 16(4): 14-17.
[6]刘春兰, 邓义红, 杨林, 等. 雪莲水溶性多糖提取工艺的研究[J]. 食品与生物技术学报, 2007, 2(3): 43-47.
[7]刘延吉, 祝寰宇. 沙棘多糖脱蛋白工艺的优化研究[J]. 河南农业科学, 2008, 37(3): 84-87.
[8]郭育东, 单斌, 李敏仪. 苦瓜多糖脱蛋白方法的比较研究[J]. 安徽农业科学, 2009, 37(7): 3225-3227.
[9]刘海青, 刘银才, 刘春兰, 等. 沙棘叶水溶性多糖SJ1的研究[J]. 食品工业科技, 2006, 27(10): 61-63.
[10]张惟杰. 复合多糖生化技术[M]. 杭州: 浙江大学出版社, 1999: 7; 242-253; 209-212; 193-198; 110; 65-68.
[11]SEKKAL M, HUVENNE J P, LEGRAND P, et al. Direct structural identification of polysaccharides from red algae by FTIR microspctrometry I: localization of agar in Gracilatia verrucosa section[J]. Mikrochim Acta, 1993, 112(1/4): 1-10.
[12]王晓娟, 曾和平, 魏传晚, 等. 葛根地连汤水溶性多糖的研究[J]. 中草药, 2005, 36(3): 345-347.
[13]徐桂云, 陈汝贤. 用毛细管气相色谱法测定多糖中单糖的组成[J]. 分析测试学报, 2000, 19(3): 71-73.
[14]WANG C C, CHANG S C, CHEN B H. Chromatographic determination of polysaccharides in Lycium barbarum Linnaeus[J]. Food Chemistry, 2009, 116(2): 595-603.
[15]龚志华, 陈美丽, 肖文军. 辐照降解茯苓多糖效应研究[J]. 分析测试学报, 2010, 29(10): 1011-1016.
[16]夏朝红, 戴奇, 陈和生, 等. 几种多糖的红外光谱研究[J]. 武汉理工大学学报, 2007, 29(1): 45-47.
[17]孙元琳, 陕方, 崔武卫, 等. 当归多糖ASP3及其水解产物的 NMR光谱分析[J]. 高等学校化学学报, 2009, 30(9): 1739-1743.
[18]GLOAGUEN V, BRUDIEUX V, CLOSS B, et al. Structural characterization and cytotoxic properties of an apiose-rich pectic polysaccharide obtained from the cell wall of the marine phanerogam Zostera marina[J]. J Nat Prod, 2010, 73(6): 1087-1092.
[19]李伟欣, 陈倩, 李平兰, 等. 双歧杆菌22-5胞外多糖结构分析[J]. 食品科学, 2008, 29(4): 267-271.
[20]WU Yalin, WANG Denong. Structural characterization and DPPH radical scavenging activity of an arabinoglucogalactan from Panaχ notoginseng root[J]. Journal of Natural Products, 2008, 71(2): 241-245.
[21]李波, 许时婴. 难溶于二甲亚砜多糖的甲基化方法研究[J]. 天然产物研究与开发, 2004, 16(3): 207-209.
[22]孔元琳, 申瑞玲, 汤坚, 等. 当归多糖ASP3的甲基化分析[J]. 高等学校化学学报, 2008, 29(7): 1367-1370.
[23]WU Yalin, PAN Yuanjiang, SUN Cuirong, et al. Structural analysis of an alkali-extractable polysaccharide from the seeds of Retama raetam ssp. gussonei[J]. Journal of Natural Products, 2006, 69(7): 1109-1112.
Isolation, Purification and Structural Analysis of Water-Soluble Polysaccharide LW21from Ligularia hodgsonii
LIU Chun-lan1,DU Ning1,XU Gui-yun2,HUANG Xiao1,A Xi-na1
(1. College of Life and Environmental Science, Minzu University of China, Beijing 100081, China;2. Institute of Chemistry Chinese Academy of Sciences, Beijing 100080, China)
Objective: to isaolate, purify and structurally characterize a water-soluble polysaccharide from the whole herbs of Ligularia hodgsonii. Methods: crude polysaccharide named as LW was extracted from Ligularia hodgsonii. A ploysaccharide fraction named as LW21 was obtained after acidic ethanol fractionation and DEAE-Sephadex A-25 gel filtration. The purity of LW21 was identified by paper chromatography, Sepharose CL-4B chromatography and cellulous acetate electrophoresis, and its structure was analyzed by HIO4oxidation, Smith degradation, methylation, IR, NMR, GC and GC-MS. Results: LW21was a homogenous polysaccharide. LW21 was composed of rhamose (Rha), arabinose (Ara), mannose (Man), glucose (Glc) and galactose (Gal) with a molar ratio of 7.4: 11.9: 25.7: 40.0: 14.9. Its average molecular weight was 110 kD. Its main chain was made up of β-(1→2)-linked or β-(1→6)-linked Man, and β-(1→2)-linked orβ-(1→6)-linked Glc residues. The β-(1→2)-linked Man was substituted at 2-O and 4-O; β-(1→6)-linked Man was substituted at 3-O and 6-O; and β-(1→2)-linked Glc was substituted at 6-O; β-(1→6)-linked Gal was substituted at 2-O. The side chain was composed of Rha, Ara and Gal. The non-reduced end was composed of Gal, Ara, Rha and Glc. Conclusion: LW21 is a new polysaccharide isolated from Ligularia hodgsonii for the first time.
Ligularia hodgsonii;polysaccharide;methylation analysis;structural analysis
Q629
A
1002-6630(2012)11-0057-05
2011-05-27
中央高校基本科研业务费专项资金资助项目(0910KYZY44);“111创新引智计划”工程项目(B08044);中央民族大学“985”工程项目(MUC985-9)
刘春兰(1962—),女,教授,硕士,研究方向为多糖化学。E-mail:liuchunlan888@yahoo.com.cn

