枯草芽孢杆菌纳豆激酶分离纯化及酶学性质
王 刚,郭明珠,陈 光,*
枯草芽孢杆菌纳豆激酶分离纯化及酶学性质
王 刚1,郭明珠2,陈 光1,*
(1.吉林农业大学生命科学学院,吉林 长春 130118;2.长春职业技术学院,吉林 长春 130033)
利用30%~70%饱和度的硫酸铵沉淀,Sephadex G-50凝胶过滤层析对浅盘发酵纳豆激酶进行分离纯化并对其酶学性质进行初步研究。以纤维平板法测定纳豆激酶活力,SDS-PAGE检验纯化效果。结果表明:纯化后纳豆激酶为电泳纯,分子质量约27.518kD,纯化倍数和酶活回收率分别为19和42.1%,纳豆激酶最适温度为50℃,最适宜pH值为8.0。
纳豆激酶;枯草芽孢杆菌;纯化;酶学特性
心脑血管血栓是心脑血管的大病,全球每年脑血栓、脑梗塞、心肌梗塞、冠心病、动脉硬化等心脑血管疾病夺走1200万人的生命,接近世界总死亡人数的1/4,成为人类健康的头号大敌。典型的以溶栓治疗为目的的药物包括尿激酶和组织型纤溶酶原激活物(TPA)。这些药物存在价格昂贵,在体内半衰期短等缺点。纳豆激酶(nattokinase)是一种具有强烈溶栓作用的丝氨酸蛋白酶,来源于日本纳豆[1-2]、海洋生物[3]、天培[4-5]、豆豉[6-7]等。纳豆激酶具有易于提取,溶栓效果好,成本低廉,来源于食品,无任何毒副作用。近年来,各国学者对纳豆激酶开展了广泛的研究,包括菌种分离[8-9],纳豆激酶的发酵条件优化[10-12],分离提取[13],功能及结构分析[11-12,14-16]等。 Fujita等[17]的研究表明,与纤溶酶相比,纳豆激酶对纤维蛋白本身更敏感,直接破坏交联纤维蛋白,而不是破坏体内的纤维蛋白原。更重要的是纳豆激酶可以由消化道吸收到血液中而引起溶血栓作用[18]。因此,纳豆激酶在溶栓药物和保健食品开发方面,具有极其重要的意义,为获得更好的溶栓、抗栓效果,实验以Sephadex G-50排阻层析对纳豆粗提物进行分离纯化,以SDS-PAGE检验纯化效果,并进行酶学性质的初步研究,以期为纳豆激酶保健品及纳豆激酶抗栓制剂的研制提供科学依据。
1 材料与方法
1.1 材料、试剂与培养基
纳豆菌NK-1由吉林农业大学生物工程实验室提供;纤维蛋白原、标准尿激酶(1280U/支) 中国药品生物制品检定所;凝血酶(2000U/支) 浙江杭康海洋生物药业公司;琼脂糖(进口分装) 宝泰克生物制品有限公司;其他试剂均为国产分析纯。
斜面培养基:蛋白胨0.5%、牛肉膏0.5%、氯化钠0.5%、琼脂2%、种子培养基:葡萄糖1%、蛋白胨1%、氯化钠0.5%,调节pH=7;浅盘发酵培养基:浸泡过夜大豆50g、麦芽糖0.1%、半乳糖0.1%、起始含水量50%。
1.2 仪器与设备
GD751分光光度计 上海雷韵试验仪器制造有限公司;Sartorius BS210S电子分析天平 德国赛多利斯科学仪器有限公司;1-6p高速冷冻离心机 美国Sigma公司;CL-32L高压蒸汽灭菌锅 日本ALP公司;722紫外-可见分光光度计 山东高密彩虹分析仪器有限公司。
1.3 方法
1.3.1 浅盘发酵及纳豆激酶粗提液制备
将市售大豆清洗除杂,2.5~3倍的清水浸泡过夜,沥去水分,121℃灭菌30min,降温至50~60℃时,接入纳豆菌,37℃恒温静置培养24h,4℃冰箱中后熟24h。用生理盐水浸提纳豆中的有效成分,经过10000r/min冷冻离心,取上清,即为粗酶液。
1.3.2 纳豆激酶活性测定方法
1.3.2.1 纤维蛋白平板制备
参照Astrup等[19]的方法,并进行了一定的改进:称取琼脂糖0.5g,溶于4mL 0.01mol/L磷酸盐缓冲液中,沸水浴煮沸,使其完全融化。设其为Q;另称取纤维蛋白原11mg,溶于5mL 0.01mol/L磷酸盐缓冲液中,45℃温浴,设其为F;称取凝血酶10U,溶于1mL 0.01mol/L的磷酸盐缓冲液中,45℃温浴,设其为T。当Q温度降为50℃左右时,把Q倒入T中,然后倒入F,迅速混匀,防止气泡的产生,倒平板。每平板打孔5~6个,点样品,37℃培养16h。
1.3.2.2 标准曲线的绘制
在纤维蛋白平板上以打孔器打5个孔,每孔内加入0.01mol/L磷酸盐缓冲液(pH7.5)10μL。将稀释好的标准品尿激酶(1U/mL)依次加入5个孔中,体积分别为0.2、0.4、0.6、0.8、1.0μL,混匀,37℃保温16~18h。用游标卡尺测量每个溶菌圈的直径,然后以溶菌圈面积(cm2)为纵坐标,以标准尿激酶活力(U)为横坐标作标准曲线,得标准方程为y=3.2782x(R2=0.9641)。
1.3.2.3 纳豆激酶活力
纳豆中加入200mL生理盐水浸提1h,3000r/min离心10min,取上清液,稀释点样于纤维蛋白平板,根据标准曲线计算出纳豆激酶相对于尿激酶的活力。
1.3.3 硫酸铵盐析
采用硫酸铵盐析,取硫酸铵的饱和度分别为10%、 20%、30%、40%、50%、60%、70%,静置过夜后,离心。分别测定上清和沉淀中的纳豆激酶酶活力。
1.3.4 柱层析分离纳豆激酶
采用葡聚糖凝胶Sephadex G-50对盐析后的样品进行进一步分离。柱层析的条件为:柱长:100cm;柱径: 1cm;柱温:室温;上样量:1mL;检测波长:254nm;流速:0.5mL/min;洗脱液:pH8.0 10mmol/L Tris-HCl缓冲液(含2mmol/L CaCl2)。
1.3.5 聚丙烯酰胺凝胶电泳(SDS-PAGE)检测
SDS-PAGE不连续凝胶电泳[20-21]。
1.3.6 蛋白质含量测定
以Bradford法[22]测定蛋白含量,采用牛血清白蛋白为标准蛋白。
1.3.7 pH值对纳豆激酶活力的影响
将纳豆激酶溶于各种不同梯度的pH值缓冲液中(pH4~7:柠檬酸-磷酸氢二钠缓冲液;pH8~11:广泛缓冲液),以纤维蛋白平板法测定酶活力,以最适条件下的酶活力(即最高值)为100%。
1.3.8 温度对纳豆激酶活力的影响
在不同温度(25、30、37、40、45、50、55、60℃)条件下保温16h,以纤维蛋白平板发测酶活力,以最适条件下的酶活力(即最高值)为100%。
2 结果与分析
2.1 纳豆激酶的分离纯化
2.1.1 硫酸铵盐析结果
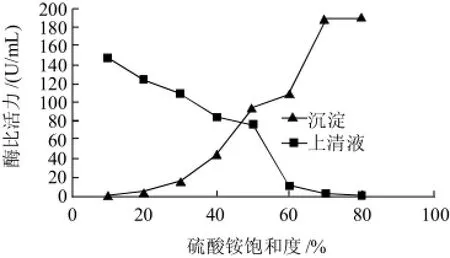
图1 硫酸铵饱和度对纳豆激酶酶活力的影响Fig.1 Effect of degree of ammonium sulfate saturation on the precipitation of nattokinase
由图1可知,随着硫酸铵饱和度的不断增加,纳豆激酶逐渐的转移到沉淀当中。硫酸铵饱和度在0~30%时,纳豆激酶大部分存在于上清液当中,沉淀中的蛋白大部分为杂蛋白,可以除去,因此选择去除杂蛋白的硫酸铵饱和度为30%。当硫酸铵的饱和度为70%时,纳豆激酶大部分转移到沉淀中,硫酸铵饱和度继续增加时,沉淀中纳豆激酶酶活不再上升,因此,本实验中选择沉淀纳豆激酶的硫酸铵饱和度为70%。
2.1.2 Sephadex G-50柱层析分离纳豆激酶
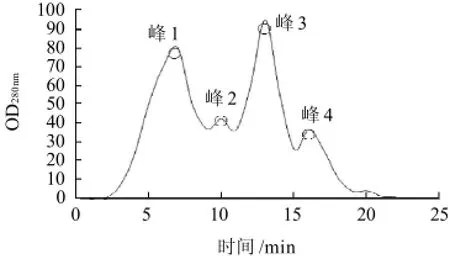
图2 葡聚糖凝胶Sephadex G-50的分离图谱Fig.2 Elution profile of Bacillus subtilis nattokinase on Sephadex G-50 column
由图2可知,经葡聚糖凝胶Sephedex G-50分离之后,得到4个吸收峰,其中吸收峰1和吸收峰3的浓度较大,吸收峰2和吸收峰4的浓度较小,其分离效果不很明显。将4个组分收集并分别经纤维蛋白平板法测纳豆激酶酶活,吸收峰3为目的吸收峰。
2.1.3 纳豆激酶分离结果的电泳检测
葡聚糖凝胶层析分离后的组分,经SDS-PAGE对目标组分进行检测,结果如图3所示。

图3 纳豆激酶分离组分的电泳检测Fig.3 SDS-PAGE of purified nattokinase
由图3可知,经过Sephadex G-50柱层析后的纳豆激酶显示为一条带,表明分离效果较好。同时以已知标准蛋白分子质量的对数(1gMr)为纵坐标,相对迁移率为横坐标绘图,其回归方程为y=-1.055x+5.2197 (R2=0.9574)。按此方程计算,纳豆激酶的分子质量为27518D,与相关文献[23-24]报道接近。
2.1.4 纯化过程评价
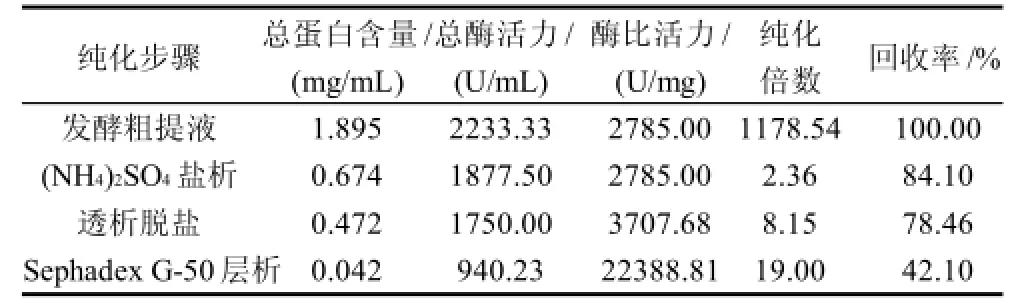
表1 分离纯化结果Table 1 Protein purity, total and specific kinase activity of isolate at different stages of purification
在纯化纳豆激酶的整个过程中,需要对每个步骤进行测定评价,即对纯化过程的每一步收集的酶液进行有效(有活性)成分含量的测定,并计算酶比活力、总酶活力、纯化倍数和回收率,结果如表1所示。纯化过程中总蛋白、总酶活力呈逐渐降低的趋势,但其酶比活力、纯化倍数逐渐增高。经Sephadex G-50层析后,纯化倍数为19,回收率为42.1%。
2.2 纳豆激酶的酶学性质研究
2.2.1 纳豆激酶的最适反应pH值
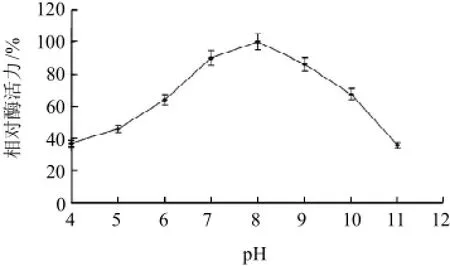
图4 纳豆激酶的最适pH值Fig.4 Effect of pH on the activity of Bacillus subtilis nattokinase
由图4可知,随着pH值的增加,纳豆激酶活力呈先增加后降低的趋势,当pH值为4时,纳豆激酶相对酶活力仅38%,当pH值为8时,相对酶活力最高,pH7.0~9.0为最适反应pH值。
2.2.2 纳豆激酶的最适反应温度

图5 温度对纳豆激酶活力的影响Fig.5 Effect of temperature on the activity of Bacillus subtilis nattokinase
由图5可知,随着温度的升高,纳豆激酶的相对酶活力,呈先增高后降低的趋势,50℃时纳豆激酶的相对酶活力最高;温度降为室温(25℃)时,纳豆激酶的活力仅为30%。当温度大于50℃,纳豆激酶的活力开始逐渐降低。
3 讨 论
3.1 纳豆激酶的分离纯化
分离纯化是一个复杂的过程,在纯化过程中,随着纯化倍数的提高,酶活性逐渐降低,得率也逐渐下降,但酶比活力是逐渐升高的。采用离心、盐析、Sephadex G-50凝胶色谱法对纳豆激酶发酵的粗提物进行纯化,从发酵粗酶液到最后的Sephadex G-50柱层析,纯化倍数为19倍,回收率为42.1%,全过程损失了57.9%,纯化倍数与前人的研究[10,13,25-26]接近,略高于高大海等[27]的研究。
3.2 酶学性质的研究
酶蛋白分子上带有很多酸性和碱性氨基酸残基,pH值的变化会直接影响到这些残基侧链基团的解离状态,进而影响酶与底物的结合能力、催化反应、酶的空间结构及酶的活性。由于酶是蛋白质,可随温度的升高而变性,因此酶促反应应有一个最适温度,在此温度下酶促反应速度最快。纳豆激酶的最适反应温度为50℃,与江晓等[28]的研究接近。与董志奎[24]、朱健辉等[29]的研究不同。最适反应pH值为8.6,与慕娟[30]、鲍艳霞等[31]的研究接近。
4 结 论
4.1 纳豆激酶纯化工艺为:纳豆激酶粗提液离心,30%饱和度硫酸铵去除杂蛋白,70%饱和度硫酸铵沉淀纳豆激酶,沉淀用10mmol/L pH6.4磷酸缓冲液溶解后,经Sephadex G-50凝胶层析,收集活性部分纳豆激酶的纯度很高,酶比活力为22388.81U/mg,SDS-PAGE电泳检验为单一条带。最终的纯化倍数为19,酶活回收率为42.1%
4.2 纳豆激酶最适反应pH值为pH7.0~9.0,纳豆激酶最适反应温度为45~55℃。
4.3 该纯化工艺适于实验室高纯度制备纳豆激酶,以供进一步研究其溶栓机理。
[1]SUMI H, HAMADA H, TSUSHIMA H, et al. A novel fibrinolytic enzyme (nattokinase) in the vegetable cheese Natto; a typical and popular soybean food in the Japanese diet[J]. Cellular and Molecular Life Sciences, 1987, 43(10): 1110-1111.
[2]FUJITA M, NOMURA K, HONG K, et al. Purification and characterization of a strong fibrinolytic enzyme (nattokinase) in the vegetable cheese natto, a popular soybean fermented food in Japan[J]. Biochemical and Biophysical Research Communications, 1993, 197(3): 1340-1347.
[3]SUMI H, NAKAJIMA N, MIHARA H. Fibrinolysis relating substances in marine creatures[J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1992, 102(1): 163-167.
[4]乔支红. 天培的研究进展[J]. 山西食品工业, 2004(1): 2-4.
[5]孙森, 宋俊梅, 张长山. 豆豉、纳豆及天培的研究进展[J]. 中国调味品, 2008(3): 29-33.
[6]PENGYong, HUANG Qing, ZHANG Renhuai, et al. Purification and characterization of a fibrinolytic enzyme produced by Bacillus amyloliquefaciens DC-4 screened from BOUCHI, a traditional Chinese soybean food[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2003, 134(1): 45-52.
[7]WANG Chengtao, JI Baoping, LI Bo, et al. Purification and characterization of a fibrinolytic enzyme of Bacillus subtilis DC33, isolated from Chinese traditional Douchi[J]. Journal of Industrial Microbiology and Biotechnology, 2006, 33(9): 750-758.
[8]LIU Junguo, XING Jianmin, CHANG Tianshi, et al. Optimization of nutritional conditions for nattokinase production by Bacillus natto NLSSE using statistical experimental methods[J]. Process Biochemistry, 2005, 40(8): 2757-2762.
[9]CHITTE R R, DEY S S. Production of a fibrinolytic enzyme by thermophilic Streptomyces species[J]. World Journal of Microbiology and Biotechnology, 2002,18(4): 289-294.
[10]CHO Y H, SONG J Y, KIM K M, et al. Production of nattokinase by batch and fed-batch culture of Bacillus subtilis[J]. New Biotechnology, 2010, 27(4): 341-346.
[11]DEEPAK V, KALISHWARALAL K, RAMKUMARPANDIAN S, et al. Optimization of media composition for nattokinase production by Bacillus subtilis using response surface methodology[J]. Bioresource Technology, 2008, 99(17): 8170-8174.
[12]WANG Sanlang, CHEN H J, LIANG T W, et al. A novel nattokinase produced by Pseudomonas sp. TKU015 using shrimp shells as substrate [J]. Process Biochemistry, 2009, 44(1): 70-76.
[13]WANG Sanlang, CHEN H J, LIANG T W, et al. Purification and biochemical characterization of a nattokinase by conversion of shrimp shell with Bacillus subtilis TKU007[J]. New Biotechnology, 2011, 28 (2): 196-202.
[14]JIA Yan, LIU Hui, BAO Wei, et al. Functional analysis of propeptide as an intramolecular chaperone for in vivo folding of subtilisin nattokinase [J]. FEBS Letters, 2010, 584(23): 4789-4796.
[15]ZHENG Zhongliang, ZUO Zhenyu, LIU Zhigang, et al. Construction of a 3D model of nattokinase, a novel fibrinolytic enzyme from Bacillus natto: a novel nucleophilic catalytic mechanism for nattokinase[J]. Journal of Molecular Graphics and Modelling, 2005, 23(4): 373-380.
[16]SUMI H, HAMADA H, NAKANISHI K, et al. Enhancement of the fibrinolytic activity in plasma by oral administration of nattokinase[J]. Acta Haematologica, 1990, 84(3): 139-143.
[17]FUJITA M, ITO Y, HONG K, et al. Characterization of nattokinasedegraded products from human fibrinogen or cross-linked fibrin[J]. Fibrinolysis, 1995, 9(3):157-164.
[18]FUJITA M, HONG K, MISAWA S, et al. Transport of nattokinase across the rat intestinal tract[J]. Biological & Pharmaceutical Bulletin, 1995, 18(9):.
[19]ASTRUP T,The fibrin plate method for estimating fibrinolytic activity[J]. Archives of Biochemistry and Biophysics, 1952, 40(2): 346-351.
[20]张云贵, 刘祥云, 李天俊, 等. 生物化学实验指导[M]. 天津: 天津科学技术出版社, 2005.
[21]余冰宾. 生物化学实验指导[M]. 北京: 清华大学出版社, 2004.
[22]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[23]刘超. 凝胶层析分离提纯纳豆激酶研究[J]. 食品研究与开发, 2010 (8): 174-192.
[24]董志奎, 杨超, 尹宗宁, 等. 纳豆激酶的分离纯化及酶学性质研究[J].中国生化药物杂志, 2009(5): 298-301.
[25]CHOI D, CHA W S, PARK N, et al. Purification and characterization of a novel fibrinolytic enzyme from fruiting bodies of Korean Cordyceps militaris[J]. Bioresource Technology, 2011, 102(3): 3279-3285.
[26]JAOUADI B, ABDELMALE B, FODIL D, et al. Purification and characterization of a thermostable keratinolytic serine alkaline proteinase from Streptomyces sp. strain AB1 with high stability in organic solvents [J]. Bioresource Technology, 2010, 101(21): 8361-8369.
[27]高大海, 梅乐和, 盛清, 等. 硫酸铵沉淀和层析法分离纯化纳豆激酶的研究[J]. 高校化学工程学报, 2006(1): 63-67.
[28]江晓, 董明盛, 江汉湖. 一种食源性纤溶酶(纳豆激酶)酶学性质的研究[J]. 中国酿造, 2002(1): 23-25.
[29]朱健辉, 杜连祥, 路福平, 等. 高效溶栓酶: 纳豆激酶的纯化及酶学性质研究[J]. 微生物学通报, 2006(1): 68-71.
[30]慕娟, 党永. 纳豆激酶的分离纯化及酶学性质研究[J]. 西北药学杂志, 2002(4): 155-157.
[31]鲍艳霞, 钱之玉, 陈钧, 等. 豆渣固体发酵产纳豆激酶的工艺优化及其部分酶学性质研究[J]. 大豆科学, 2005(1): 43-47.
Purification and Characterization of Bacillus subtilis Nattokinase
WANG Gang1,GUO Ming-zhu2,CHEN Guang1,*
(1. College of Life Science, Jilin Agricultural University, Changchun 130118, China;2. Changchun Vocational Institute of Technology, Changchun 130033, China)
In this study, nattokinase produced by Bacillus subtilis NK-1 after shallow tray fermentation was separated and purified by 30%-70% saturation ammonium sulfate precipitation and Sephadex G-50 column chromatography and enzymatically characterized. Nattokinase activity was measured by fibrin plate method, and SDS-PAGE was used to analyze its purity. Electrophoresis-pure nattokinase was obtained, with a molecular weight of about 27.518kD. The purification factor and activity recovery were 19 and 42.1%, respectively. The optimal reaction temperature and pH of this enzyme were 50 ℃ and 8.0, respectively.
nattokinase;Bacillus subtilis;purification;characterization
Q815
A
1002-6630(2012)15-0231-04
2011-06-28
吉林省自然科学基金项目(201115189);吉林农业大学青年启动基金项目(201129)
王刚(1978—),男,讲师,博士研究生,研究方向为酶工程。E-mail:gangziccc@163.com
*通信作者:陈光(1961—),女,教授,博士,研究方向为酶工程。E-mail:chg61@163.com

