鹅肉蛋白酶解条件优化及酶解产物抗氧化活性研究
李俊江,潘道东,2,郭宇星,*,岳 娜,孙杨赢
(1.南京师范大学金陵女子学院,江苏 南京 210097;2.宁波大学海洋学院,浙江 宁波 315211)
鹅肉蛋白酶解条件优化及酶解产物抗氧化活性研究
李俊江1,潘道东1,2,郭宇星1,*,岳 娜1,孙杨赢1
(1.南京师范大学金陵女子学院,江苏 南京 210097;2.宁波大学海洋学院,浙江 宁波 315211)
运用响应面(RSM)分析对鹅肉蛋白酶解工艺条件进行优化。在单因素试验基础上,以抗氧化活性为主要指标,水解度为辅助指标,研究酶解时间、酶解温度、pH值、固液比、酶添加量对鹅肉蛋白水解度和抗氧化活性的影响。结果表明:鹅肉蛋白最佳酶解条件为酶解温度53℃、酶解液 pH10.5、固液比1:3(m/V)、酶解时间7.2h,加酶量1200U/g,在此条件下,酶解液对Fe3+还原力为0.402,水解度可达34.74%。
鹅肉蛋白;酶解;水解度;抗氧化能力
鹅肉营养丰富,蛋白质含量较高,从生物学价值上来看,鹅肉是全价蛋白质。鹅肉中脂肪含量低,而且品质好[1],蛋白质酶解有助于改善其营养价值和功能特性,在动物蛋白水解方面,孙杨赢[2]、唐道邦[3]、宋茹[4]、丁利君[5]、阎欲晓[6]、孟祥河[7]等分别对鸡肉、鱿鱼、鳕鱼、文蛤以及牛肉酶解进行了研究;国外Silva[8]、Shahidi[9]、Lahl[10]等对动物水解蛋白的特性和应用进行阐述;O,Meara等[11]以米氏方程和兰格缪耳等温吸附模型为基础,研究了熟肉的酶解动力学并对酶解反应进行了研究。近年来,已有许多关于蛋白质水解物抗氧化活性的研究报道,说明蛋白中可能蕴含着具有抗氧化活性的肽序列,选择适当的蛋白酶体外酶解蛋白有利于释放出有活性的肽段,但对鹅肉酶解产物的研究却较少。
本实验利用碱性蛋白酶水解鹅肉蛋白,在单因素试验基础上,运用响应面分析法对水解工艺条件进行优化并研究酶解产物抗氧化活性,旨在为酶解制备生物活性肽和鹅肉的深加工提供一定的参考。
1 材料与方法
1.1 材料与试剂
鹅肉(绞碎、冷藏) 市售。
中性蛋白酶(5×104U/g)、木瓜蛋白酶(80×104U/g)、碱性蛋白酶(20×104U/g) 南京奥多福尼生物科技有限公司。
1.2 仪器与设备
DS-1高速组织捣碎机 上海标本模型厂制造;HH-6数显恒温水浴锅 常州国华电器有限公司;PHS-3L型精密pH计 上海今迈仪器仪表有限公司;LDS5-1离心机北京医用离心机厂;722型可见分光光度计 上海精密科学仪器有限公司。
1.3 方法
1.3.1 鹅肉的预处理
从市场上购得鹅肉,清水洗净后,用小刀精心除去脂肪,将鹅肉用自来水冲洗,去血1h后,冷冻保藏,一段时间后取出并切成颗粒状,然后用组织捣碎机捣成泥状,放置冰箱冷冻备用。
1.3.2 鹅肉蛋白酶解工艺流程
鹅肉糜(经预处理)→按比例加水匀浆→调节pH值→加酶保温酶解→100℃灭酶15min→4500r/min离心 15min→上清液过滤→鹅肉蛋白酶解液
1.3.3 总氮含量的测定
采用凯氏定氮法[12]。
1.3.4 水解度的测定
采用茚三酮比色法[13]。
1.3.5 酶解液对Fe3+还原力的测定
Yen等[14]和Siddhuraju等[15]研究表明,抗氧化剂的还原力与其抗氧化活性之间存在联系。抗氧化剂是通过自身的还原作用给出电子而清除自由基的,还原力越强,抗氧化活性越强。因此,可通过测定还原力来说明抗氧化活性的强弱。
取0.1mL样品(酶解液)溶于2.00mL 的去离子水中,振荡使其充分混匀,加2mL 0.2mol/L 的磷酸缓冲液(pH 6.6),2mL 1%的铁氰化钾(K3Fe(CN)6)溶液,混匀后于50℃水浴保温30min,再加入2mL 10%的三氯乙酸(TCA)溶液,混匀后3000r/min 离心10min,取离心后的上清液2mL,加入2mL去离子水和0.4mL 0.1%的 FeCl3溶液,混匀后于50℃水浴保温10min,于波长700nm 处测定其吸光度,样品吸光度越大,则表示还原力越大,即抗氧化活性越强,以去离子水代替样品作为空白对照。
1.3.6 最佳酶种类的选择

表1 各种酶酶解条件比较Table 1 Optimal hydrolysis conditions of 3 different types of proteases
[2-8]的基础上,选上述3种酶对鹅肉蛋白进行酶解,分别在其适宜的 pH 值 (7.0、7.0、10.0)及温度(45、45、45℃) 条件下[16-17],以 1200U/g 的加酶量,酶解鹅肉蛋白6.5h,用茚三酮比色法测定酶解液吸光度并计算出相应的水解度,并测定其还原力,通过比较确定最适宜的酶。
1.3.7 最佳酶解条件的单因素试验
1.3.7.1 最佳酶解时间的确定
选取碱性蛋白酶,在鹅肉糜、蒸馏水固液比1:3(m/V)、加酶量1200U/g、温度45℃、pH10.0的条件下,选取酶解时间为2、4、6、8h,考察酶解时间对鹅肉蛋白水解度和还原能力的影响。
1.3.7.2 最佳固液比的确定
选取碱性蛋白酶,在酶解时间为6h,加酶量1200U/g,酶解温度45℃,pH10.0的条件下,选取固液比1:1、1:2、1:3、1:4、1:5,考察固液比对鹅肉蛋白水解度和还原能力的影响。
1.3.7.3 最适加酶量的确定
选取碱性蛋白酶,在酶解时间为6h,固液比为1:3(m/V),酶解温度45℃,pH10.0的条件下,选取酶的添加量为700、900、1100、1200、1300、1500U/g,考察加酶量对鹅肉蛋白水解度和还原能力的影响。
1.3.7.4 最适pH值的确定
选取碱性蛋白酶,在酶解时间为6h,固液比为1:3(m/V),酶解温度45℃,加酶量1200U/g的条件下,选 取pH值为7、9、10、11、12,考察pH值对鹅肉蛋白水解度和还原能力的影响。
1.3.7.5 最适酶解温度的确定
选取碱性蛋白酶,在酶解时间为6h,固液比为1:3(m/V),pH10.0,加酶量1200U/g的条件下,选取温度为40、45、50、55、60℃,考察酶解温度对鹅肉蛋白水解度和还原能力的影响。
1.3.8 响应面分析试验
根据单因素试验结果,运用Box-Behnken的中心组合试验设计原理。以酶解温度(X1)、酶解时间(X2)、pH值(X3)为变量,展开三因素三水平的响应面试验,因素水平设计见表2。采用F检验对试验结果进行方差分析以评价模型的统计意义。数据分析软件采用Design-Expert 7.1.3。

表2 Box-Behnken试验设计Table 2 Coded and real values of the variables involved in Box-Behnken experimental design
2 结果与分析
2.1 最佳酶种类的选择

图1 不同蛋白酶对鹅肉蛋白酶解效果的影响Fig.1 Effect of protease type on hydrolysis efficiency of goose meat protein
由图1可知,不同的蛋白酶,由于其水解蛋白质时,作用的位点不同,抗氧化活性就不同,木瓜蛋白酶的作用位点较广泛,因而可能把一些具有抗氧化活性的多肽水解成短肽,从而降低抗氧化活性,而中性蛋白酶的作用活性位点主要是Leu-Phe-,因而在水解过程中水解物暴露的活性位点不够,抗氧化活性较低,而碱性蛋白酶的活性位点为Ala-Leu-Val-Tyr-Phe-Trp-,因而水解过程中暴露的活性位点较多,对酶解鹅肉蛋白抗氧化性活性效果最好,其值为0.427,水解度也最大,达到33.10%,故选取碱性蛋白为本实验的最适水解酶。
2.2 单因素试验结果分析
2.2.1 酶解时间的选择
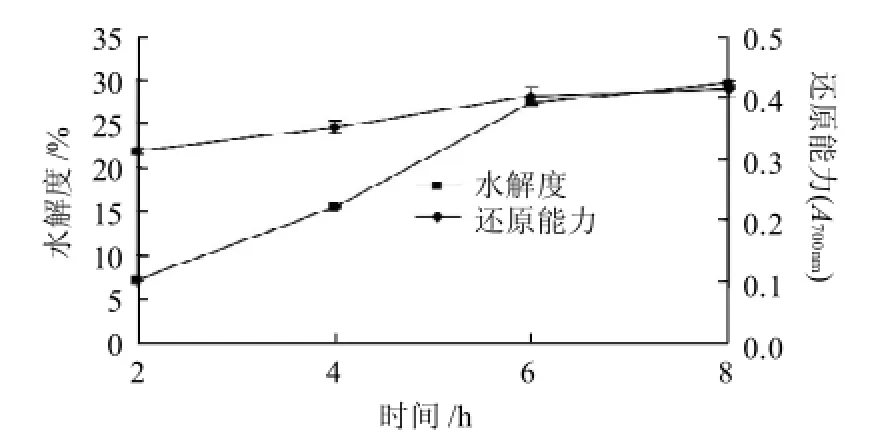
图2 酶解时间的选择Fig.2 Effect of hydrolysis time on hydrolysis efficiency of goose meat protein
酶解时间会影响鹅肉蛋白的酶解反应,时间短酶解反应不彻底,时间过长又有可能出现过度水解,从而影响鹅肉蛋白抗氧化肽的抗氧化活性。由图2可知,随着酶解时间的延长,在一定范围内,水解度和抗氧化性不断增加,当时间为6h时,对Fe3+还原能力为0.401,水解度为27.35%,此后,随着底物逐渐被转化,水解度增加速度变慢,并有平缓的趋势,考虑到时间太长不利于工业应用,水解度增加也不显著,因此,综合考虑水解效率、能源消耗、生产成本的问题,最优反应酶解时间选择6h。
2.2.2 固液比的选择
固液比的变化会引起酶反应体系中底物浓度和酶浓度的变化,当底物浓度较高时,酶的作用效率较低,导致水解度较低,而底物浓度较低时,尚有一部分游离酶未与底物结合,其催化功能没有完全发挥,故水解不完全,进而对酶解液的抗氧化活性产生影响。
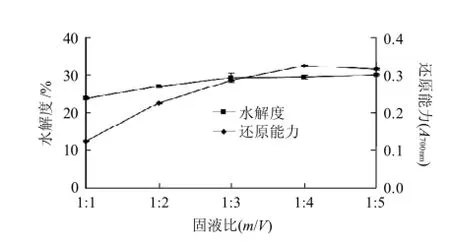
图3 酶解固液比的选择Fig.3 Effect of solid-to-liquid ratio on hydrolysis efficiency of goose meat protein
由图3可知,随着固液比的增大,即随着底物浓度的降低,抗氧化活性和水解度都增加,当固液比大于1:4时,抗氧化活性开始下降,可能由于底物浓度减少,底物更好地与酶接触,加速了酶解反应,同时酶的用量是以底物计算的,固液比增加,酶的浓度也有所减少,综合考虑效率及成本的问题,因此固液比1:3为最适。
2.2.3 加酶量的选择

图4 加量酶的选择Fig.4 Effect of enzyme dose on hydrolysis efficiency of goose meat protein
加酶量会引起酶反应体系中酶浓度的变化,进而影响鹅肉蛋白的酶解效果,从而影响鹅肉蛋白水解度和抗氧化活性。由图4可知,随着加酶量的增加,抗氧化性逐渐增大,当加酶量为1200U/g左右时,酶解液的抗氧化活性和水解度均达到最大值,分别为0.400和24.58%,此后,随着加酶量的增加,酶解液的抗氧化活性开始减小,因此,加酶量为1200U/g左右较为合适。
2.2.4pH值的选择

图5 酶解pH值的选择Fig.5 Effect of pH on hydrolysis efficiency of goose meat protein
pH值影响酶的稳定性,改变 pH值大小,即改变溶液中 OHˉ浓度,会影响蛋白酶自身的解离和底物的解离,从而影响酶解反应,所以pH值对酶解反应影响很大。由图5可知,随着pH值的增加,水解度和酶解液的抗氧化活性开始逐渐增大,当pH10左右时,水解度和酶解液的抗氧化活性均达到最大值,分别为0.424和32.00%,此后,随着pH值增加,水解度和酶解液的抗氧化活性开始迅速减小,因此,反应体系pH10左右较为合适。
2.2.5 酶解温度的选择

图6 酶解温度的选择Fig.6 Effect of temperature on hydrolysis efficiency of goose meat protein
在一定的温度范围内随着反应温度的升高,抗氧化活性不断增加但超过一定温度后,抗氧化活性会随着温度的升高而降低。这是因为在一定范围内升高温度,反应速度加快,酶解效率也相应提高,但温度过高,酶蛋白变性,酶的稳定性下降,酶解效率随之降低。由图6可知,随着温度的升高,水解度和酶解液的抗氧化活性逐渐增大,当温度达到50℃时,水解度和酶解液的抗氧化活性均达到最大值,分别为25.19%和0.433,此后,随着温度的继续升高,水解度和酶解液的抗氧化活性开始下降,因此,反应温度50℃左右较为合适。
2.3 响应面试验分析
根据单因素试验结果,固液比及加酶量对水解度和抗氧化活性影响不如其他3个因素,因此以水解温度、水解时间、pH值为变量,进行三因素三水平的响应面试验。

表3 Box-Behnken试验设计及结果Table 3 Box-Behnken experimental design and results
碱性蛋白酶水解鹅肉蛋白的工艺条件优化根据Box-Behnken试验设计进行了17组试验, 5组为中心点重复试验(表3)。由于抗氧化值与水解度不存在线性关系[3],但可能在一定范围内水解度对抗氧化活性有促进作用,为了选取鹅肉蛋白抗氧化活性的最大值,因而本实验把抗氧化活性作为最近水解条件的第一指标,水解度作为辅助指标,利用Design-Expert 7.1.3软件对抗氧化活性Y1与各水解因素进行多元回归拟合,得二次多项式拟合方程为:Y1=0.43+0.051X1+0.017X2ˉ0.002X3ˉ0.025X1X2ˉ 0.008X1X3ˉ0.014X2X3ˉ0.088X12ˉ0.097X22ˉ0.072X32。

表4 抗氧化活性为响应值的二次多项式模型方差分析Table 4 Variance analysis for the fitted quadratic polynomial model describing reducing power
由表4可知,本实验所选用的二次多项式模型具有高度显著性(P<0.0001)。而F值为50.04,其模型不显著概率小于0.0001,失拟项的F值为3.20,存在14.54%的概率失拟,R2为0.9847,表明该回归方程回归效果比较好,R2Adj为0.9650,表明该方程可信度高,失拟项不显著(P<0.05),表明实验模型拟合程度良好。
由表5可知,X1(酶解温度)、X2(酶解时间)、X1X2(酶解温度与时间),还有全部二次项对抗氧化活性的影响都显著,各个具体试验因素对响应值的影响不是简单的线性关系,而是二次抛物线的关系,说明响应值的变化较为复杂。由F值可知,酶解温度(X1)、酶解时间(X2)在试验过程中起主要作用,而pH值(X3)对水解效果影响较小。由以上分析得出,运用Design Expert 7.13得出碱性蛋白酶水解鹅肉的最佳工艺参数。

表5 抗氧化活性为响应值的回归方程系数显著性检验Table 5 Significant test of each regression coefficient in the fitted quadratic polynomial model describing reducing power

图7 各因素交互作用对抗氧化活性的影响Fig.7 Response surface plots for the interactive effects of different variables on reducing power
通过图7即可对任何两因素交互影响抗氧化活性效应进行分析与评价,并从中确定最佳因素水平范围。结果表明,酶解时间和酶解温度交互作用对抗氧化活性影响显著,其他各因素的交互作用不是很显著。
2.6 验证实验
根据Box-Behnken 试验所得的结果和二次多项式回归方程,利用Design Expert 7.1.3 软件获得了各因素的最佳酶解条件组合为:酶解温度52.96℃、酶解时间7.21h、pH10.46、固液比1:3、加酶量1200U/g,此时对Fe3+还原力为0.395,水解度达35.27%。为了检验模型预测的准确性,选取酶解时间7.2h,固液比1:3,加酶量1200U/g,pH10.5,酶解温度53℃,做3组平行实验,水解度可达34.74%, 对Fe3+还原力为0.402所得结果与最佳理论条件下所得的结果误差均在±1%以内,由此可见,以抗氧化活性为指标,采用响应面分析法对碱性蛋白酶酶解鹅肉蛋白工艺条件进行优化是行之有效的。
3 结 论
实验确定了酶解鹅肉蛋白的最佳用酶为碱性蛋白酶。通过单因素试验和响应面试验分析,各酶解因素对鹅肉蛋白酶解液抗氧化活性的影响顺序为:酶解温度>酶解时间>pH值。利用响应面法优化鹅肉抗氧化肽的最佳工艺条件为:酶解温度53℃、pH10.5、固液比1:3、酶解时间7.2h,加酶量1200U/g,在此条件下水解鹅肉蛋白,水解度可达34.74%,对Fe3+还原力为0.402。此结果可为今后鹅肉蛋白抗氧化活性肽的分离纯化提供有利基础。
参考文献:
[1]王健, 赵万里, 王志跃. 肉用仔鹅的营养需要研究进展[J]. 山东家禽, 2001(3): 35-37.
[2]孙杨赢, 潘道东, 郭宇星. 鸡肉蛋白酶解及其抗氧化性的研究[J]. 食品科学, 2010, 31(24): 56-61.
[3]唐道邦, 裴小平, 徐玉娟, 等. 响应曲面法优化鸡肉蛋白抗氧化肽制备工艺研究[J]. 食品科学, 2010, 31(6): 86-90.
[4]宋茹, 谢超, 崔晓旭. 酶解法制备鱿鱼蛋白抗氧化肽工艺优化[J]. 浙江海洋学院学报, 2009, 28(3): 311-314.
[5]丁利君, 钟森辉. 鳕鱼蛋白酶解工艺优化及酶解液抗氧化研究[J]. 食品科学, 2008, 29(8): 398-401.
[6]阎欲晓, 粟桂娇, 李小梅, 等. 文蛤蛋白抗氧化活性肽的研究[J]. 食品工业科技, 2007, 28(12): 121-123.
[7]孟祥河, 张萜华. 复合酶水解牛肉的研究[J]. 食品科技, 2002(2): 17-20.
[8]SILVA M E M P E, MAZZILLI R N, CUSIN F. Composition of hydrolysates from meat[J]. Journal of Food Composition and Analysis, 1999, 12(3): 219-225.
[9]SHAHIDI F, HAN Xiaoqing, SYNOWIECKI J. Production and characteristics of protein hydrolysates from capelin(Mallotus villosus)[J]. Food Chemistry, 1995, 53(3): 285-293.
[10]LAHL W J, BRAUM S D. Enzymatic production of protein hydrolyales for food use[J]. Food Technology, 1994, 48(10): 68-71.
[11]O,MEARA G M, MUNRO P A. Effects of reaction variables on the hydrolysis of lean beef tissue by alcalase[J]. Meat Science, 1984, 11(3): 227-238.
[12]张水华. 食品分析[M]. 北京: 中国轻工业出版社, 2004: 156-160.
[13]徐英操, 刘春红. 蛋白质水解度测定方法综述[J]. 食品研发与开发, 2007, 28(7): 173-175.
[14]YEN G C, DUH P D, TSAI C L. Relationship between antioxidant activity and maturity of peanut hulls[J]. Agric Food Chem, 1993, 41(1): 67-70.
[15]SIDDHURAJU P, MOHAN P S, BECKER K. Studies on the antioxidant activity of Indian laburnum (Cassia fistula L.): a preliminary assessment of crude extracts from stembark, leaves, flowers and fruit pulp [J]. Food Chem, 2002, 79(1): 61-67.
[16]杨二刚, 童群义. 复合酶水解鸡肉工艺条件的优化[J]. 安徽农业科学, 2008, 36(14): 6083-6084.
[17]郭玉华, 曾名勇. 牡蛎酶解工艺的研究[J]. 中国海洋药物杂志, 2008, 27(2): 37-41.
Optimization of Enzymatic Hydrolysis of Goose Meat Protein and Antioxidant Activity of Its Hydrolysate
LI Jun-jiang1,PAN Dao-dong1,2,GUO Yu-xing1,*,YUE Na1,SUN Yang-ying1
(1. Ginling College, Nanjing Normal University, Nanjing 210097, China;2. School of Marine Sciences, Ningbo University, Ningbo 315211, China)
This paper deals with the optimization of process conditions for the enzymatic hydrolysis of goose meat protein using response surface methodology (RSM). The effects of hydrolysis time, temperature, pH, solid-to-liquid ratio and enzyme dose on degree of hydrolysis and antioxidant activity of hydrolysates were investigated based on single factor experiments. The optimal hydrolysis conditions were found to be 53 ℃, pH 10.5, 1:3 solid-to-liquid ratio, time 7.2 h,1200 U/g enzyme dose. The degree of hydrolysis under these conditions and the reducing power of the hydrolysate obtained were 34.74% and 0.402, respectively.
goose protein;enzymatic hydrolysis;hydrolysis degree;antioxidant activity
TS251
A
1002-6630(2012)03-0126-05
2011-06-15
国家水禽(水禽肉类加工)产业技术体系建设专项(CARS-43-17);江苏省科技支撑计划项目(BE2009366);江苏省教育厅高校自然科学基金项目(10KJB550003);国家自然科学基金青年科学基金项目(31101314);江苏省自然科学基金项目(BK2011787);南京师范大学特聘教授、高层次人才科研启动基金项目(184070H2B08)
李俊江(1988—),男,硕士研究生,研究方向为农产品加工。E-mail:jeron1988@163.com
*通信作者:郭宇星(1981—),女,讲师,博士,研究方向为乳品科学。E-mail:yuxingguo1981@yahoo.com.cn

