乳源ACE抑制肽的制备及应用
王佳佳,胡志和*
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
乳源ACE抑制肽的制备及应用
王佳佳,胡志和*
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
近年来高血压成为威胁人类健康的第一大慢性病,由于常规降压药物对人体的损害,食源性降压肽成为研究的热点。目前研究发现了多种乳源ACE抑制肽,并得到应用。本文综述乳源ACE抑制肽的制备、纯化及应用现状。
高血压;降压药物;ACE抑制肽;应用
随着经济的发展,生活水平显著提高,饮食中脂肪和热量的比重上升,同时机械的发展使得体力活动减少,使我国心血管疾病的发病率呈逐年快速上升趋势,并成为我国高死亡率、高致残率和高医疗费用的第一大慢性疾病。心血管疾病以冠心病为主,冠心病又称冠状动脉硬化性心脏病,而高血压是动脉粥样硬化的重要危险因素[1],且血压水平与心血管发病危险呈正相关[2]。在WHO/ISH、ESH/ESC和中国高血压治指南[3-5]中强调了控制收缩压的重要性,阐述选择降压药物的原则以及联合用药干预心血管危险因素的高血压治疗新观念,但这些降压药物都有一定的毒副作用,如对心脏和肾造成损害或者对于特殊人群如心衰患者有使用限制[6]。
人们逐渐发现食物蛋白质水解后形成的小分子多肽具有明显的降血压作用,它与普通降压药物相比具有无毒副作用,且对正常的血压无影响等优点。研究表明,这些小分子多肽是一种血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制肽,即ACE抑制肽,因此,来源于食物蛋白中的ACE抑制肽越来越受到现代社会广泛重视[7]。通过水解所得的生物活性肽,其分子质量较小,在小肠内可以以完整肽段的形式被人体吸收,安全性好,不会引起人体的免疫排斥反应,加之其生理功能强、用量少的独特优势,已越来越多地引起人们的重视,其工业化生产也成为当前功能性食品研究的重点[8],本文对有关乳源ACE抑制肽的研究与应用前景进行相关的阐述。
1 高血压
1.1 高血压的危害
高血压病是近年来最常见的心血管病,是全球范围的重大公共卫生问题。据流行病学的研究,高血压损伤靶器官,引起多种心脑血管疾病和肾脏疾病,最终导致患者致残和致死,血压的升高是脑卒中和冠心病发病的独立危险因素,防治高血压是预防心脑血管病的关键。研究表明目前美国约有5000万人患有高血压,日本60岁以上的老年人中约有60%患有高血压[9],在我国高血压患者已超过1.6亿[10],高血压的发病率在世界范围内的日益增高,越来越受到广泛关注。在近10年的国际及国内高血压的流行趋势都显示高血压仍处在一种高发病低控制的状态。因此,对于高血压的防治已经迫在眉睫。
1.2 传统降压药物的分类评价与食源性ACE抑制肽的优势
高血压的诊断标准是血压水平≥140/90mmHg,它的药物治疗目标是使高血压病人的血压水平能非常严格的控制在此水平之下,其终极目标是使心血管发病和死亡发生的总危险长期受到抑制[11]。
目前用于抗高血压药物治疗的有6种主要的降压药物,它们分别是利尿剂、β-阻滞剂、钙拮抗剂、ACE抑制剂、血管紧张素Ⅱ受体拮抗剂和α-肾上腺素能受体阻滞剂[6]。通过合理的用药原则,这些降压药物能显著降低血压。但是它们都有一定的毒副作用,不良反应有过敏性血管水肿、咳嗽、肾功能不全加重、高血钾和致畸形等[12]。而且原发性的高血压中有些属于轻度高血压即高血压前期(130~139)/(85~89)mmHg与正常血压<130/84mmHg相比,由于血压水平升高幅度较小,且部分具有朝着正常波动的趋势,所以是否选择药物治疗引起争议。而由蛋白质在温和的条件下被蛋白酶水解而得到的ACE抑制肽对高血压患者具有降压作用,而且性质温和并对正常血压的人无作用,它还具有免疫活性、促进消化吸收并具有减肥等多种功效[13],由此,食源性ACE抑制肽逐渐成为生物活性肽研究领域的重点方向之一。
2 乳源ACE抑制肽
人体内的肾素-血管紧张素系统(rennin-angiotensin system,RAS)和激肽释放酶-激肽系统(kallikrein-kinin system,KKS)与血压的调节密切相关。RAS是升压系统,其中的血管紧张素原在肾素的作用下转化为血管紧张素Ⅰ,血管紧张素Ⅰ本身没有升高血压的作用,它可以在血管紧张素转化酶(ACE)的作用下生成至今已知的最强的升高血压活性肽。与此同时在降压系统KKS中,舒缓激肽是降压物质,它能舒张毛细血管增加其通透性,使血压下降,而ACE使得舒缓激肽的片段失活,引起血压的升高。ACE抑制肽能竞争性地抑制ACE的活性,从而阻断RAS的升血压作用,同时增强KKS的降压作用,起到降低高血压患者血压的作用。
ACE抑制肽主要来自食品中的蛋白质,目前已成功提取出的主要有乳类蛋白、植物类蛋白及动物类蛋白中的ACE抑制肽。科学研究发现,牛乳不仅含有丰富的营养成分,能够提供人类非常丰富的必需氨基酸,而且还是生物活性肽的重要来源。对乳源活性肽的研究最早开始于1979年,由Brantl等[14]第一次从牛β-酪蛋白水解物提取出了具有吗啡样活性的七肽,Mellander等[15]从酪蛋白中首次获得了酪蛋白磷酸肽(casein phosphopeptide,CPP)自此相继从乳源蛋白中的一级结构分离出许多具有生理功能的活性肽,如吗啡样活性肽、抗高血压肽、免疫调节肽、抗菌肽、抗血栓肽、促进金属离子吸收的肽、促细胞生长肽等,这其中研究最热门,最具研究开发价值的当数抗高血压活性肽。
2.1 乳酪蛋白源ACE抑制肽
牛乳中蛋白质的含量为32g/L,其中酪蛋白的含量约为26g/L。酪蛋白富含磷、吸附钙和丰富的必需氨基酸,酪蛋白的主要成分是αs1-、αs2-、β-、κ-酪蛋白,它们的质量比是3:0.8:3:1[16]。
自Maruyama等[17]于1982年在酪蛋白水解物分离出具有ACE抑制活性的12肽(CEJ12),接着又分离出ACE抑制活性更强的CEI即和CEIS后,各国研究人员采用不同的方法从酪蛋白中分离提取了更多具有不同降压效果的ACE抑制肽。Kohmura等[18]分别以人乳的α-酪蛋白和κ-酪蛋白为材料合成了具有生物活性的肽片段,经体外检测具有抑制活性。但是现在研究最多的是通过各种酶对酪蛋白进行水解从而得到具有降压作用的ACE抑制肽,如1997年Yamamoto[19]用Lactobacillus helveticus CP790蛋白酶对αs1-酪蛋白和β-酪蛋白进行了水解得到的水解物在很大程度上能抑制ACE的活性,姜瞻梅等[20]利用胰蛋白酶、胃蛋白酶、木瓜蛋白酶、As.1398中性蛋白酶和Alcalase 5种蛋白酶对牛乳酪蛋白进行酶解筛选出能够产生具有较高ACE抑制活性的AS1.398中性蛋白酶,其ACE抑制肽的半数抑制质量浓度为0.68mg/mL。
2.2 乳清蛋白源ACE抑制肽
存在于乳清中的蛋白质称为乳清蛋白,约占乳蛋白质总量的17%~20%,主要包括β-乳球蛋白、α-乳白蛋白、牛乳血清白蛋白(BSA)、免疫球蛋白(Ig)等[21]。乳清蛋白的片段中包含多种生物活性序列,其中具有ACE抑制活性的序列可通过适当的蛋白酶对其水解而从乳清蛋白中释放出来。
自1996年Amhar等[22]通过对酪乳清蛋白进行水解,发现不同的蛋白酶对酪乳清蛋白水解可得到不同的酶解产物,其ACE抑制活性有很大的差异。2005年,李朝慧等[23]分别用中性蛋白酶、胃蛋白酶、碱性蛋白酶、木瓜蛋白酶和胰蛋白酶水解乳清蛋白制备ACE抑制肽,通过体外检测得出碱性蛋白酶水解物的ACE抑制率最大。2007年,Ferreira等[24]利用胰蛋白酶水解乳清蛋白,而后通过RP-HPLC分离水解物得到降压肽片段Ala-Leu-Pro-Met-His-Ile-Arg(ALPMHIR),从而得出功能性小肽可通过水解从无活性的乳清蛋白中释放出来。Costa等[25]分别用在65℃和95℃处理的变性乳清蛋白为原料,通过碱性蛋白酶,α-胰凝乳蛋白酶和Proteomix对其进行水解,发现65℃变性的乳清蛋白在α-胰凝乳蛋白酶水解作用下有较高的ACE抑制活性,饲喂SHR大鼠可改善其高血压。2009年,潘道东等[26]利用瑞士乳杆菌蛋白酶水解牛乳清蛋白,通过对水解温度、pH值、酶与底物比、底物浓度和水解时间进行优化,得到的产物ACE抑制率达到92.21%,IC50值为0.375mg/mL的高ACE抑制活性的ACE抑制肽。
2.3 发酵乳源ACE抑制肽
发酵乳是乳类经乳酸菌或其他一些有益菌发酵而制得的一类产品,与普通乳制品相比较,它具有提高乳的营养价值、改善乳的风味、增强乳的保健作用等功效。虽然乳酸菌的蛋白质水解酶系统较弱,但其胞外蛋白酶能限制性的水解乳蛋白质在发酵液中可得到一些活性多肽[27]。
发酵乳中生物活性肽的种类和性质与乳酸菌的益生效应有关,利用益生菌种Lactobacillus GG发酵,再经胃蛋白酶或胰蛋白酶消化的UHT乳中,含有αs1-酪蛋白、β-酪蛋白和α-乳清蛋白具有免疫调节活性、阿片样活性和降血压活性的相应肽段[28]。而ACE抑制活性活性的大小与乳酸菌的蛋白酶种类和活性密切相关。根据研究报道,瑞士乳杆菌有较强的蛋白酶活性,其中一些菌株制作的发酵乳制品,有较强的抗ACE活性[29-30]。
自1995年Nakamura等[31]以Lactobacillus helveticus和Saccharomyces cerovisiae菌株作为乳发酵剂制成Calpis酸乳,通过4步高效液相色谱从Calpis酸乳中纯化出两条ACE抑制肽VPP和IPP,其IC50值分别为9μmol/L和5μmol/L,并将Calpis和得到的两种小肽饲喂SHR大鼠,动物实验结果表明口服一定剂量的酸乳或这两种肽对SHR大鼠血压均有明显的改善作用,并且对正常鼠血压没有任何影响以来,筛选适当的益生菌株发酵乳类制得含有ACE抑制肽的功能性酸乳的研究报道就屡见不鲜。
2007年,潘道东[32]从两种干酪制品的混合样品中分离筛选出能发酵牛乳产生较强抗ACE活性的乳杆菌1002、1004和1006。2008年,王宇[33]比较了6个属内18种共计61株乳酸菌发酵脱脂乳后ACE抑制率的大小,结果表明不同乳酸菌菌株的ACE抑制率不同,其中乳杆菌属的ACE抑制活力最强,其次是双歧杆菌属,链球菌属、乳球菌属、明串珠菌属和片球菌属的ACE抑制活力很低。乳酸菌ACE抑制活力其蛋白水解活力正相关性。2009年,赵树平等[34]从81株分离自新疆传统酸马奶中的乳杆菌中筛选到瑞士乳杆菌(L. helveticus)ND01,利用该菌株得到的发酵乳其ACE抑制活性最大值为67.18%。
2.4 乳源ACE抑制肽的制备与纯化
ACE抑制肽一般以无活性的形式存在于蛋白质序列中,但当蛋白质通过热、酸碱的降解、酶制剂的水解或微生物的发酵等,无活性的蛋白质中可以释放出具有降压作用的ACE抑制肽。ACE的制备方法主要有5种:化学降解法、酶解法、微生物发酵法、化学合成法和基因工程法,现在研究最多的是酶解法和微生物发酵法。
在酶解法中酶水解条件温和对蛋白质的营养价值破坏小,蛋白质的水解过程易控制,而且酶可以对蛋白质进行定位水解进而产生人们所需要的特定肽类,酶解法的这些特点使得越来越多的人开始了酶解法制备ACE抑制肽的研究。
目前已用在降压肽生产过程中的蛋白质水解酶有碱性蛋白酶、中性蛋白酶、胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、Alcalase、胶原蛋白酶、嗜热菌蛋白酶、胰糜蛋白酶等。酶的选择是ACE抑制肽生产的关键,因为不同的蛋白酶水解产生的多肽活性不同,又一般不知道原料蛋白质的一级结构,并且ACE抑制肽有多种结构组成,所以应根据酶的专一性从众多的蛋白酶中进行筛选。例如Qian Zhongji等[35]利用6种不同的蛋白酶(Alcalase、α-糜蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶、胰蛋白酶)水解牛蛙的肌肉蛋白生产降压肽,通过灌胃SHR表明Alcalase蛋白酶水解物显示出高的ACE抑制活性,经分离提纯得到12肽Gly-Ala-Ala-Glu-Leu-Pro-Cys-Ser-Ala-Asp-Trp-Trp。酶法水解又可分为只用单一酶水解和两种或多种酶同时加入或按一定顺序加入进行水解的方法,在实际应用中需根据产物的活性做具体的实验摸索。
微生物发酵法是近年来生产降压肽很具前景的技术,研究发现发酵酸乳、奶酪及豆奶等许多发酵食品中都含有降压肽,它们是利用微生物发酵过程中产生的复合蛋白酶具有较高的水解度来水解蛋白质,通过对水解物的检测发现食品经发酵后含有较高活性的降压肽,这样就会大大的降低酶法生产降压肽的成本从而应用于大规模的生产中。
经酶水解或微生物发酵蛋白质会得到多种长短不一的多肽混合物,建立一套适宜的分离提取工艺是将ACE抑制肽推向商业化生产的必要条件。目前分离ACE抑制肽的方法很多,如离子交换层析、凝胶过滤层析、超滤、毛细管电泳、凝胶电泳、高效液相色谱方法等。在进行ACE抑制肽的分离提取上,一般采用几种方法相结合。目前广泛采用的先是用活性炭吸附去除高分子质量、未水解的蛋白质,用超滤除去分子质量较大的蛋白质和不溶底物,再根据分子大小,将混合物通过凝胶过滤层析柱进行分离,因ACE抑制肽的结构相近,分子质量差别小,需和离子交换层析柱串联使用[36]。代永刚等[37]采用超滤对碱性蛋白酶酶解酪蛋白制备ACE抑制肽酶解液进行初步分离,得到分子质量在4000u以下的组分,然后用凝胶柱Sephadex G-25进行进一步纯化,纯化后其相对分子质量在1500u以下,测得组分的ACE抑制活性可达62.78%,比原酶解物的ACE抑制活性高了24.77%。
3 乳源降压肽在食品中的应用
将乳源ACE抑制肽作为一种配料添加到食品中,生产出可供正常人或轻度高血压患者食用的具有预防和治疗高血压功效的功能性食品,是近年来研究降压肽的最根本目的。目前国内外已经开发出一些具有ACE抑制作用的相关产品。但是应该注意的是在食品工业生产作为食品配料用的降压肽应考虑它的感官特性和生产过程可能对它的活性的破坏作用,这是研究者们在研究过程中应当注意和解决的难题。
3.1 苦味肽的脱除
虽然酶法水解蛋白质可得到多种具有高ACE抑制活性的降压肽,但在水解的同时也会相应的有苦味肽的形成,这就严重影响了水解产物的应用。在酶解过程中,往往由于条件限制,尽管底物、酶和水解度可以选择并加以控制降低苦味,但有时也无法满足脱苦的最低条件,还需要外加措施进行脱苦,其方法主要包括选择性分离法、掩盖法、酶法等[38-40]。
1)选择分离法:根据疏水多肽的性质,采用活性炭吸附、有机溶剂抽提、树脂分离、膜分离法等技术可去除高含量疏水氨基酸苦味肽,缺点是会造成一定量的肽的损失。
2)掩盖法:是指向水解产物中加入某种物质来掩盖苦味,例如采用环化糊精、凝胶淀粉、多磷酸盐、谷氨酸、天门冬氨酸来掩盖苦味或添加苹果酸、柠檬酸、乳酸等降低苦味。
3)酶法:采用外切型蛋白酶切除肽端的疏水性氨基酸,外切型蛋白酶是一种胞外酶,故采用微生物酶能起到脱苦作用。外切酶又称端肽酶,主要作用于肽链末端的氨基酸位点。其包括氨肽酶和羧肽酶,前者作用于肽链氨基末端开始而后者是从羧基末端开始依次水解氨基酸。随着疏水性氨基酸的位置从肽链中间转移至末端或游离出来,苦味即得到了有效的降低。
但是,这些方法在苦味肽的脱除方面都是有限的,在一定程度上都会造成活性肽的损失,至今还未发现一种既能有效消除苦味肽又能保持ACE抑制肽活性的方法[41]。因此,应结合实际情况认真选择脱苦方法,现在最常用的方法是掩盖法。如王进等[42]将质量浓度为2g/100mL的β-环状糊精添加到质量浓度5g/100mL的复合肽水解液中,可使苦味基本去除,也不造成氮损失。
还应该注意的是,除了苦味的产生,在水解过程中为了使酶拥有很高的活性就要不断地添加酸或碱使得水解环境处于酶的最适pH值范围内,最后再加碱或酸中和水解产物,这就导致水解产物含有很高的盐分,也可能影响到水解物在食品中的应用。因此要对其中的盐分进行脱除,食品中盐分的脱除有多种方法[43],如离子交换、超滤、电渗析等物理、化学方法。超滤和电渗析可以有效脱除大分子化合物中的盐分,但对蛋白质水解物来说,采用超滤或渗析技术处理会造成一些低肽分子的损失[44]。
3.2 加工过程的影响
食品的加工过程虽然可以改善食品的营养、风味、货架期和安全性等,但同时也可能破坏降压肽的活性,使其活性降低或消失。对食品进行热处理主要目的分为两种:保藏处理和转化处理,在食品加工中几乎是必不可少的。然而热处理会造成氨基酸的外消旋、降解,凝胶化和与食品中的还原糖发生美拉德反应等。
单独的或在碱性环境的热处理都可以诱发氨基酸的外消旋,L-氨基酸转变成D-氨基酸,尤其是在侧链上含有很强电子电位的氨基酸,此外在有微生物存在的环境下通过微生物的氨基酸氧化酶,氨基转移酶和差向异构酶也可以使L-氨基酸转变成D-氨基酸,所以在发酵乳,酸乳酪和成熟的奶酪中发现D-氨基酸的存在。一些氨基酸的结构改变如精氨酸、丝氨酸、苏氨酸和赖氨酸等也可发生降解,如精氨酸可热解成鸟氨酸[45]。
一般无论是否在碱性环境下的热加工都会引起氨基酸的交联作用进而发生氨基酸的凝胶化。Ferreira等[24]研究发现加热诱发水解产物的凝胶化,最终的凝胶时间和凝胶强度与水解程度有很大的关联,而凝胶会使水解过程中释放的活性肽失去活性。
在有氨基和还原糖存在的环境下通过加热可发生美拉德反应。美拉德反应的发生虽然会对食品的风味产生一些积极的作用,但是伴随着一些对产品产生影响的物质的生成且反应的发生对食品的营养特性产生很大的影响,尤其是对其中的氨基酸类化合物,所以人们在食品的加工过程中要严格控制美拉德反应的发生[46]。
在产品的加工和贮藏过程中,由于氧化剂的作用或产品中感光物质的存在等产品内部会发生氧化,氧化后的物质一般都是机体不可利用的。乳制品中由于感光物质核黄素的存在故对光特别敏感。由于氧化反应对降压肽分子结构的改变进而对它们生物活性的影响,因此对产品包装的选择也是至关重要的,合适的密封包装会减弱甚至消除它们的氧化反应。
3.3 降压产品的开发
很多研究表明通过使用乳蛋白的水解物或发酵乳产品,轻微或严重的高血压患者的血压水平都会有所降低,表1列出了通过进行临床实验评价了这些降压产品的降压效果[45,47]。
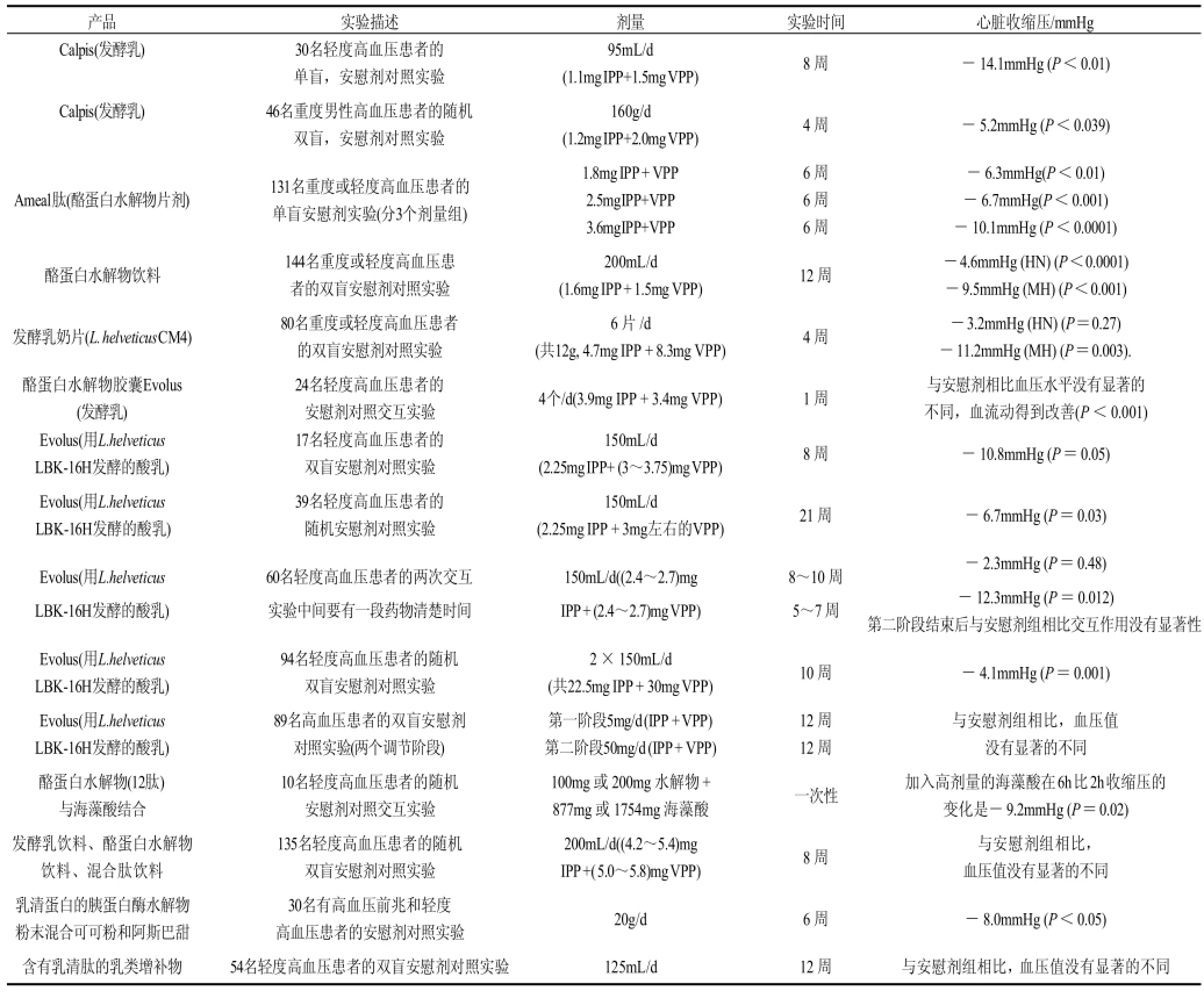
表1 含有乳源降压肽降压产品的降压效果Table 1 Antihypertensive effects of food products containing milk-derived ACE inhibitory peptides
4 结 语
营养因素在高血压的预防和治疗中发挥着重要作用已经被意识到,因此研究者致力于开发具有降血压活性的食品。乳以其特殊的营养价值,对人类和动物独特的免疫保护与生长调节功能,以及各成分之间的适宜比例是新生哺乳动物最好的营养素,而经过酶解或微生物发酵得到的乳源降压肽与原料乳相比,不仅消化吸收率变高、耐酸、耐热,而且具有多种生理调节功能。基于以上的优点,科学家们正在致力于开发具有一定的保健和营养价值,还具有较高的降血压功能,经长期食用可达到预防、控制、缓解、治疗高血压的目的功能性食品。对含乳源降压肽功能性食品的开发过程中要不断地完善其感官特性和稳定性使其在功能性食品中发挥其最大的功效。因为它具有合成降压药物所无法比拟的独特的优越性,因此,含有乳源ACE抑制肽的产品具有十分广阔的应用前景。
[1]揭红波. 浅谈心血管疾病的发病机理与预防[J]. 中外医疗, 2011(5): 184.
[2]陈绍行, 沈卫峰. 高血压治疗现状[J]. 国际心血管病杂志, 2006, 33 (2): 67-69.
[3]CHOBANIAN A V, BAKRLS G L, BLACK H R, et al. Seventh report of the joint national committee on prevention, detection, evaluation and treatment of high blood pressure[J]. Hypertension, 2003, 42(2): 1206-1252.
[4]Guidelines Committee. 2003 European Society of Hypertension-European Society of Cardiology guidelines for the management of arterial hypertension[J]. Hypertension, 2003, 21(6): 1011-1053.
[5]中国高血压防治指南修订委员会. 2004年中国高血压防治指南[J]. 中华心血管病杂志, 2004, 32(12): 1060-1064.
[6]张元宏. 高血压病的药物治疗新进展[J]. 实用医技杂志, 2007, 14(3): 382-385.
[7]张源淑, 邹思湘. 酪蛋白源生物活性肽[J]. 国外畜牧科技, 1998, 25 (4): 33-36.
[8]PARK O, SWAISGOOD H E, ALLEN J C. Calcium binding ofphosphopeptides derived from hydrolysis of a αs-casein and β-casein using immobilized trypsin[J]. Diary Science, 1998, 81(11): 2850-2857.
[9]MOTOYAMA M, SUNAMI Y, KINOSHITA F, et al. Blood pressure lowering effect of low intensity aerobic training in elderly hypertension patients[J]. Medicine Science in Sports Exercise, 1998, 30(6): 818-823.
[10]中华人民共和国卫生部, 中华人民共和国科学技术部, 中华人民共和国国家统计局. 中国居民营养与健康状况[M]. 北京: 人民卫生出版社, 2005: 15-16.
[11]马海珍. 高血压药物治疗新进展[J]. 医学理论与实践, 2011, 24(5): 514-515.
[12]MANCIA G, DE BACKER G, DOMINICZAK A, et al. 2007 Guidelines for the management of arterial hypertension: The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension(ESH) and of the European Society of Cardiology (ESC) [J]. European Heart Journal, 2007, 28(12): 1462-1536.
[13]肖红, 段玉峰, 刘平, 等. 食品蛋白降血压肽及其研究进展[J]. 食品研究与开发, 2004, 25(5): 3-6.
[14]BRANTL V, TESCHEMACHER H, LOEESPEICH F, et al. Novel opioid peptide derived from casein (β-casomorphins). I. Isolation from bovine casein peptone[J]. Physical Chemistry, 1979, 360(9): 1211-1216.
[15]MELLANDER O. The physiological importance of the casein in phosphopeptide calcium salts. II. Peroral calcium dosage in infant[J]. Acat Soc Med UPS, 1950, 55(5/6): 247-255.
[16]MATSUMOTO H, SHIMOKAWA Y, USHIDA Y, et al. New biological function of bovine α-lactalbumin: protective effect against ethanoland stress-induced gastric mucosal injury in rats[J]. Bioscience Biotechnology, and Biochemistry, 2001, 65(5): 1104-1111.
[17]MARUYAMA S, SUZUKI H. A peptide inhibitor of angiotensinⅠ-converting enzyme in the tryptic hydrolysate of casein[J]. Agric Biol Chem, 1982, 46(5): 1393-1394.
[18]KOHMURA M, NIO N, ARIYOSHI Y. Inhibition of angiotensin Ⅰ-converting enzyme by synthetic peptides of human κ-casein[J]. Agricultural and Biological Chemistry, 1990, 54(3): 825-836.
[19]YAMAMOTO N. Antihypertensive peptides derived from food proteins [J]. Biopolymers Peptide Science, 1997, 43(2): 129-134.
[20]姜瞻梅, 田波, 吴刚, 等. 酶解牛乳酪蛋白制备ACE抑制肽的研究[J]. 中国食品学报, 2007, 7(6): 39-43.
[21]顾瑞霞. 乳与乳制品的生理功能特性[M]. 北京: 中国轻工业出版社, 2001: 55-58.
[22]AMHAR A, TADAO S, MARIA V A, et al. New derivation of the inhibitory activity against angiotensin converting enzyme (ACE) from sweet cheese whey[J]. Tohoku Journal of Agricultural Research, 1996, 47(1/2): 1-8.
[23]李朝慧, 罗永康, 王全宇. 乳清蛋白酶解制备ACE抑制肽的研究[J].中国乳品工业, 2005, 33(2): 8-11.
[24]FERREIRA I M P L V O, PINHO O, MOTA M V, et al. Preparation of ingredients containing an ACE-inhibitory peptide by tryptic hydrolysis of whey protein concentrates[J]. International Dairy Journal, 2007, 17 (5): 481-487.
[25]COSTA E L D, GONTIJO J A D, NETTO F M. Effect of heat and enzymatic treatment on the antihypertensive activity of whey protein hydrolysates[J]. International Dairy Journal, 2007, 17(6): 632-640.
[26]潘道东, 郭宇星. 瑞士乳杆菌蛋白酶水解乳清蛋白制备ACE抑制肽的条件优化[J]. 食品科学, 2009, 30(11): 138-143.
[27]王海燕, 张佳程. 食品降压肽的比较与评价方法[J]. 食品与发酵工业, 2001, 27(11): 70-73.
[28]ROKKA T, EEVA L. Release of bioactive peptides by enzymatic proteolysis of Lactobacillus GG fermented UHT milk[J]. Milchwissenschaft, 1997, 52(12): 675-677.
[29]YAMAMOTO N, AKINO A, TAKANO T. Antihypertensive effect of the peptides derived from casein by an extracellular proteinase from Lactobacillus helveticus CP790[J]. Journal of Dairy Science, 1994, 77(4): 917-922.
[30]CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of angiotensin-converting enzyme of rabbit lung[J]. Biochem Pharmacol, 1971, 20(7): 1637-1648.
[31]NAKAMURA Y, MASUDA O, TAKANO T. Decrease of tissue angiotensin Ⅰ-converting enzyme activity upon feeding sour milk in spontaneously hypertensive rats[J]. Biosci Biotech Biochen, 1996, 60(3): 488-489.
[32]潘道东. 抗ACE活性之瑞士乳杆菌的筛选[J]. 食品科学, 2007, 28 (2): 145-148.
[33]王宇. 乳酸菌发酵乳抑制血管紧张素转化酶活性的研究[D]. 无锡: 江南大学, 2008.
[34]赵树平, 陈永福, 孙天松, 等. 瑞士乳杆菌ND01(L. helveticus ND01)发酵乳中ACE抑制活性和γ-氨基丁酸的研究[J]. 中国食品学报, 2009, 9(6): 48-53.
[35]QIAN Zhongji, JUNG W K, LEE S H, et al. Antihypertensive effect of an angiotensin I-converting enzyme inhibitory peptide from bullfrog (Rana catesbeiana Shaw) muscle protein in spontaneously hypertensive rats[J]. Process Biochemistry, 2007, 42(10): 1443-1448.
[36]吴炜亮, 吴国杰, 梁道双, 等. ACE抑制肽的生理功能和研究进展[J].现代食品科技, 2006, 22(3): 251-254.
[37]代永刚, 南喜平, 李铁柱, 等. 酪蛋白源ACE抑制肽的分离纯化[J].中国乳品工业, 2010, 38(10): 21-22.
[38]PEDERSEN B. Removing bitterness from protein hydrolysates[J]. Food Technology, 1994, 45(10): 96-98.
[39]唐传核. 大豆中的苦味物质及脱除方法[J]. 食品与机械, 1998(4): 10-12. [40]杜林, 李亚娜. 生物活性肽的功能与制备研究进展[J]. 中国食物与营养, 2005(8): 18-21.
[41]WU Jianping, ALUKO R E. Quantitative structure-activity relationship study of bitter di-and tri-peptides including relationship with angiotensin I-converting enzyme inhibitory activity[J]. J Peptide Science, 2007, 13(1): 63-69.
[42]王进, 何慧, 石燕玲, 等. 玉米大豆复合ACE抑制肽风味控制研究[J]. 中国粮油学报, 2008, 23(5): 65-68.
[43]赵新淮. 大豆蛋白水解物的精制研究[J]. 东北农业大学学报, 1997, 28(1): 94-97.
[44]田波, 迟玉杰. 蛋清蛋白质水解物的精制[J]. 食品科学, 2003, 24(1): 90-92.
[45]BLANCA H L, MARIA D M C, ISIDRA R. Antihypertensive peptides: production, bioavailability and incorporation into foods[J]. Advances in Colloid and Interface Science, 2011, 165(1): 23-35.
[46]OGASAWARA M, KATSUMATA T, EGI M. Taste properties of Maillard-reaction products prepared from 1000 to 5000 Da peptide[J]. Food Chemistry, 2006, 99(3): 600-604.
[47]KORHONEN H. Milk-derived bioactive peptides: from science to applications[J]. Journal of Functional Foods, 2009, 1(2): 177-187.
Preparation and Application of Angiotensin Converting Enzyme (ACE) Inhibitory Peptides Derived from Milk: A Review
WANG Jia-jia,HU Zhi-he*
(Tianjin Key Laboratory of Food and Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
In recent years, high blood pressure has become the first chronic disease threatening human health. Research into antihypertensive peptides derived from food proteins has become a hot topic. Many milk-derived angiotensin converting enzyme (ACE) inhibitory peptides have been found and applied. The present paper reviews the current status of the preparation, purification and application of milk-derived ACE inhibitory peptides.
high blood pressure;antihypertensive drugs;ACE inhibitory peptide;application
Q936.16
A
1002-6630(2012)03-0286-06
2011-09-20
王佳佳(1986—),女,硕士研究生,研究方向为食品生物技术。E-mail:jianianhuajiajia@163.com
*通信作者:胡志和(1962—),男,教授,硕士,研究方向为专用功能食品。E-mail:hzhihe@tjcu.edu.cn

