微量测定木聚糖酶活力的新方法
——MBTH法
张永勤,王 斐,曾凡伟,王哲平,张 杰,赵 鑫,程 千
(青岛科技大学化工学院,山东 青岛 266042)
微量测定木聚糖酶活力的新方法
——MBTH法
张永勤,王 斐,曾凡伟,王哲平,张 杰,赵 鑫,程 千
(青岛科技大学化工学院,山东 青岛 266042)
建立一种木聚糖酶活力的微量测定新方法——3-甲基-2-苯并噻唑酮腙(MBTH)法。根据木聚糖及其酶解产物的特殊性,研究MBTH法的显色条件,并以多点测定法对酶活力测定中的几个关键参数进行探讨。结果表明:蛋白质在其质量浓度低于30μg/mL时对测定无干扰;木聚糖溶液的最佳测定质量浓度为4mg/mL;较高的酶解温度会使木聚糖酶在测定过程中失活,因此,酶活力测定的最佳温度为30℃,而远低于该酶的最适温度;酶解时间为60min以内;酶解产物与MBTH试剂的反应时间应控制在13~16min之间,以15min为最佳。以酶解时间为30min计,本法检测限为0.135mU/mL,定量限为0.451mU/mL,适当延长酶解时间可相应提高酶活力检测灵敏度。该法准确度高,结果稳定,灵敏度远高于DNS法。
木聚糖酶;M B T H;活力;木聚糖;木糖;测定
木聚糖是一种多聚五碳糖,是植物半纤维素的重要组成成分,是自然界中继纤维素之后含量第二丰富的可再生资源。木聚糖酶是一类降解木聚糖分子中β-1,4木糖苷键的酶系,是可将木聚糖水解为低聚木糖、木寡糖、木二糖以及少量阿拉伯糖和木糖的一种复杂的复合酶系统[1],因而广泛应用于生物能源、食品、饲料、制药、制浆、造纸、纺织等行业中,已成为国内外众多学者的研究热点[2-5]。
酶活力是衡量酶生物活性的重要指标,也是控制木聚糖酶制剂产品质量的关键参数。目前常用DNS法[6-8]测定其酶活力,此法虽然简便、快捷,但灵敏度相对较低,特别不适用于酶含量极低的含酶材料的酶活力测定。本实验所采用的3-甲基-2-苯并噻唑酮腙(MBTH)法常用于检测酚类和醛类化合物[9-10],以及漆酶和锰过氧化物酶活力的测定[11-12],MBTH还可与含羰基的化合物反应[13],且测定不受低浓度醋酸盐和琥珀酸盐缓冲液的干扰,因此可用于检测木聚糖酶活力。由于该法灵敏度较高,在木聚糖酶解程度极低的条件下即可测得酶活力,而水解产物中大分子糖链的还原端基不会因分子质量的略微变化而有大的反应性改变,即不同聚合度的同类还原糖,其还原端的显色吸光系数基本相同,因此,所得活力测定数值不会像DNS法那样偏离测定真值[14-15]。近年来有人将其应用于几丁质酶、溶菌酶的活力测定[16],而将其用于木聚糖酶的活力测定还是一种新的尝试。
1 材料与方法
1.1 材料、试剂与仪器
木聚糖酶(最适pH值为5.5) 和氏璧生物技术有限公司;木糖、木聚糖(来源于榉木)、3-甲基-2-苯并噻唑酮腙(MBTH)、二硫苏糖醇(DTT) 美国Sigma公司。
SHZ-82水浴恒温振荡器 常州国华电器有限公司;FE 20数字酸度计 梅特勒-托利多仪器有限公司;UNICO 2100紫外-可见光分光光度计 尤尼柯(上海)仪器有限公司;移液器 赛默飞世尔(上海)仪器有限公司。
1.2 方法
1.2.1 木聚糖溶液的配制
准确称取木聚糖0.8000g于100mL烧杯中,逐滴加入50mL水,使其浸润并分散于水中,于80℃加热直至完全溶解,冷却至室温,转移至容量瓶中,并以水定容至50mL。以0.1mol/mL pH5.5的醋酸缓冲溶液为溶剂,将定容好的木聚糖溶液转移至100mL容量瓶中,并定容至100mL,充分混匀,配成8mg/mL的木聚糖溶液于4℃贮藏备用。
1.2.2 还原糖浓度的测定及木糖标准曲线的绘制
以MBTH为氧化剂代替通常采用的DNS来测定还原糖浓度,其原理为,MBTH首先与还原糖反应生成嗪,过量的MBTH被Fe3+氧化成氧离子,在与嗪反应生成青蓝色化合物,在一定范围内,还原糖的量和反应液的颜色强度呈正比关系,通过测定波长650nm处的吸光度表示还原糖浓度。在相同的还原糖浓度条件下,MBTH的氧化产物不同于DNS的氧化产物(橙黄-棕红色的氨基化合物),且其色度明显深于后者。
MBTH法:参照木糖质量浓度测定方法[17]并略加改动。取0.6mL木糖溶液或酶解液加入到0.6mL 0.5mol/mL NaOH溶液中,充分混匀,加入0.6mL MBTH试剂(3mg/mL MBTH溶液和1mg/mL DTT溶液等量混合即得,现用现配),混匀后于80℃水浴中加热15min 后趁热加入1.2mL硫酸铁铵试剂(0.5g/100mL (FeNH4(SO4)2)·12H2O、0.5%氨基磺酸、0.5mol/L盐酸),显色稳定后于650nm波长处测定其吸光度。每个样品做3个平行样(以下同)。其中,用于标准曲线的绘制的0.6mL木糖溶液(0~30 μ g/mL)由0.3mL的木聚糖溶液(1.2.1节配制)和0.3mL的具有不同质量浓度系列的木糖溶液(0~60 μg/mL)构成。
DNS法:参照国家标准GB/T 23874——2009《饲料添加剂木聚糖酶的活力的测定》[18]。
1.2.3 蛋白质对还原糖浓度测定的影响
将2mg/mL牛血清白蛋白溶液以对倍稀释法配制成不同质量浓度溶液,再分别与20 μg/mL木糖标准溶液等体积混合,按照1.2.2节的方法测定还原糖浓度。
1.2.4 酶活力测定
多点测定法(罐法):用于考察温度、时间对酶活力测定的影响。将预热至一定温度的0.1mL木聚糖酶溶液(以50mmol/mL pH5.5的醋酸溶液为溶剂)加入到预热至相同温度的9.9mL 4mg/mL木聚糖溶液中起始酶解反应,定时取出2mL酶解液加入到2mL 0.5mol/L的NaOH溶液中以终止反应,充分混匀,分别取出1.2mL(做3个平行样),参照1.2.2节的方法测定还原糖浓度。在考察温度对酶活力测定的影响和MBTH显色反应时间对酶活力测定的影响中,木聚糖酶质量浓度均为10μg/mL(即终质量浓度均为0.1μg/mL),后者的酶解时间为20min左右。
终点测定法(试管法):用于常规活力测定。将预热至30℃的0.3mL木聚糖酶溶液加入到预热至相同温度的0.3mL木聚糖溶液中充分混合以起始酶解反应(混合后木聚糖溶液质量浓度为4mg/mL),30min后,准时加入0.6mL 0.5mol/L的NaOH溶液中以终止酶解反应,充分混匀,参照1.2.2节的方法测定还原糖浓度。在考察酶解产物显色后的稳定性实验中,木聚糖酶质量浓度均为0.2μg/mL (即终质量浓度为0.1μg/mL)。
酶活力单位可被定义为:在上述条件下,使每毫升酶解液中每分钟产生1μmoL相当于木糖的还原糖的量为1个酶活力单位。
1.2.5 酶质量浓度曲线的建立及方法验证初步
以0.05mol/L的醋酸缓冲液(pH5.5)为溶剂配制不同质量浓度的木聚糖酶溶液,使木聚糖酶在酶解液中的终质量浓度分别为0、0.01、 0.03、 0.05、 0.07、 0.1、 0.15、0.2、 0.3μg/mL,参照1.2.4节的多点测定法进行酶活力测定。检测限(DL)和定量限(QL)是由回归直线方程确定[19],由方程(1)和(2)计算所得。

式中:Sb1是10个空白溶液的标准偏差;b为回归方程的斜率。
2 结果与分析
2.1 木糖标准曲线的绘制
木聚糖酶可催化木聚糖水解产生具有还原性木糖端基的低聚木聚糖,通过测定其还原端基或还原糖浓度的增加速率即可推算酶活力。以MBTH为氧化剂代替通常采用的DNS来测定还原糖浓度。

图1 木糖标准曲线Fig.1 Standard curves of xylose prepared using DNS or MBTH as oxidizer
由图1可知,其测定的灵敏度高于DNS法10倍以上。由于酶活力测定的灵敏度取决于相应还原糖测定的灵敏度,因此,利用MBTH法进行木聚糖酶活力的测定可显著提高测定灵敏度。针对MBTH 法测定木聚糖酶解产物还原端基以及木聚糖酶活力测定的具体特点,实验对木聚糖酶活力测定中的几个关键参数进行了研究。
2.2 蛋白质对酶活力测定的影响
有些多糖水解酶活力测定方法如BCA法[20],其检测试剂会与蛋白质发生显色反应,从而致使酶本身对显色反应产生干扰,因此需考察蛋白质对MBTH法测定的干扰情况。由于木聚糖的酶水解产物的还原端基为木糖,所以以木糖为例,配制不同蛋白质量浓度相同木糖质量浓度(10μg/mL)的木糖标准溶液,来考察蛋白质对该方法的干扰情况,结果如图2所示。当蛋白质量在250μg/mL以上时,白蛋白对测定干扰严重,而低于30μg/mL时,基本无干扰。在实验文所建立的木聚糖酶活力测定方法中,木聚糖酶的质量浓度在5μg/mL以下,因此不会干扰酶活力测定。
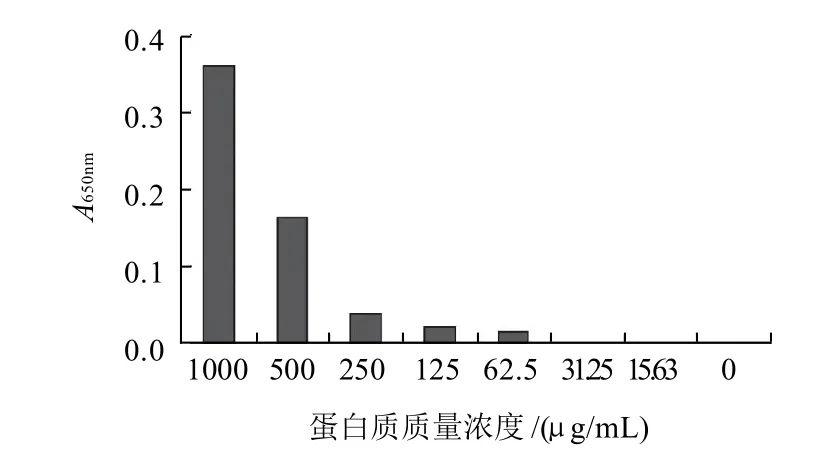
图2 蛋白质对还原糖测定的影响Fig.2 Effect of protein concentration on the determination of reducing sugar
2.3 MBTH显色反应时间对酶活力测定的影响
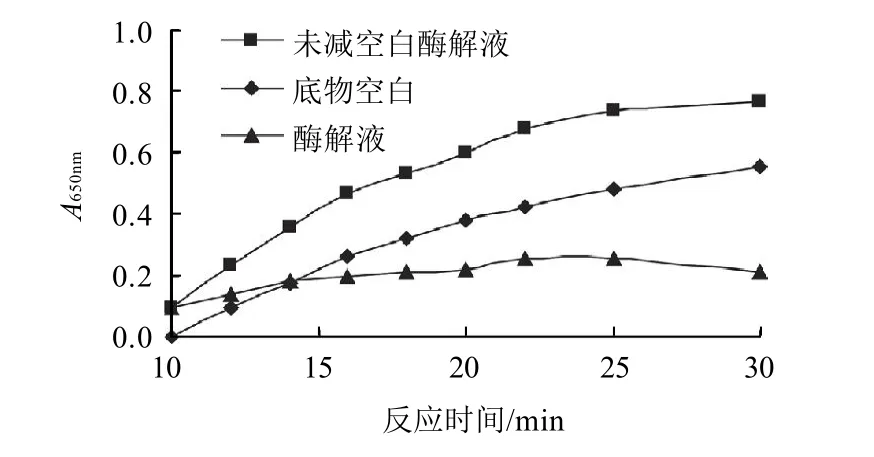
图3 MBTH与还原糖端基反应时间对酶活力测定的影响Fig.3 Effect of reaction time between MBTH and reducing sugar ends on the determination of xylanase activity
考察MBTH与酶解产物反应的时间对测定的影响,分别测定80℃水浴条件下,反应5、10、15、20、25、30、35、40min 时反应产物吸光度的变化,结果见图3,反应时间为13~16min内吸光度基本保持恒定,为了减少木聚糖本身的非酶热降解程度,因此显色反应时间定为15min。
2.4 反应产物显色后的稳定性
考察显色反应后溶液吸光度随时间的变化,分别测定显色反应后室温放置不同时间的吸光度,结果见表1。尽管显色后试剂空白与样品的吸光度都会略有变化,但减去空白后的样品吸光度在1~5h内变化较小。

表1 显色反应后的产物稳定性Table 1 Stability of chromogenic reaction products
2.5 酶解温度和时间对酶活力测定的影响
由于酶的最适温度是由多种因素相互影响而产生的综合结果,因此,用于酶活力测定的酶解温度不能简单地以酶的最适温度为测定条件。以木聚糖酶为例考察不同酶解温度和时间条件下的酶解动力学。

图4 酶解温度和时间对酶活力测定的影响Fig.4 Effect of hydrolysis temperature on the determination of xylanase activity
由图4可知,在相同酶解时间内,尽管在37、45、55℃条件下所得酶解产物都明显多于30℃,但是由于酶解速率随时间延长而逐渐降低,按照常规所采用的试管法(终点法)很难准确测得酶解初速率。这主要是因为高温容易使蛋白质变性,从而引起酶活力降低,而且,温度越高,酶蛋白变性越明显。而酶解温度为30℃时,曲线方程为一阶线性方程,即为零级反应,产物生成速率基本保持恒定,在60min内不受时间和底物质量浓度的影响。而当温度低于30℃时(如25℃),首先底物木聚糖溶液的黏度较高,底物与酶很难充分混合,从而影响酶解动力学进程;其次低温下木聚糖酶活力较低,会降低测定的灵敏度;另外,对测定的环境条件以及实验设备会有更高的要求,较难达到。因此木聚糖酶初速率的最佳测定温度为30℃,时间在60min以内。也有文献选择在37℃条件下进行酶解测定,由图4可知,酶解时间最好不要超过20min。但对于热稳定性较高的木聚糖酶,则可使用37℃,并可适当延长酶解时间。
2.6 底物质量浓度对酶活力测定的影响
由图5可知,随着木聚糖底物质量浓度的升高,还原糖生成速率逐渐升高,当木聚糖质量浓度为2.5~4mg/mL时还原糖生成速率基本保持稳定。由于定量测定酶活力一般要求底物质量浓度尽可能大,但考虑到底物质量浓度过大时,其自身还原糖浓度较高从而使本底颜色过深而影响测定,因此,确定木聚糖质量浓度为4mg/mL,以便于木聚糖酶初速率的测定。

图5 木聚糖质量浓度对酶活力测定的影响Fig.5 Effect of xylan concentration on the determination of xylanase activity
2.7 酶质量浓度对酶活力测定的影响及酶质量浓度标准曲线的建立
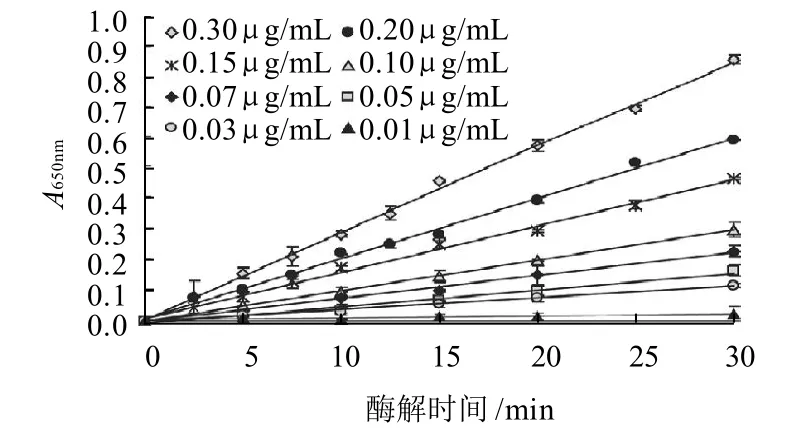
图6 不同酶质量浓度条件下的动力学曲线Fig.6 Kinetic curve of xylanase with various concentrations

图7 木聚糖酶质量浓度曲线Fig.7 Calibration curve of xylanase concentration
由图6可知,在该酶质量浓度范围内酶解动力学曲线呈线性,为零级反应,酶解速率与底物质量浓度无关,因此,可视为酶解初速率。以在上述条件下酶解30min所测酶解液中木聚糖酶活力的线性回归方程(吸光度-木聚糖酶质量浓度)为y=2.8426x+0.0084,R2=0.9983,如图7所示。其木聚糖酶质量浓度检测限为0.00316μg/mL,根据线性回归方程(还原端基酶解初速率-酶质量浓度) y=22.065x+0.0656, 其酶活力检测限为0.135mU/mL,则定量限为0.451mU/mL。由于酶活力检测的灵敏度取决于还原糖测定的灵敏度,因此,可通过适当延长酶解时间来测定较低的酶质量浓度。
3 结 论
利用多点测定法研究了木聚糖酶的酶解参数,并优化了酶解产物的显色条件,从而建立了木聚糖酶活力定量测定的新方法—MBTH法。其最佳测定条件为:在木聚糖酶的最适pH值条件下,木聚糖酶酶解温度为30℃,底物质量浓度4mg/mL,酶解时间在60min以内;在80℃条件下酶解产物与MBTH的反应时间应控制在13~16min之间,以15min为最佳。通过多点测定法对整个酶解过程的动力学研究,优化测定参数,以保证在一定酶解时间内使酶解速率保持恒定,从而可以将测定参数应用于试管法(终点法)以保证酶活力测定的准确性。
[1]杨浩萌, 姚斌, 范云六. 木聚糖酶分子结构与重要酶学性质关系的研究进展[J]. 生物工程学报, 2005, 21(1): 7-10.
[2]汤斌, 陈中碧, 张庆庆, 等. 玉米秸秆发酵燃料乙醇预处理条件的优化[J]. 食品与发酵工业, 2008, 34(6): 65-67.
[3]聂国兴, 华雪铭, 王俊丽, 等. 小麦基础饲料添加木聚糖酶对尼罗罗非鱼肠道菌群的影响[J]. 水产学报, 2009, 33(5): 805-812.
[4]李武光, 李新平, 杜敏. 木聚糖酶对漂白针叶木浆改性的研究[J]. 造纸科学与技术, 2009, 28(4): 20-22.
[5]任延刚, 朱启忠, 刘新颖. 木聚糖酶的制备及应用研究[J]. 饲料研究, 2009(9): 18-20.
[6]张永勤, 薛长湖, 汤浩源, 等. 还原糖的可见分光光度法研究进展[J].食品与发酵工业, 2007, 33(5): 97-100.
[7]LI Lite, TIAN Hongmei, CHENG Yongqiang, et al. Purification and characterization of a thermostable cellulase-free xylanase from the newly isolated Paecilomyces themophila[J]. Enzyme and Microbial Technology, 2006, 38: 780-787.
[8]苏玉春, 陈光, 白晶, 等. 双水相法提取木聚糖酶的初步研究[J]. 食品科学, 2009, 30(5): 214-216.
[9]MARIE P, MIROSLAV P, DRAHOMIRA S. Spectrophotometric study of reactions of substituted phenols with MBTH in alkaline medium: the effect of phenol structure on the formation of analytically useful coloured products[J]. Mikrochim Acta, 1998, 129: 201-208.
[10]TODA K, YOSHIOKA K I, MORI K, et al. Portable system for near-real time measurement of gaseous formaldehyde by means of parallel scrubber stopped-flow absorptiometry[J]. Analytica Chimica Acta, 2005, 531: 41-49.
[11]NAGARAJA P, SHIVAKUMAR A, SHRESTHA A K. Quantification of hydrogen peroxide and glucose using 3-methyl-2-benzothiazolinonehydrazone hydrochloride with 10,11-dihydro-5H-benz (b,f)azepine as chromogenic probe[J]. Analytical Biochemistry, 2009, 395: 231-236.
[12]JORDAAN J, LEUKES W D. Isolation of a thermostable laccase with DMAB and MBTH oxidative coupling activity from a mesophilic white rot fungus[J]. Enzyme and Microbial Technology, 2003, 33: 212-219.
[13]ANTHON G E, BARRETT D M. Determination of reducing sugars with 3-methyl-2- benzothiazohnonehydrazone[J]. Analytical Biochemistry, 2002, 305: 287-289.
[14]JEFFRIES T W, YANG V W, DAVIS M W. Comparative study of xylanase kinetics using dinitrosalicylic, arsenomolybdate, and ion chromatographic assays[J]. Applied Biochemistry and Biotechnology, 1998, 70-72(1): 257-265.
[15]BIELY P, PUCHART V. Recent progress in the assays of xylanolytic enzymes[J]. Journal of the Science of Food and Agriculture,2006, 86 (11): 1636-1647.
[16]HORN S J, EIJSINK V G H. A reliable reducing end assay for chitooligosaccharides[J]. Carbohydrate Polymers, 2004, 56: 35-39.
[17]张永勤, 王哲平, 徐杰, 等. MBTH法测木糖含量的研究[J]. 食品科技, 2010, 35(4): 247-250.
[18]GB/T 23874—2009饲料添加剂木聚糖酶活力的测定[S].
[19]MILLER J N. Basic statistical methods for analytical chemistry Part 2. Calibration and regression rethods a review[J]. Analyst, 1991, 116: 3-14.
[20]SCHOEL A, WELZEL M, KAUFMANN S H E. Quantification of protein in dilute and complex samples: modification of the bicinchoninic acid assay[J]. Journal of Biochemical and Biophysical Methods, 1995, 30: 199-206.
A Novel Method for Determining Trace Amounts of Xylanase Activity: MBTH
ZHANG Yong-qin,WANG Fei,ZENG Fan-wei,WANG Zhe-ping,ZHANG Jie,ZHAO Xin,CHENG Qian (College of Chemical Engineering, Qingdao University of Science and Technology, Qingdao 266042, China)
A novel method for the quantitative determination of trace amounts of xylanase activity was established. The chromogenic conditions were explored according to the properties of xylan and its hydrolysates. The effects of several key hydrolysis parameters on the determination of xylanase activity were investigated by multiple-point procedures. The results showed that protein concentrations less than 30μg/mL did not interfere with the determination of xylanase activity. The optimal xylan concentration for the determination of xylanase activity was 4 mg/mL. High hydrolysis temperatures could inactivate xylanase. The most appropriate temperature for determining xylanase activity was 30 ℃, much lower than the optimal reaction temperature. The hydrolysis time was controlled within 60 min. The reaction time between hydrolysates and MBTH reagent was 13-16 min with the optimal level of 15 min. Based on 30 min hydrolysis, the detection limit and quantitation limit of the method were 0.135 mU/mL and 0.451 mU/mL, respectively. Properly prolonged hydrolysis time could improve the sensitivity of the method. The method was accurate, stable and even more sensitive than the DNS method.
xylanase;MBTH;activity;xylan;xylose;determination
Q814.9
A
1002-6630(2012)03-0044-04
2011-02-19
张永勤(1965—),女,教授,博士,主要从事酶工程、生化分析研究。E-mail:zyq0205@qust.edu.cn

