低渗造影剂对老年糖尿病大鼠肾毒性的研究
王瑞强 王毅 李涛 刘闯 蒲娟娟 于洁
随着现代医学影像诊断和介入治疗的快速发展,血管内造影剂的应用越来越普及,造影剂肾病(contrast induced nephropathy,CIN)的发病率也呈上升趋势。造影剂肾病是指血管内注射碘造影剂后48 h内,在排除其他病因的前提下,肾功能发生损害,血清肌酐水平升高0.5 mg/dl(44.2 μmol/L)或比基础值升高25%以上。由造影剂引起的急性肾功能衰竭是医院获得性肾功能衰竭的常见原因,居于医院内获得性肾衰竭第3位[1]。既往无肾脏疾病的患者,其CIN发病率为3.35%~8%,平均5%,而对于患有糖尿病或肾脏疾病者,CIN发病率则明显上升高达50%[2]。老年患者由于肾小球硬化、肾血流量减少等因素的影响,在应用造影剂时更容易产生一系列不良反应[3]。
糖尿病人群中CIN的发病机制尚未完全明确,氧化应激以及信号传导是目前研究的热点。本研究通过制作老年糖尿病大鼠模型,观察低渗造影剂对肾功能和肾组织一氧化氮(NO)及谷胱甘肽(GSH)的影响,并探讨NO及GSH在CIN中的作用,从而进一步揭示CIN的发病机制。
1 材料与方法
1.1 一般材料 SD大鼠,6~7月龄雄性,体质量420~520 g,清洁级,40只,随机取出10只作为正常对照组(SD组,n=10),其余给予一次性腹腔注射链脲佐菌素(STZ Sigma公司)60 mg/kg(STZ用0.1 mmol/L,pH4.5的枸橼酸钠缓冲液配制成2%溶液),正常对照组给予腹腔注射等体积枸橼酸钠缓冲液。注射72 h后尾静脉取血检测血糖≥16.7 mmol/L、尿糖+++以上者表示老年糖尿病大鼠造模成功。大鼠饲养期间每周检测空腹尾静脉血血糖1次,根据血糖情况每天给予中效人基因重组胰岛素1~2 U,早晨一次性皮下注射,维持空腹血糖在16~26 mmol/L之间。每间隔2周测量1次体重。
8周后,26只老年糖尿病大鼠造模成功。老年糖尿病大鼠随机分成2组:糖尿病对照组(DM组,n=13);糖尿病+低渗造影剂组(LOCM组,n=13)。LOCM组经尾静脉注入欧乃派克350(10 ml/kg);DM组和SD组经尾静脉注入生理盐水(10 ml/kg)。注射2 d后处死大鼠,处死当天在1%戊巴比妥麻醉下行心脏穿刺收集血标本、肾脏标本。
1.2 检验项目与方法 血肌酐、尿素氮、血糖由全自动生化分析仪完成。
取出大鼠肾脏组织,分离出部分肾皮质,加入冰冷生理盐水制成10%组织匀浆,低温离心机离心,取上清液,测定GSH含量及NO水平(试剂盒由南京建成生物工程研究所提供),严格按照试剂盒说明操作。
2 结果
2.1 一般情况的变化 实验期间,正常对照组大鼠体重明显增加,精神状态良好,反应灵敏,动作敏捷,毛色光泽,无一只死亡。糖尿病大鼠出现多饮、多食、多尿、消瘦、精神萎靡、反应迟钝、毛无光泽,四只死亡。
2.2 肾功、血糖的变化 造模成功后,糖尿病大鼠血糖水平即明显高于正常对照组,并维持高水平至实验结束。LOCM组、DM组与SD组相比,血肌酐和尿素氮升高明显,差异有统计学意义。LOCM组与DM比较血肌酐、尿素氮升高,差异无统计学意义(见表1)。
2.3 肾脏组织匀浆一氧化氮、谷胱甘肽的变化 DM组与SD组比较,一氧化氮、谷胱甘肽降低,差异有统计学意义。应用造影剂后,LOCM组与DM组比较一氧化氮降低更明显,差异有统计学意义(见表2)。
表1 各组大鼠血肌酐、尿素氮和血糖水平比较()
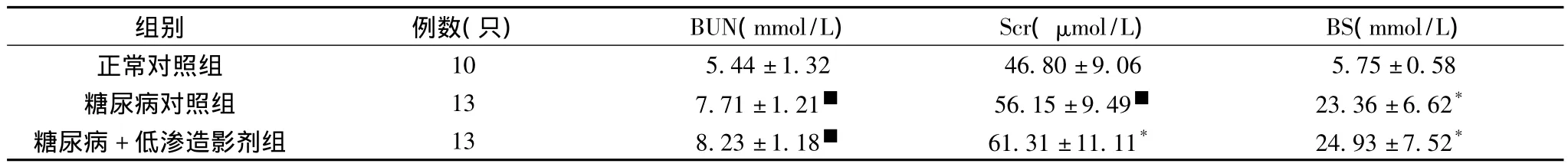
表1 各组大鼠血肌酐、尿素氮和血糖水平比较()
注:与正常对照组比较,*P<0.01,■P<0.05
组别 例数(只) BUN(mmol/L) Scr(μmol/L) BS(mmol/L)正常对照组10 5.44±1.32 46.80±9.06 5.75±0.58糖尿病对照组 13 7.71±1.21■ 56.15±9.49■ 23.36±6.62*糖尿病+低渗造影剂组 13 8.23±1.18■ 61.31±11.11* 24.93±7.52*
表2 各组大鼠一氧化氮、比较()

表2 各组大鼠一氧化氮、比较()
注:与正常对照组比较,*P<0.01,■P<0.05;与糖尿病对照比较,▲P<0.05
组别 例数(只) NO(μmol/mg pro) gsh(μmol/g pro)正常对照组10 0.31±0.05 2.23±0.16糖尿病对照组 13 0.24±0.04* 2.04±0.24■糖尿病+低渗造影剂 13 0.15±0.05*▲ 1.92±0.21*
3 讨论
糖尿病人群CIN的发病机制尚未完全明确,目前认为可能是多机制参与的,主要的发病机制有血流动力学改变导致肾脏缺氧性损伤、造影剂的肾毒性效应以及氧化应激等。临床上使用的造影剂分为离子型高渗、离子型和非离子型等渗与低渗造影剂。多数学者认为低渗、等渗造影剂的安全性优于高渗造影剂[4]。本试验选用的是在临床广泛应用的低渗造影剂。本研究发现糖尿病+低渗造影剂组与糖尿病对照组比较血肌酐、尿素氮升高不明显,但是与正常对照组比较升高明显,可能与我们选用的低渗造影剂低肾毒性有关。
活性氧(ROS)损伤作用越来越受到重视。ROS含量超过抗氧化剂含量时,常发生氧化应激反应,而且ROS作为细胞外信号分子,参与血管收缩活动。氧化应激也被认为与糖尿病的发病以及糖尿病并发症的快速进展相关[5]。有文献指出糖尿病患者本身的抗氧化能力(如谷胱甘肽过氧化物酶、超氧化物歧化酶、过氧化氢酶以及维生素C,E,A等)已经降低[6]。而且糖尿病人群常同时伴有高血压、代谢障碍、多支冠状动脉病变等其他危险因素,可能也与该人群CIN高发病率相关。由谷氨酸、半胱氨酸和甘氨酸结合而成的谷胱甘肽(GSH)被认为是复杂的抗氧化网络的中心,其半胱氨酸上的巯基为其活性基团,可以直接清除氧自由基发挥抗氧化作用[7]。但是谷胱甘肽水平随着年龄增长而降低,从而老年人容易受到氧化应激的威胁[8]。本实验发现老年糖尿病大鼠的GSH水平下降,应用造影剂后与糖尿病对照组大鼠比较GSH水平轻微下降。老年糖尿病大鼠的低GSH水平,可能使其更易受到造影剂的损害。
肾脏血管收缩因子(包括肾素一血管紧张素一醛固酮系统、内皮素、腺苷、钙离子等)和舒张因子(一氧化氮和前列腺素等)比例失调导致血流动力学改变与CIN密切相关。生物体内NO主要由一氧化氮合成酶以左旋精氨酸为底物,在还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH),黄素腺嘌呤二核苷酸(FAD),黄素单核苷酸(FMN),四氢生物蝶呤(H4B)等因子辅助下生成。生物体内NO通过扩散或其它方式传输到邻近细胞,结合并活化可溶性血红素蛋白鸟苷酸环化酶,生成环磷酸鸟苷,参与多种信号途径。NO作为信使和细胞因子参与血压调节、神经信息传递及抗感染防御等重要功能[9]。本研究发现糖尿病大鼠模型建立8周后,NO含量显著低于正常对照组,应用造影剂后NO水平进一步下降。老年糖尿病大鼠已经存在NO代谢障碍,推测低渗造影剂进一步削弱了NO的合成或加速了NO的消耗,继而出现持久的肾内血管收缩,导致肾脏缺血、缺氧,损伤肾小管,肾小球滤过率下降,加重肾功能损害。低渗造影剂影响NO的机制尚不明确,低渗造影剂是否影响到一氧化氮合成酶的合成,以及如何干预一氧化氮合成酶的功能(例如是否影响到是否影响到一氧化氮合成酶的电子传递,以及一氧化氮合成酶的空间构型是否改变)是我们团队目前的研究内容。
综上所述,低渗造影剂可以引起糖尿病大鼠肾功能的减退,这可能与其影响NO的代谢有关,这为我们今后进一步的研究指明方向。
[1]Nash K,Hafeez A,Hou S.Hospital-acquired renal insufficiency.Am J Kidney Dis,2002,39(5):930-936.
[2]Wayabill MM,Wyabill PN.Contrast media-induced nephrotoxicity:identification of patients at risk and algorhitms for prevention.J Vasc Interv Radiol,2001,12(1):3-9.
[3]Tumlin J,Stacul F,Adam A,et al.Pathophysiology of contrastinduced nephropathy.AM J Cardiol,2006,98(6):14-20.
[4]Rudnick MR,Goldfarb S,Wexler L,et al.Nephrotoxicity of ionic and nonionic contrast media in 1196 patients:a randomized trial.The Iohexol Cooperative Study.Kidney Int,1995,47(1):254-261.
[5]Abo-Salem OM,El-Edel RH,Harisa GE,et al.Experimental diabetic nephropathy can be prevented by propolis:Effect on metabolic disturbances and renal oxidative parameters.Pak J Pharm Sci,2009,22(2):205-210.
[6]Yoshida SI,Hashimoto T,Kihara M,et al.Urinary oidative stress markers closely reflect the efficacy of Candesartan treatment for diabetic nephropathy.Nephron Exp Nephrol,2009,111(1):20-30.
[7]Stojiljkovi V,Peji SA,Kasapovi J,et al.Glutathione redox cycle in small intestinal mucosa and peripheral blood of pediatric celiac disease patients.An Acad Bras Cienc,2012,84(1):175-184.
[8]Richie JP Jr,Das A,Calcagnotto AM,et al.Age related changes in selenium and glutathione levels in different lobes of the rat prostate.Exp Gerontol,2012,47(3):223-228.
[9]Palmer RM,Ferrige AG,Moncada S.Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor.Nature,1987,327(6122):524-526.

