猪伪狂犬病病毒间接ELISA 检测方法的建立
折尕才措
(青海省玉树州畜牧兽医工作站,青海玉树 815000)
猪伪狂犬病(Pseudorabies,PR)是由伪狂犬病病毒(Pseudorabies virus,PRV)引起猪的一种急性、热性、高度接触性传染病,以发热、脑脊髓炎、奇痒、呼吸和神经系统障碍为主要特征,临床上表现为怀孕母猪流产、死胎、弱胎、木乃伊胎;新生仔猪发热、神经症状、麻痹、衰竭死亡,死亡率可达100%;成年猪多耐过而呈隐性感染,并成为该病的主要传染源[1-4]。该病在世界范围内流行,给全球养猪业造成了巨大的经济损失[5-7],世界动物卫生组织(OIE)将其列为必须报告的动物疫病,我国也将其列为二类动物疫病。我国自1947年发现此病以来,现全国已有30多个省份发生流行,是严重危害我国养猪业的重要疫病之一[8-10]。为预防和控制该病的发生与流行,需加强PR诊断技术的研究与推广工作。本研究以纯化的全病毒抗原为包被抗原,优化ELISA反应条件,建立了可检测PR血清抗体的间接ELISA诊断方法,并对现地采集的猪血清进行了检测。
1 材料与方法
1.1 材料
1.1.1 病毒、细胞、血清 猪伪狂犬病病毒SA株、仓鼠肾细胞(BHK-21)由本实验室保存;CSFV、PCV-2、PRRSV、PPV、JEV、TGEV参考阳性血清及PRV参考阴性、阳性血清均由本实验室保存。
1.1.2 主要试剂 HRP标记的SPA购自武汉博士德生物工程有限公司;可溶型单组分TMB底物溶液购自天根生化科技(北京)有限公司;BSA、小牛血清,购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 PRV抗原制备 将PRV接种于BHK-21单层细胞,待细胞出现典型的病变后,收获病毒,反复冻融3次,以高速冷冻离心机8 000r/min离心30 min,取离心上清液以超速冷冻离心机35 000r/min离心120min,沉淀充分溶解于适量0.01mol/L PBS液中,35 000r/min再次离心120min。取少许0.01mol/L PBS液溶解沉淀,低速离心取上清即为PRV抗原,测定抗原浓度后,冷冻保存。
1.2.2 PRV间接ELISA反应条件的优化
1.2.2.1 抗原最适包被浓度和待检血清最佳稀释浓度的确定 采用方阵滴定法,根据阳性血清、阴性血清的P/N值,确定抗原的包被浓度和血清的稀释倍数。
1.2.2.2 最佳封闭液及封闭时间的确定 用100 mL/L小牛血清、50g/L脱脂奶粉、10g/L BSA、10 g/L明胶、PBST 5种不同封闭液分别封闭30、60、90、120、150min,按常规ELISA操作方法进行试验操作,确定最佳的封闭液及封闭时间。
1.2.2.3 待检血清及底物最佳作用时间的确定在相同的试验条件下,待检血清分别作用30、60、90、120min,底物分别作用5、10、15、20、25min,确定最佳的待检血清及底物作用时间。
1.2.2.4 判断标准的确定 选用北京世纪元亨的PRV ELISA检测试剂盒检测过的40份阴性血清样品,用所建立的间接ELISA方法进行检测,测定OD 450nm值,进行统计学分析,计算出40份血清样本平均OD 450nm值和标准差SD,根据公式(平均OD 450nm值+3×SD)计算其判定标准的临界值。
1.2.3 血清交叉反应试验 用建立的ELISA方法测定已知阳性的 PRV、CSFV、PCV-2、PRRSV、PPV、JEV、TGEV参考血清,确定血清交叉反应情况。
1.2.4 稳定性试验 选择4位操作者分别对PRV参考阳性和参考阴性血清于不同地方进行间接ELISA检测,比较不同操作者之间的结果差异。
1.2.5 比较性试验 将不同猪场送检的420份血清用北京世纪元亨的PRV ELISA试剂盒和本研究建立的间接ELISA方法同时检测,计算两者的符合率。
1.2.6 ELISA方法的应用 利用建立的ELISA方法,对山东地区送检的615份血清样品进行检测,统计血清阳性率。
2 结果
2.1 PRV抗原的制备
经差速离心提取的PRV抗原紫外吸收法测定,其浓度为1.604mg/mL。
2.2 ELISA最适反应条件确定
2.2.1 最适抗原包被浓度和血清稀释度的确定根据检测结果确定抗原的最佳包被浓度为1∶2 000倍稀释(0.802μg/mL),血清的最佳稀释度为1∶100(表1)。
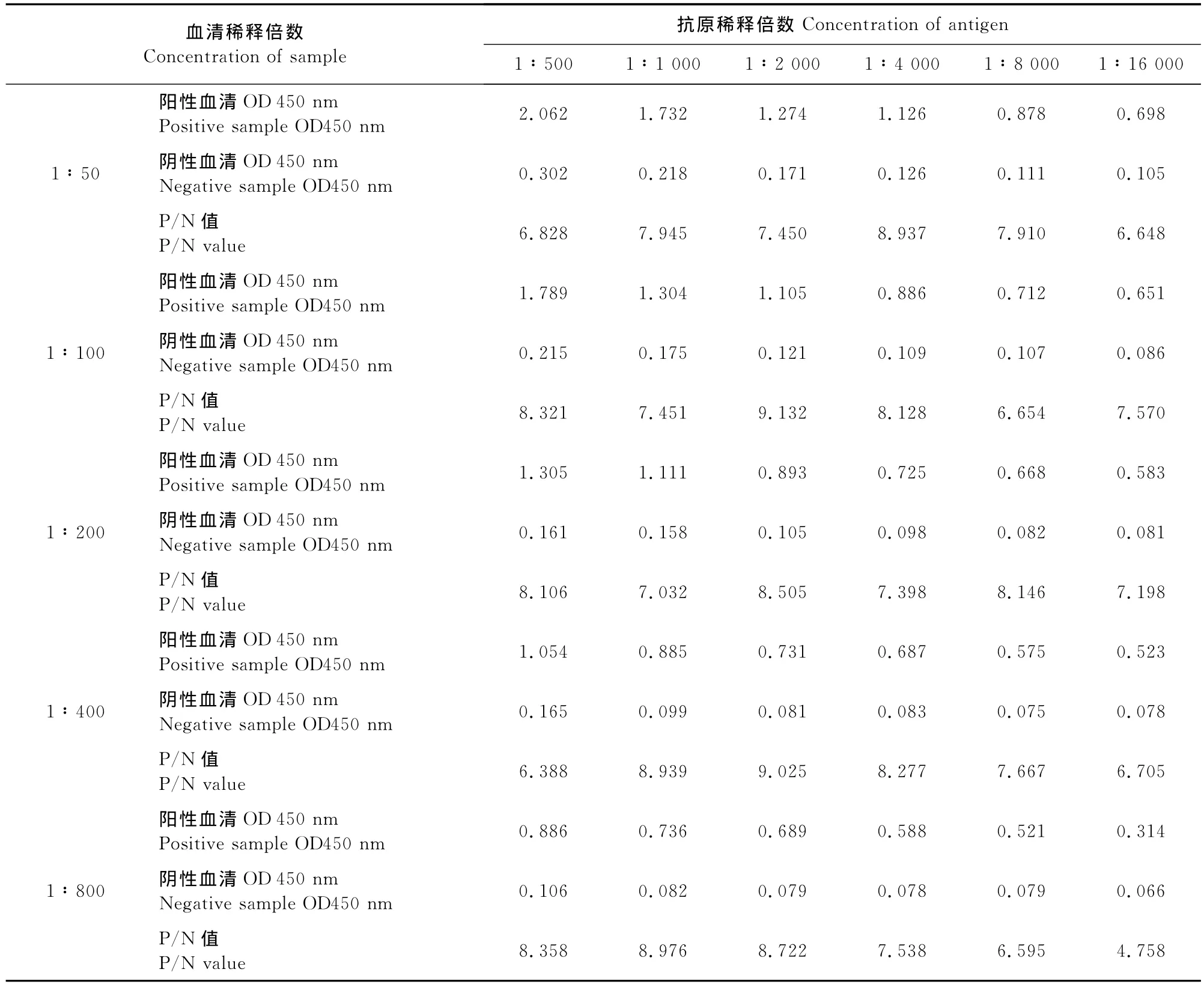
表1 血清稀释倍数与抗原包被浓度的确定Table 1 Optimization of serum concentration and antigen concentration
2.2.2 最佳封闭液及封闭时间的确定 采用10g/L BSA封闭90min,P/N值最高,因此确定最佳封闭液为10g/L BSA,最佳封闭时间为90min(表2)。
2.2.3 待检血清与底物最佳作用时间的确定 结果见表3、表4。由表3可见,待检血清作用60min时,阳性血清OD 450nm值≈1.0,阴性血清OD450nm值<0.2,且P/N值最高;由表4可见,底物作用15min时,阳性血清OD 450nm值≈1.0,阴性血清OD450nm值<0.2,P/N值较高;因此,确定待检血清的最佳作用时间为60min,底物最佳作用时间为15min。
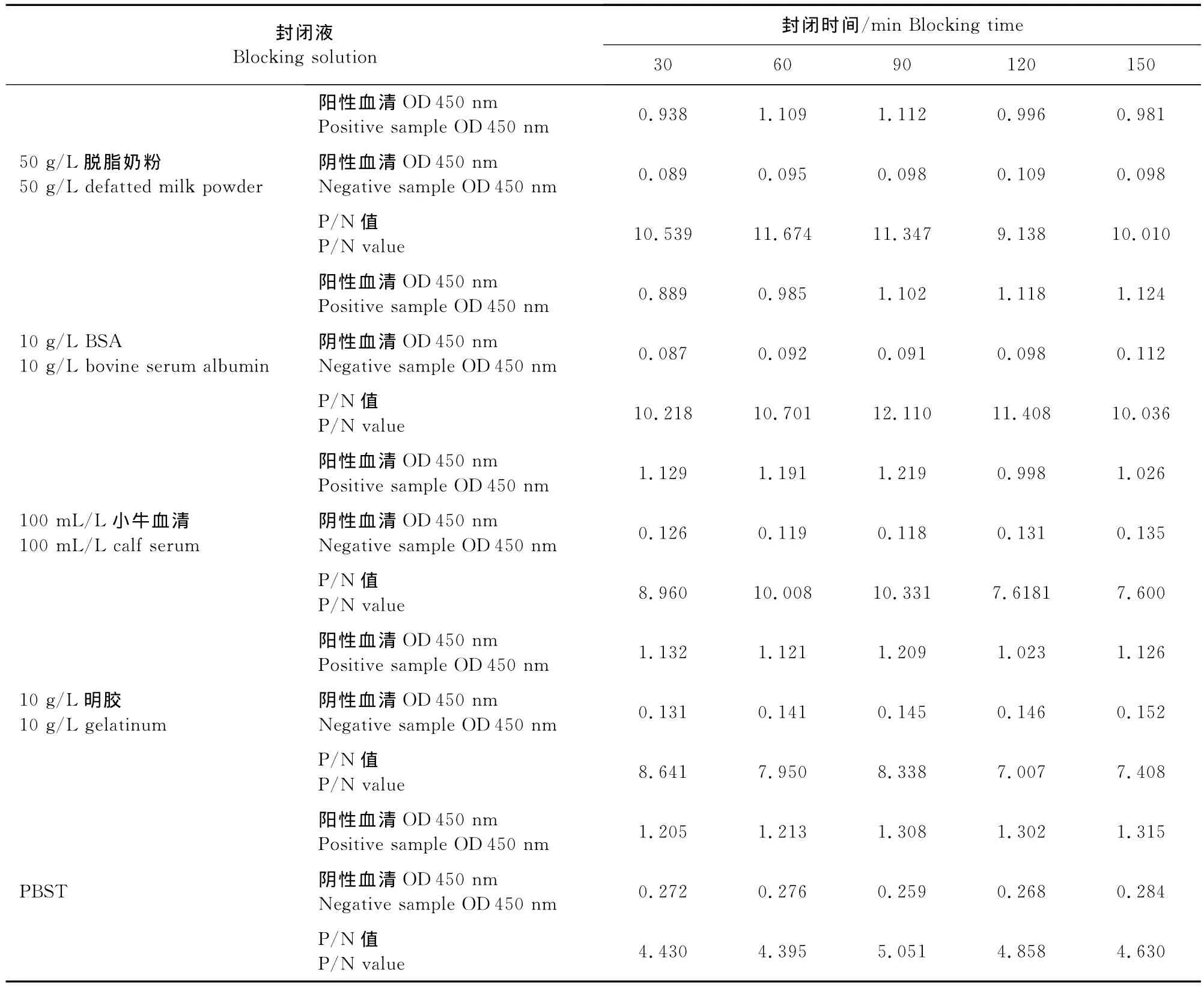
表2 最佳封闭液与最佳封闭时间的确定Table 2 Optimization of blocking solution and reaction time
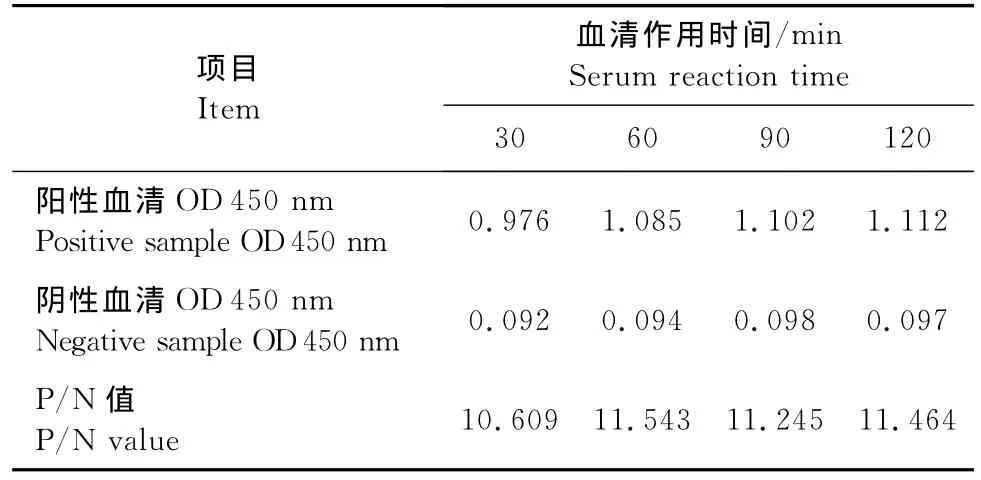
表3 血清作用时间的确定Table 3 Optimization of serum reaction time
2.2.4 判断标准的确定 对40份用北京世纪元亨的PRV ELISA试剂盒检测出的阴性血清用建立的间接ELSIA方法进行检测,结果见表5。对结果进行统计学分析,计算出血清样本平均OD 450nm值为0.174,标准差(SD)为0.061,以样本的平均 OD 450nm值+3×SD=0.357为临界值。将待测样本OD 450nm值≥0.357判为阳性,介于0.357~0.296(样本的平均OD 450nm值+2×SD)为疑似,小于0.296判为阴性。
2.3 血清交叉反应试验
用已知阳性的 PRV、CSFV、PCV-2、PRRSV、PPV、JEV、TGEV参考血清进行ELISA交叉反应,除PRV阳性血清呈阳性外,其他6种血清OD450nm值均小于0.296,证明无血清学交叉反应(表6)。
2.4 稳定性试验
4位操作者对PRV参考阳性血清检测变异系数为5.50%,PRV参考阴性血清检测结果变异系数为7.17%,均小于8%(表7),结果无显著差异,说明建立的间接ELISA方法具有良好的重复性和稳定性。
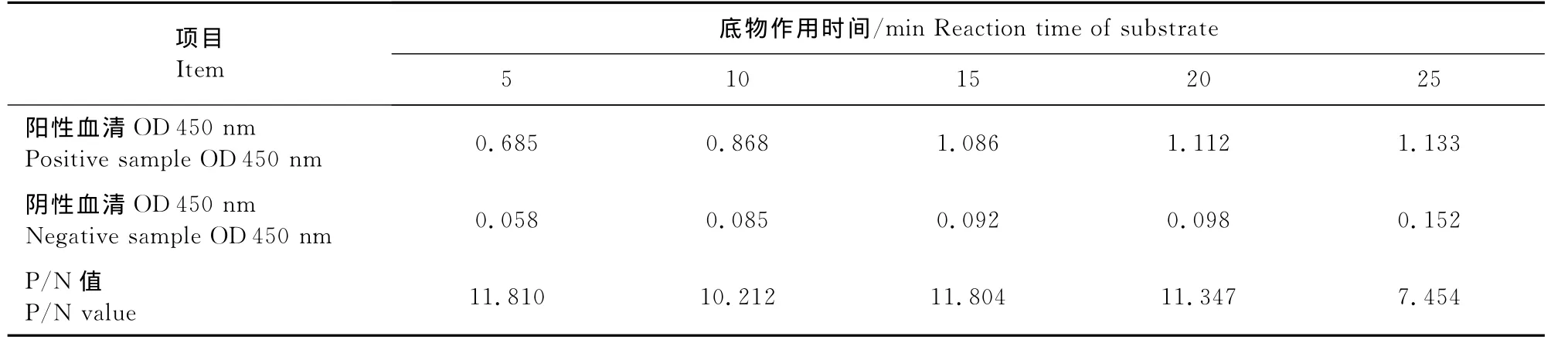
表4 底物显色时间的确定Table 4 Optimization of substrate reaction time
表5 阴性血清样品OD 450nm值Table 5 OD 450nm value of negative serum samples

表6 血清交叉反应试验Table 6 Test of serum cross-reaction
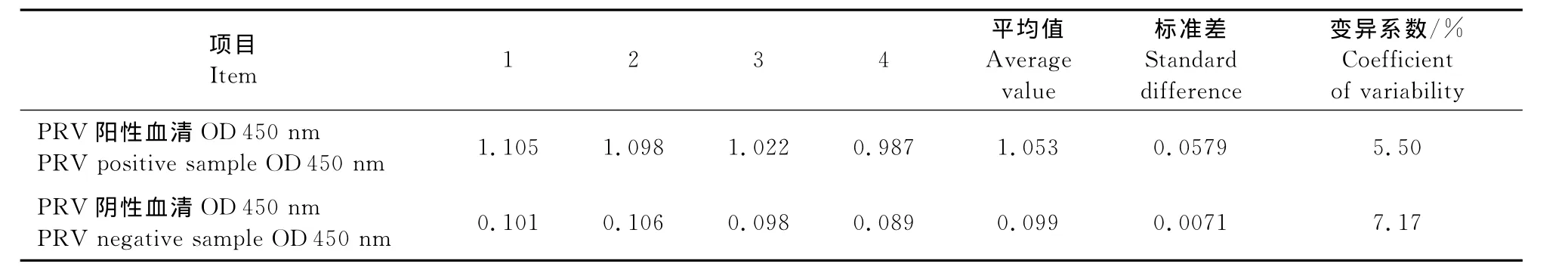
表7 稳定性试验Table 7 The test of stability
2.5 比较性试验
将不同猪场送检的420份血清用北京世纪元亨的PRV ELISA试剂盒和本研究建立的间接ELISA同时检测,北京世纪元亨ELISA试剂盒检测出阳性样品186份,本研究建立的PRV ELISA方法检测出阳性样品162份,敏感性为87.1%(162/186);北京世纪元亨ELISA试剂盒检测出阴性样品234份,本研究建立的PRV ELISA方法检测出阴性样品216份,特异性为92.3%(216/234)。两种方法的符合率为90.0%(378/420)。
2.6 PRV间接ELISA方法的应用
用建立的间接ELISA方法检测山东等各地送检的不同猪场的615份疑似PRV感染血清样本,检出阳性样品520份,阳性率为84.6%。
3 讨论
猪伪狂犬的诊断方法较多,主要包括病毒分离与鉴定、血清学及分子生物学检测方法[11]。其中,血清学检测方法是检测PRV血清抗体的重要手段之一,在PRV感染早期检测、流行病学调查和监测等方面发挥着重要的作用,也是免疫猪群抗体水平监测的主要方法。对于PRV血清学诊断,病毒中和试验是最经典、使用最广泛的诊断方法。病毒中和试验虽然准确性高,但存在试验周期长、操作繁琐和不适于大批量样品检测等缺点。ELISA检测方法具有敏感性和特异性强、操作简单、检测快速、高通量、无辐射、价格低廉等特点,是当前动物传染病检疫、流行病学调查和免疫监测广泛采用的血清学诊断技术。本研究以纯化的全病毒抗原作为包被抗原建立的间接ELISA诊断方法检测常见6种猪病的阳性血清均为阴性,显示出了良好的特异性;4位操作者检测的变异系数均小于8%,显示出了良好的重复性和稳定性;在符合性试验中本研究建立的PRV间接ELISA相对于北京世纪元亨ELISA试剂盒 的 符 合 率 为 90.0% (378/420)、敏 感 性 为87.1%(162/186)、特异性为92.3%(216/234)。造成这一现象的主要原因可能是两种方法所用的抗原纯度不同,虽然北京世纪元亨ELISA试剂盒和本研究的PRV间接ELISA诊断方法均采用全病毒作为抗原,但全病毒由于受纯化方面的限制,纯化效果较差,往往导致试验的背景值偏高。在PRV间接ELISA与北京世纪元亨ELISA试剂盒共同检测的420份血清样品中商品化试剂盒检测出阳性186份,阴性234份;PRV间接ELISA检出阳性180份,阴性240份。以上说明本研究的PRV间接ELISA诊断方法可较北京世纪元亨ELISA试剂盒进一步减少非特异性反应,尽可能的避免假阳性结果的产生,这在进出口检疫中具有明显的优势。总之,本研究建立PRV ELISA方法检测具有较好的敏感性、特异性、重复性与稳定性,显示出了良好的应用前景,本实验室预期将其组装成试剂盒,为我国PRV疫苗免疫水平抗体监测和流行病学调查等提供一种简便、快速的血清学检测方法。
[1]Rock D L,Hagemoser W A,Osorio F A,et al.Transcription from the pseudorabies virus genome during latent infection[J].Arch Virol,1988;98(1-2):99-106.
[2]Schuster F,Klupp B G,Granzow H,et al.Structural determinants for nuclear envelope localization and function of pseudorabies virus pUL34[J].J Virol,2012,86(4):2079-2088.
[3]杨 毅,李文刚,饶 宝,等.猪伪狂犬病疫苗的研究进展[J].江西农业学报,2010,22(3):154-157.
[4]Müller T,Hahn E C,Tottewitz F,et al.Pseudorabies virus in wild swine:aglobal perspective[J].Arch Virol,2011,156(10):1691-1705.
[5]Muller T,Klupp B G,Freuling C,et al.Characterization of pseudorabies virus of wild boar origin from Europe[J].Epidemiol Infect,2010,138(11):1590-1600.
[6]Wilson S,Doster A R,Hoffman J D,et al.First record of pseudorabies in feral swine in Nebraska[J].J Wildl Dis,2009,45(3):874-876.
[7]Fonseca A A Jr,Camargos M F,de Oliveira A M,et al.Molecular epidemiology of Brazilian pseudorabies viral isolates[J].Vet Microbiol,2010,41(3-4):238-245.
[8]孙圣福,陈 静,马慧玲,等.不同日龄猪伪狂犬抗体跟踪监测与分析[J].中国畜牧兽医,2011,38(4):232-233.
[9]Li F,Zhou R,Zhao K,et al.Magnetic beads-based electrochemical immunosensor for detection of pseudorabies virus antibody in swine serum[J].Talanta,2011,87(12):302-306.
[10]王小玉,李小欢,郭万柱,等.猪伪狂犬病病毒四川株的分离鉴定及 UL43基因序列分析[J].畜牧与兽医,2010,42(10):10-14.
[11]李春华,王 英,蒋凤英,等.猪伪狂犬病研究进展[J].动物医学进展,2008,29(3):68-72.

