以索拉非尼为基础治疗晚期肝细胞癌的疗效和不良反应临床观察
苑珩珩 白玉贤 张婷婷 黄鹏
哈尔滨医科大学附属第三医院消化内科,黑龙江 哈尔滨 150040
原发性肝癌是临床上最常见的恶性肿瘤之一,全球发病率逐年增长,已超过62.6万/年,居于恶性肿瘤的第5位;死亡接近60万/年,位居肿瘤相关死亡的第3位[1]。原发性肝癌在我国高发,我国发病人数约占全球的55%,在肿瘤相关死亡中仅次于肺癌,位居第二。既往有手术、TACE、射频消融、中药、免疫等治疗方法。SHARP和ORIENTAL 2个Ⅲ期试验证实,多激酶抑制剂索拉非尼组较安慰剂组在无进展生存期(progress free survival,PFS)、疾病进展时间(time to progression,TTP)和总生存期(overall survival,OS)等方面显示明显的风险比(HR)优势[2-3]。本研究回顾性分析晚期肝细胞癌患者给予索拉非尼单用或联合TACE治疗观察患者的疗效和不良反应。
1 资料和方法
1.1 一般资料
选择2009年3月—2011年1月在本院治疗和申请中华慈善总会援赠项目的30例晚期肝细胞癌患者,给予口服索拉非尼单用或联合TACE治疗,患者用药2个月后进行观察。患者的一般资料见表1。入选标准:⑴不适合手术或局部治疗,手术或局部治疗后疾病进展的晚期肝细胞癌;⑵至少有1个可测量的未治疗病灶(螺旋CT扫描≥10 mm);⑶ECOG体力状况评分0~2;⑷预期寿命至少12周的受试者;⑸能够接受治疗和随访。
1.2 方法
索拉非尼起始剂量均为每次400 mg,每日2次口服,如果发生不可耐受的不良反应,减量至每次400 mg,每日1次口服,若仍不可耐受,则再减量至400 mg,隔日1次口服,仍需减量或中断用药的患者退出本研究。20例患者在服用索拉非尼的基础上联合TACE治疗。
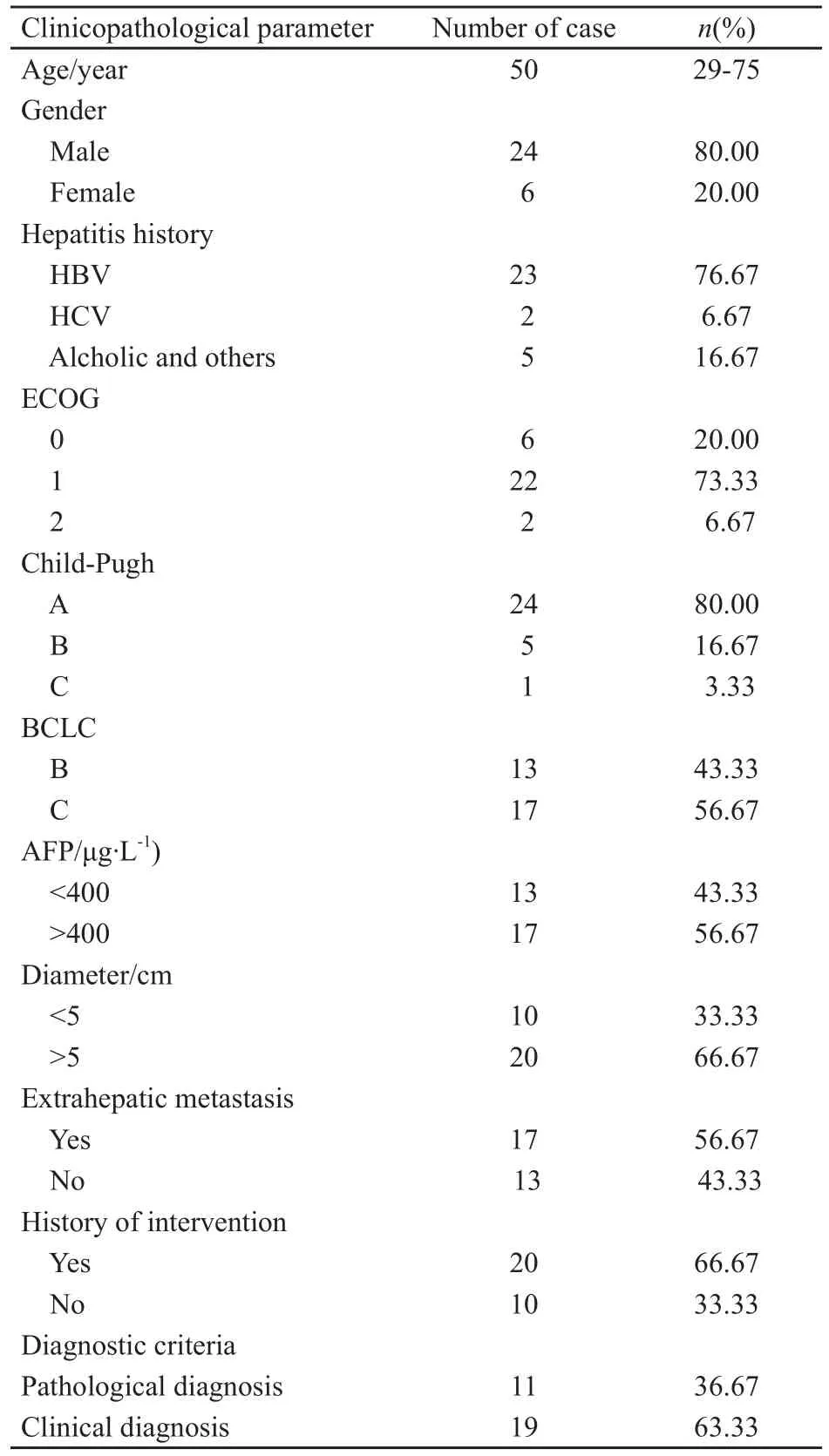
表 1 患者基本情况Tab.1 Basic conditions of patients
1.3 观察指标
按RECIST 1.0标准,每2个月评价疗效,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。观察临床获益率(clinical benefit rate,CBR)、随访中位至疾病进展时间(time to progress,TTP)和总生存期(overall survival,OS),观察不良反应。
1.4 统计学处理
所有分析用SPSS 16.0统计软件操作。单变量分析用χ2检验、Fisher’s精确检验和秩和检验。生存分析用Kaplan-Meier法,不同分组之间的比较用log-rank检验。P<0.05为差异有统计学意义。
2 结 果
2.1 疗效
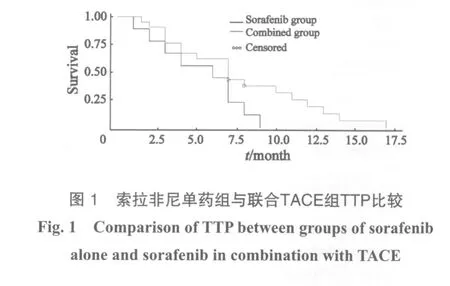
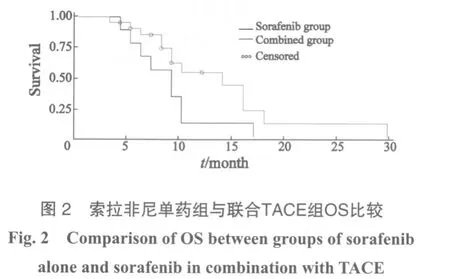
随访至2011年10月1日,30例患者中28例接受规律随访,随访率达93.3%。其中PR 3例,SD 16例,PD 11例,CBR为63.3%,其中10例单用索拉非尼组PR 1例,SD 5例,PD 4例,CBR为60.0%;20例联合治疗组PR 2例,SD 11例,PD 7例,CBR为65.0%。患者生存期为3个月的共27例(90%),6个月为24例(80%),9个月为21例(70%),生存期达1年以上的9例(30%),全组中位TTP为7个月,中位OS为9个月。在索拉非尼治疗基础上有20例患者加1~9次TACE治疗,联合组患者TTP为7个月,OS为14个月,单用索拉非尼组患者TTP为6个月,OS为9个月,根据 Kaplan-Meier法进行生存分析检验,差异无统计学意义(P=0.067 2和0.058 9,图1)。(表2)。两组患者不良反应经χ2检验,差异无统计学意义。其中1例3度手足皮肤反应患者给予减量,减量方案按照SHARP试验进行,首先减量为400 mg,每日1次,1周后仍不能耐受再减量为400 mg,隔日1次,减量2周后患者不良反应恢复至2度,给予原剂量口服可耐受;6例3度腹泻患者,2例患者未减量,继续服用同时给予黄连素 0.2 g,每日3次,口服;思密达1袋,每日3次,口服,治疗后3~5天腹泻可降至1~2度,在病程中反复出现3度腹泻,给予对症治疗有效,未减量,4例给予减量后腹泻减轻;3例3度高血压患者未减量,给予调整降压药物血压降至1~2度;1例患者出现高胆红素血症,不良反应3级,考虑可能与索拉非尼相关,停药1周,给予注射用复方甘草酸单胺160 mg+5%葡萄糖注射液250 mL,每日1次,静脉滴注,还原性谷胱甘肽注射液1 800 mg+5%葡萄糖注射液100 mL,每日1次,静脉滴注;1周后胆红素下降至不良反应2级,继续原剂量口服未再出现3级不良反应。
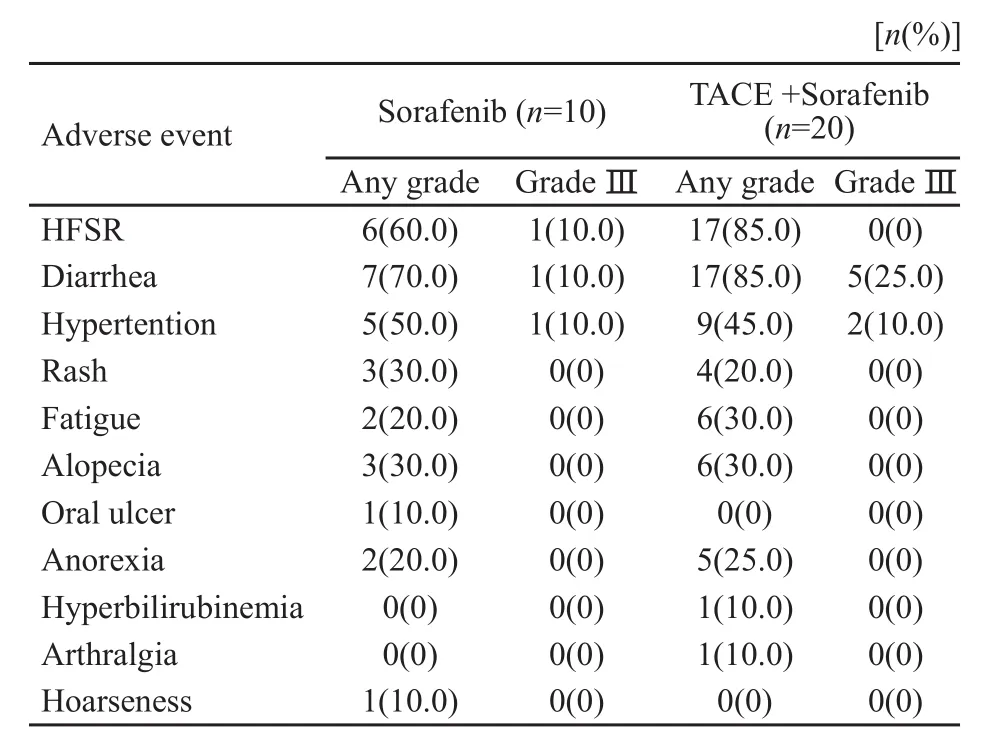
表 2 单用索拉非尼组与联合TACE组患者不良反应情况Tab.2 Adverse reactions of patients receiving sorafenib alone and sorafenib in combination with TACE
2.2 不良反应
患者用药1~2周开始出现不良反应,其中手足皮肤反应23例,腹泻24例,高血压14例,乏力24例,脱发9例,出现3度不良反应10例
患者中有1例声音嘶哑,该不良反应在SHARP和ORIENTAL中均未有报道,患者胸部CT未见纵隔淋巴结肿大,排除压迫喉返神经可能,喉镜未见声带异常,既往无咽炎病史,考虑可能与服用索拉非尼相关。1例关节痛,1例口腔黏膜溃疡,对症治疗后好转,30例患者均未因不良反应退出治疗。
3 讨 论
原发性肝癌是我国常见的恶性肿瘤之一,近年来发病率有增高趋势,预后差。分子靶向治疗为原发性肝癌的治疗提供了新的思路。索拉非尼是一种口服的多靶点的多激酶抑制剂,能通过抑制丝氨酸-苏氨酸激酶(c-RAF和突变型及野生型BRAF)、血管内皮生长因子受体-2、血小板衍生生长因子受体、FLT3、Ret和c-Kit受体酪氨酸激酶而起作用的,可阻断肿瘤细胞增殖和血管形成[4-8]。2007年在ASCO大会上公布的一项国际多中心的Ⅲ期临床研究SHARP研究结果显示,索拉非尼治疗组中位OS为10.7个月,中位TTP为5.5个月,安慰剂组的中位OS为7.9个月(HR=0.69,95%CI:0.55~0.87,P<0.001),索拉非尼显著提高了晚期肝细胞癌患者3个月的生存率,因治疗组的显著优势该研究在第二阶段被终止;另一项研究结果显示,索拉非尼治疗组中位OS为6.5个月,安慰剂组中位OS为4.2个月(HR=0.68,95%CI:0.50~0.93,P<0.014)。两项研究证实索拉非尼能有效地阻止病情恶化,显著延长晚期肝癌患者的生存时间,开创了肝癌靶向治疗的新时代[2-3]。
索拉非尼可以阻断肿瘤增殖和血管形成,从而抑制TACE后残存肿瘤生长及肿瘤侧支循环的形成,两者联合可取得较好的治疗效果[9]。在本临床观察中,在索拉非尼治疗基础上有20例患者加1~9次TACE治疗,这些患者的TTP和OS均有延长,但差异无统计学意义(P>0.05)。该观察中联合组较单药组TTP和OS均有延长,但差异无统计学意义(P<0.05),这可能因为样本量小,如增加样本量,延长随访时间,可能会出现阳性结果。
索拉非尼引起的不良反应主要表现在手、足部皮肤反应和腹泻,其次是高血压和脱发,对症治疗后好转。本研究中30例患者均未因不良反应而退出治疗,两组患者差异无统计学意义(P>0.05)。有1例患者出现声音嘶哑,该不良反应在SHARP和ORIENTAL中均未有报道,患者胸部CT未见纵隔淋巴结肿大,排除压迫喉返神经可能,喉镜未见声带异常,既往无咽炎病史,考虑可能与服用索拉非尼相关。患者手足皮肤反应发生率较高,考虑研究地点在北方,寒冷干燥的环境可能会导致患者皮肤干燥,手足皮肤反应发生率增加。
综上所述,索拉非尼在中国人群中治疗晚期原发性肝癌,疗效确切,其不良反应可耐受,且在单用和联合TACE治疗两组间差异无统计学意义(P>0.05)。本观察索拉非尼联合TACE治疗可延长患者TTP和OS,在后续扩大样本量的观察分析中可能会有进一步的结果。
[1]ALVESl R C, ALVES D, GUZ B, et al.Advanced hepatocellular carcinoma.Review of targeted molecular drugs[J].Ann Hepatol, 2011, 10(1): 21-27.
[2]LLOVET J M, RICCI S, MAZZAFERRO V, et al.Sharp investigators study group sorafenib in advanced hepatocellular carcinoma [J].N Engl J Med, 2008, 359(7): 378-390.
[3]CHENG A L, KANG Y K, Chen Z, et al.Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase Ⅲ randomized, double blind, placebo-controlled trial [J].Lancet Oncol, 2009,10(1): 25-34.
[4]SEBOLT-LEOPOLD J S, ENGLISH J M.Mechanisms of drug inhibition of signaling molecules [J].Nature, 2006,441(7092): 457-462.
[5]PANG R W, POON R T.From molecular biology to targeted therapies for hepatocellular carcinoma: the future is now[J].Oncology, 2007, 72(Suppl 1): 30-44.
[6]LLOVET J M, RICCI S, MAZZAFERRO V.Sorafenib in advanced hepatocellular carcinoma [J].N Engl J Med,2008, 359(4): 378-390.
[7]CHANG Y S, ADNANE J, TRAIL P A, et al.Sorafenib (Bay 43-9006) inhibits tumor growth and vascularization and induces tumor apoptosis and hypoxia in RCC xenograft models[J].Cancer Chem Pharm, 2007, 59(5): 561-574.
[8]ZHU A X.Development of sorafenib and other molecularly targeted agents in hepatocellular carcinoma [J].Cancer,2008, 112(2): 250-259.
[9]WANG B, XU H, GAO Z Q, et al.Increased expression of vascular endothelial growth factor in hepatocellular carcinoma after transcatheter arterial chemoembolization[J].Acta Radiol, 2008, 49(5): 523-529.

