丹参酮ⅡA诱导NB4细胞分化与PML-RARα融合蛋白的关系
郭庆寅 伍学强 刘玉峰
1.郑州大学第一附属医院儿科,河南 郑州450000;2.北京航天总医院血液肿瘤研究所,北京 100076
急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)以特异的染色体易位t(15;17)(q22;q21)为特征,形成PML-RARα融合基因,表达PML-RARα融合蛋白,引起RARα转录活化功能障碍,使粒细胞分化阻滞于早幼粒细胞阶段[1]。本研究采用NB4细胞株作为体外细胞模型,通过对丹参酮ⅡA(TanⅡA)与全反式维甲酸(all-tram retinoid,ATRA)及三氧化二砷(As2O3)诱导NB4细胞分化在细胞分化形态学、免疫表型和对PML-RARαmRNA和PML-RARα融合蛋白影响的比较,探索TanⅡA诱导APL细胞分化的分子机制。
1 材料和方法
1.1 细胞培养
将NB4细胞(上海交通大学医学院附属瑞金医院血液学研究所提供)加入含10%新生小牛血清、100 U/mL青霉素及100 U/mL链霉素的RPMI1640培养基中,置于37 ℃,CO2体积分数为5%的温箱中培养。取对数生长期的NB4细胞,分别加入浓度为1.70、2.55及3.40 μmol/L的TanⅡA(中国药品生物制品检定所化学标准品),同时加入浓度为0.1及1.0 μmol/L的As2O3(哈尔滨伊达药业有限公司)、1.0 μmol/L的ATRA(美国Sigma公司)和浓度为0.01%的DMS0。分别检测培养12、24、48、72、96、120、144和168 h时间点的多项指标。
1.2 细胞生长曲线的测定
各时间段NB4细胞用锥虫兰拒染法在光镜下计数细胞。
1.3 细胞分化形态学观察及分化抗原的检测
NB4细胞瑞氏染色后观察细胞形态;加入鼠抗人的PE标记的CD11b和FITC标记的CD33的抗体,用流式细胞仪检测细胞分化抗原(CD33、CD11b)表达。
1.4 细胞PML-RARαmRN A的检测
取4×106个NB4细胞,应用TRIzol(Life Techologies公司)按说明书抽提总RNA。氯仿相分离,异丙醇沉淀RNA。乙醇洗涤RNA 团块,干燥并溶解RNA。经紫外分光光度计测定RNA浓度。取2.5 μL RNA加入反应体系,RT-PCR扩增检测PML-RARα基因的 cDNA,按赛百盛技术公司(北京SBS Genetech有限公司)硅胶膜型PCR纯化试剂盒说明书纯化cDNA。引物和探针设计参照欧洲抗癌协作组制订的方案[2],cDNA加入20 μL的反应体系中(大连宝生物公司),在Lightcycler2.0型荧光定量PCR仪上进行实时荧光定量PCR(Roche公司)。
1.5 细胞 PML-RARα融合蛋白表达水平的检测
用Western blot检测PML-RARα融合蛋白。将NB4细胞,经预冷PBS洗涤,加入预冷细胞裂解液后,冰上温育20 min,离心(12 000 r/min×20 min,离心半径为10 cm)后-80 ℃冰箱冻存。蛋白提取物经定量后,取30 μg在的聚丙烯酰胺凝胶上电泳、转膜,3%BSA封闭,分别与抗PML抗体和辣根过氧化酶标记的二抗温育。最后经显色自显影,用凝胶图象处理系统分析灰度值和相对浓度值。
1.6 细胞内PML蛋白观察
方法[3],将NB4细胞离心涂片、固定,0.1%Triton 100破细胞膜、抗PML抗体(PG-M3)、FITC标记的二抗等处理后,观察PML荧光颗粒的数量、形态和大小并相对量化核小体恢复情况。
1.7 统计学处理
统计处理软件采用SPSS 13.0统计软件进行统计分析。计量资料以±s 表示,采用方差分析比较。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组对NB4细胞生长抑制
NB4细胞生长受抑程度随着TanⅡA浓度的增加而增强,低浓度与中高浓度的TanⅡA在48 h后生长抑制率差异有统计学意义(F=9.93,P=0.013 6)。同时TanⅡA对NB4细胞生长抑制作用呈时间依赖性。48 h后2.55 μmol/L TanⅡA组生长抑制率强于0.10 μmol/L As203组(F=6.30,P=0.036 4),与1.0 μmol/L As203组差异无统计学意义(F=4.02,P=0.079 9,表1)。
表1 不同浓度TanⅡ、AAs2O3及ATRA对NB4细胞生长抑制率影响的比较Tab.1 Effects of Tan ⅡA , ATRA and As2O3 with different concentration on the growth inhibition of NB4 cell lines(±s, %)
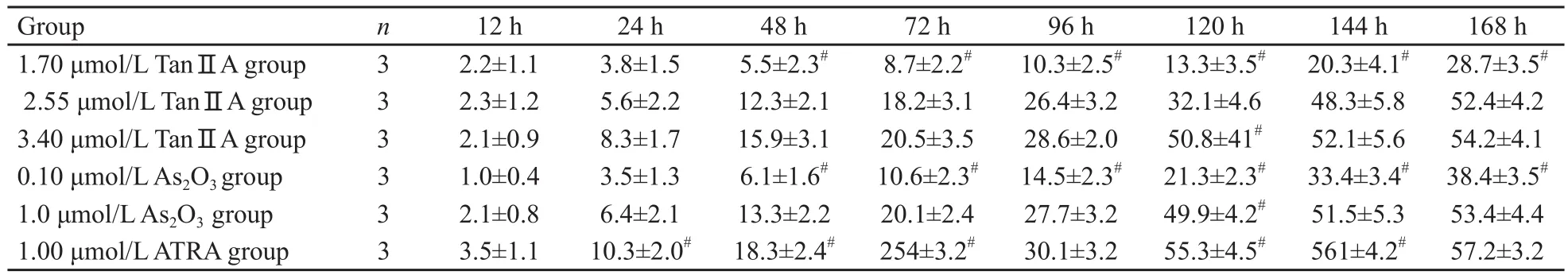
表1 不同浓度TanⅡ、AAs2O3及ATRA对NB4细胞生长抑制率影响的比较Tab.1 Effects of Tan ⅡA , ATRA and As2O3 with different concentration on the growth inhibition of NB4 cell lines(±s, %)
Compared with 2.55 μmol/L TanⅡA group ,#: P<0.05.
Group n 12 h 24 h 48 h 72 h 96 h 120 h 144 h 168 h 1.70 μmol/L TanⅡA group 3 2.2±1.1 3.8±1.5 5.5±2.3# 8.7±2.2# 10.3±2.5# 13.3±3.5# 20.3±4.1# 28.7±3.5#2.55 μmol/L TanⅡA group 3 2.3±1.2 5.6±2.2 12.3±2.1 18.2±3.1 26.4±3.2 32.1±4.6 48.3±5.8 52.4±4.2 3.40 μmol/L TanⅡA group 3 2.1±0.9 8.3±1.7 15.9±3.1 20.5±3.5 28.6±2.0 50.8±41# 52.1±5.6 54.2±4.1 0.10 μmol/L As2O3 group 3 1.0±0.4 3.5±1.3 6.1±1.6# 10.6±2.3# 14.5±2.3# 21.3±2.3# 33.4±3.4# 38.4±3.5#1.0 μmol/L As2O3 group 3 2.1±0.8 6.4±2.1 13.3±2.2 20.1±2.4 27.7±3.2 49.9±4.2# 51.5±5.3 53.4±4.4 1.00 μmol/L ATRA group 3 3.5±1.1 10.3±2.0# 18.3±2.4# 254±3.2# 30.1±3.2 55.3±4.5# 561±4.2# 57.2±3.2
2.2 各组诱导NB4细胞分化的形态学变化
随着时间的延长,TanⅡA对NB4细胞分化作用逐渐明显,96~168 h 1.70 μmol/L TanⅡA组与其他两组杆状分叶核表达率差异有统计学意义(F=8.47,P=0.002 6),2.55 μmol/L TanⅡA和3.40 μmol/L TanⅡA各时段差异无统计学意义(F=1.13,P=0.348 8)。48~168 h期间,2.55 μmol/L TanⅡA组诱导分化率强于两组As203组(F=4.86,P=0.049 1,表2)。
2.3 各组诱导NB4细胞分化抗原表达
随着时间的延长,TanⅡA诱导NB4细胞CDllb表达逐渐增加(表3),而CD33表达逐渐下降,1.70 μmol/L TanⅡA组作用差于2.55和3.40 μmol/L TanⅡA组(χ2);2.55和3.40 μmol/L TanⅡA组各时点分化抗原表达率差异无统计学意义(F=0.94,P=0.447 4) (表4)。
2.4 对NB4细胞PML-RARα mRNA的影响
实时荧光定量PCR检测融合基因PMLRARαmRNA,显示3组不同浓度TanⅡA样本各时间段Ct值和浓度比率差异无统计学意义(F=11.28,P=0.083 4,表5)。
2.5 对NB4细胞PML-RARα融合蛋白的影响
3种不同浓度TanⅡA处理NB4细胞12 h时,PML-RARα融合蛋白有减少迹象,可见PML条带的出现。3组PML的表达随浓度增加而增加。ATRA组和两种不同浓度的As2O3组,在24 h时间点检测中均可见PML-RARα融合蛋白减少,PML增加的迹象(表6)。
2.6 各组对NB4细胞PML的影响
TanⅡA处理24 h起,细胞核内颗粒均见不同程度的由量多细小细胞颗粒,逐渐变为颗粒粗大、颗粒数量较少的粗颗粒。至72 h核内颗粒呈大的点状或斑点状,颗粒数量在15~30个之间,与正常粒细胞对照组相似。在各时间段,3种不同浓度的TanⅡA和其他所有药物组PML荧光颗粒积分与0.01%DMSO组差异均有统计学意义(F=24.20,P= 0.038 9,图1)。
表2 TanⅡA与ATRA和As2O3诱导NB4细胞分化率的比较Tab.2 Effects of Tan ⅡA, ATRA and As2O3 on the morphologic changes of NB4 cell lines(±s, %)
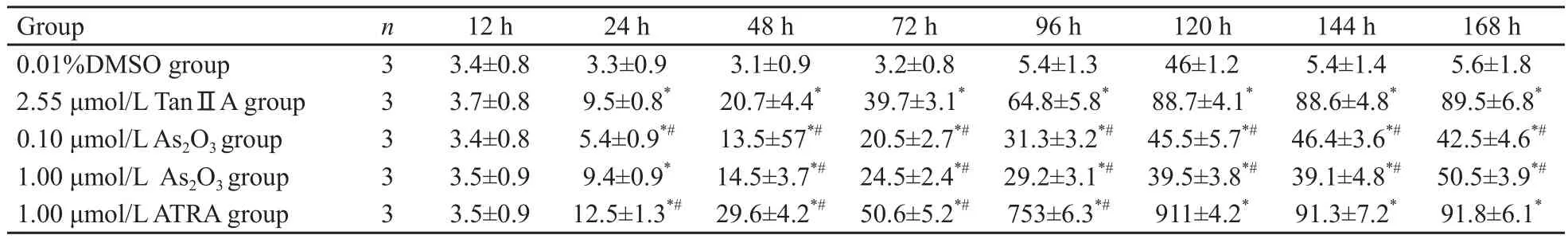
表2 TanⅡA与ATRA和As2O3诱导NB4细胞分化率的比较Tab.2 Effects of Tan ⅡA, ATRA and As2O3 on the morphologic changes of NB4 cell lines(±s, %)
Compared with 0.01% DMSO group, *: P<0.05; Compared with 2.55 μmol/L TanⅡA group, #: P<0.05.
Group n 12 h 24 h 48 h 72 h 96 h 120 h 144 h 168 h 0.01%DMSO group 3 3.4±0.8 3.3±0.9 3.1±0.9 3.2±0.8 5.4±1.3 46±1.2 5.4±1.4 5.6±1.8 2.55 μmol/L TanⅡA group 3 3.7±0.8 9.5±0.8* 20.7±4.4* 39.7±3.1* 64.8±5.8* 88.7±4.1* 88.6±4.8* 89.5±6.8*0.10 μmol/L As2O3 group 3 3.4±0.8 5.4±0.9*# 13.5±57*# 20.5±2.7*# 31.3±3.2*# 45.5±5.7*# 46.4±3.6*# 42.5±4.6*#1.00 μmol/L As2O3 group 3 3.5±0.9 9.4±0.9* 14.5±3.7*# 24.5±2.4*# 29.2±3.1*# 39.5±3.8*# 39.1±4.8*# 50.5±3.9*#1.00 μmol/L ATRA group 3 3.5±0.9 12.5±1.3*# 29.6±4.2*# 50.6±5.2*# 753±6.3*# 911±4.2* 91.3±7.2* 91.8±6.1*
表3 各组诱导NB4细胞分化抗原CD11b表达的比较Tab.3 Effects of Tan ⅡA, ATRA and As2O3 on the expression of CD11b of NB4 cell lines(±s, %)
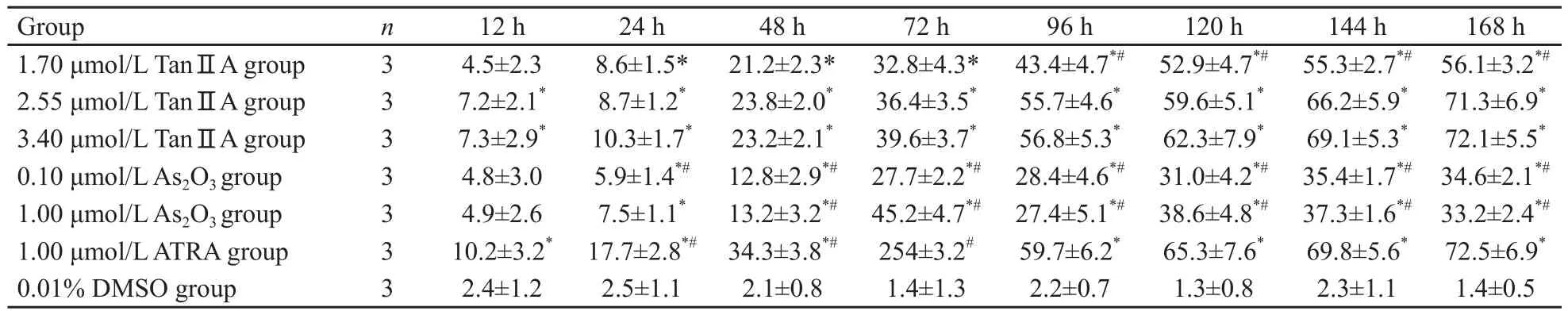
表3 各组诱导NB4细胞分化抗原CD11b表达的比较Tab.3 Effects of Tan ⅡA, ATRA and As2O3 on the expression of CD11b of NB4 cell lines(±s, %)
Compared with 0.01% DMSO group, *: P<0.05; Compared with 2.55 μmol/L TanⅡA group, #: P<0.05.
Group n 12 h 24 h 48 h 72 h 96 h 120 h 144 h 168 h 1.70 μmol/L TanⅡA group 3 4.5±2.3 8.6±1.5* 21.2±2.3* 32.8±4.3* 43.4±4.7*# 52.9±4.7*# 55.3±2.7*# 56.1±3.2*#2.55 μmol/L TanⅡA group 3 7.2±2.1* 8.7±1.2* 23.8±2.0* 36.4±3.5* 55.7±4.6* 59.6±5.1* 66.2±5.9* 71.3±6.9*3.40 μmol/L TanⅡA group 3 7.3±2.9* 10.3±1.7* 23.2±2.1* 39.6±3.7* 56.8±5.3* 62.3±7.9* 69.1±5.3* 72.1±5.5*0.10 μmol/L As2O3 group 3 4.8±3.0 5.9±1.4*# 12.8±2.9*# 27.7±2.2*# 28.4±4.6*# 31.0±4.2*# 35.4±1.7*# 34.6±2.1*#1.00 μmol/L As2O3 group 3 4.9±2.6 7.5±1.1* 13.2±3.2*# 45.2±4.7*# 27.4±5.1*# 38.6±4.8*# 37.3±1.6*# 33.2±2.4*#1.00 μmol/L ATRA group 3 10.2±3.2* 17.7±2.8*# 34.3±3.8*# 254±3.2# 59.7±6.2* 65.3±7.6* 69.8±5.6* 72.5±6.9*0.01% DMSO group 3 2.4±1.2 2.5±1.1 2.1±0.8 1.4±1.3 2.2±0.7 1.3±0.8 2.3±1.1 1.4±0.5
表4 各组诱导NB4细胞分化抗原CD33表达的比较Tab.4 Effects of Tan ⅡA, ATRA and As2O3 on the expression of CD33 of NB4 cell lines(±s, %)
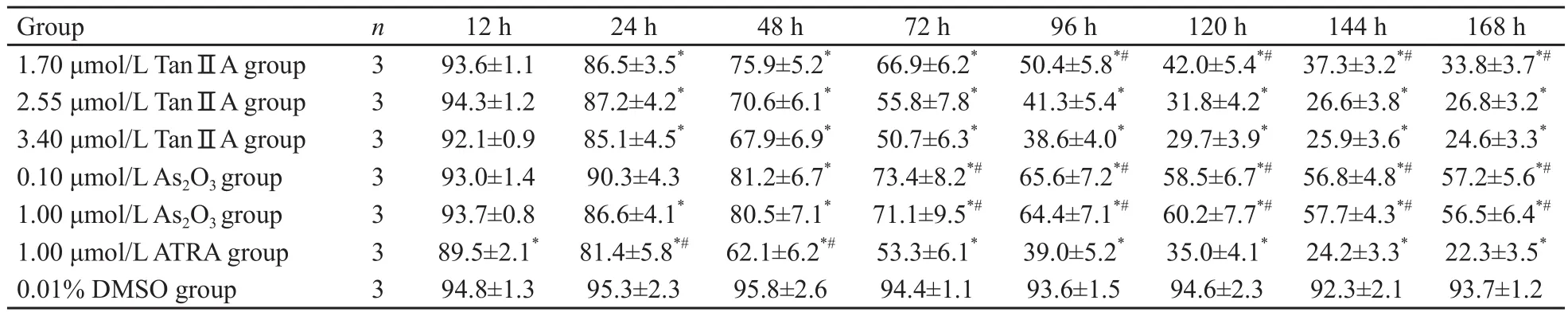
表4 各组诱导NB4细胞分化抗原CD33表达的比较Tab.4 Effects of Tan ⅡA, ATRA and As2O3 on the expression of CD33 of NB4 cell lines(±s, %)
Compared with 0.01% DMSO group, *: P<0.05; Compared wiht 2.55μmol/L TanⅡA group , #: P<0.05.
Group n 12 h 24 h 48 h 72 h 96 h 120 h 144 h 168 h 1.70 μmol/L TanⅡA group 3 93.6±1.1 86.5±3.5* 75.9±5.2* 66.9±6.2* 50.4±5.8*# 42.0±5.4*# 37.3±3.2*# 33.8±3.7*#2.55 μmol/L TanⅡA group 3 94.3±1.2 87.2±4.2* 70.6±6.1* 55.8±7.8* 41.3±5.4* 31.8±4.2* 26.6±3.8* 26.8±3.2*3.40 μmol/L TanⅡA group 3 92.1±0.9 85.1±4.5* 67.9±6.9* 50.7±6.3* 38.6±4.0* 29.7±3.9* 25.9±3.6* 24.6±3.3*0.10 μmol/L As2O3 group 3 93.0±1.4 90.3±4.3 81.2±6.7* 73.4±8.2*# 65.6±7.2*# 58.5±6.7*# 56.8±4.8*# 57.2±5.6*#1.00 μmol/L As2O3 group 3 93.7±0.8 86.6±4.1* 80.5±7.1* 71.1±9.5*# 64.4±7.1*# 60.2±7.7*# 57.7±4.3*# 56.5±6.4*#1.00 μmol/L ATRA group 3 89.5±2.1* 81.4±5.8*# 62.1±6.2*# 53.3±6.1* 39.0±5.2* 35.0±4.1* 24.2±3.3* 22.3±3.5*0.01% DMSO group 3 94.8±1.3 95.3±2.3 95.8±2.6 94.4±1.1 93.6±1.5 94.6±2.3 92.3±2.1 93.7±1.2
3 讨 论
近年来,传统中草药 治疗恶性肿瘤得到了越来越多学者的认可,现已证明中草药在肿瘤的综合治疗中起重要作用[4]。丹参酮ⅡA是从活血化瘀中药丹参中提取的有效成份,分子式为C19H1803,其结构中含有醌型结构,易被氧化还原,有多种生物学活性,可参与机体的多种生化反应,已在心血管、神经系统疾病领域得到广泛应用,近年来发现其对白血病等肿瘤疾病具有抗肿瘤作用[5]。APL是急性髓细胞白血病的一种特殊类型,是最有希望治愈的急性白血病。APL具有特征性染色体异常t(15;17)(q22;q2l),导致形成PML-RARα融合基因。PML-RARα融合基因转录、翻译PML-RARα融合蛋白,PML-RARα融合蛋白通常与RXR或RARα形成多聚复合体,该复合体与RARα竞争RARE和RXR,抑制RARα的转录活性,阻断粒细胞的分化成熟,导致APL发生。同时PML蛋白从核小体(NBs)中释放出来,与PMLRARα融合蛋白形成二聚体,使NBs中PML蛋白减少,NBs的结构和功能破坏,免疫荧光染色表现为由大斑点型变为细小颗粒型。NBs为细胞核内一种多蛋白复合体,PML蛋白形成其外壳,在维持NBs正常结构中起核心作用[6],PML发挥抑制生长和促进凋亡作用。PML蛋白和NBs相关蛋白的异位在APL发病中发挥重要作用。因此,恢复PML正常定位和正常NBs结构是APL新的治疗策略。NB4细胞株来自一例第2次复发的APL女性患者,1991年建株。NB4细胞具有特征性的t( 15; 17)染色体移位,表达PML-RARα融合蛋白。在体外和动物模型中对诱导分化剂ATRA敏感,是研究APL分化作用机制的理想模型[7]。
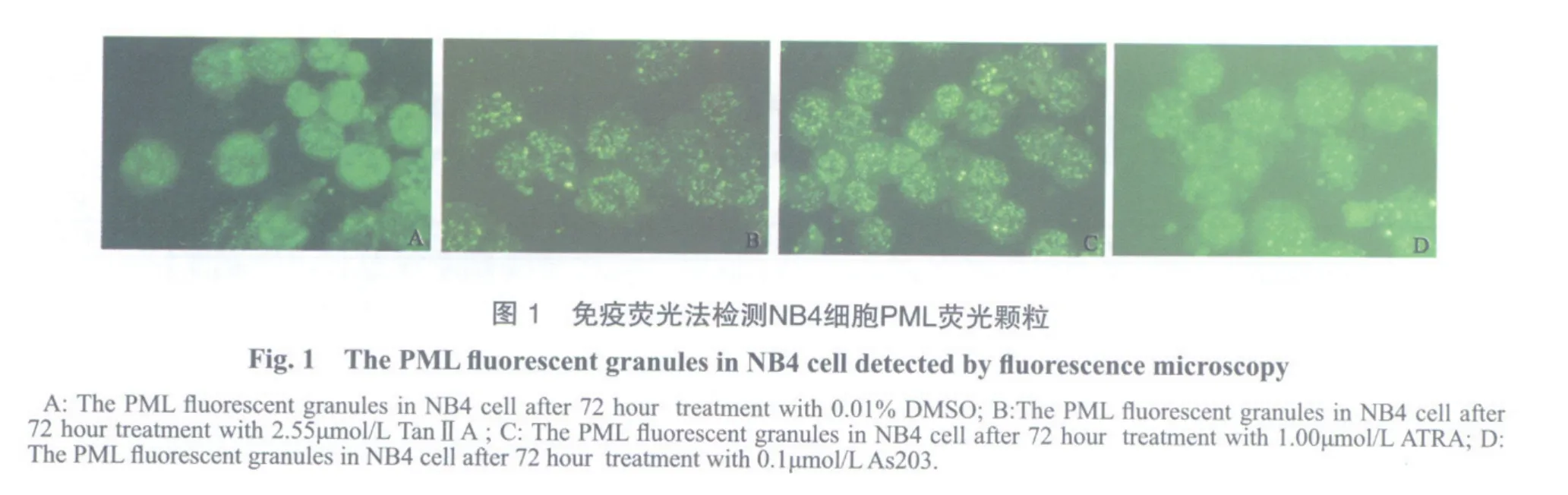
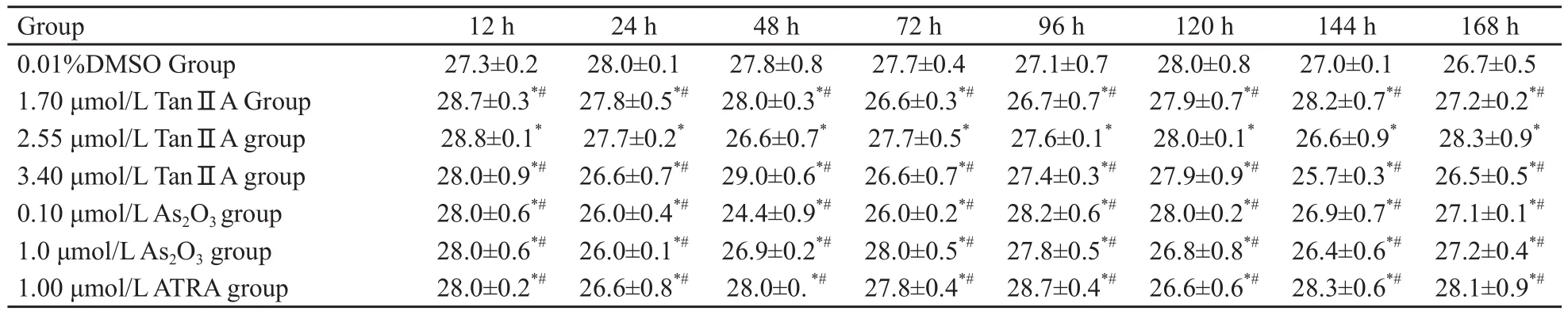
表5 QT-PCR各组样本CT值比较Tab.5 Effects of Tan ⅡA , ATRA and As203 on the Ct values of expressions of PML-RARα mRNA of NB4 cell lines(x±s, %)
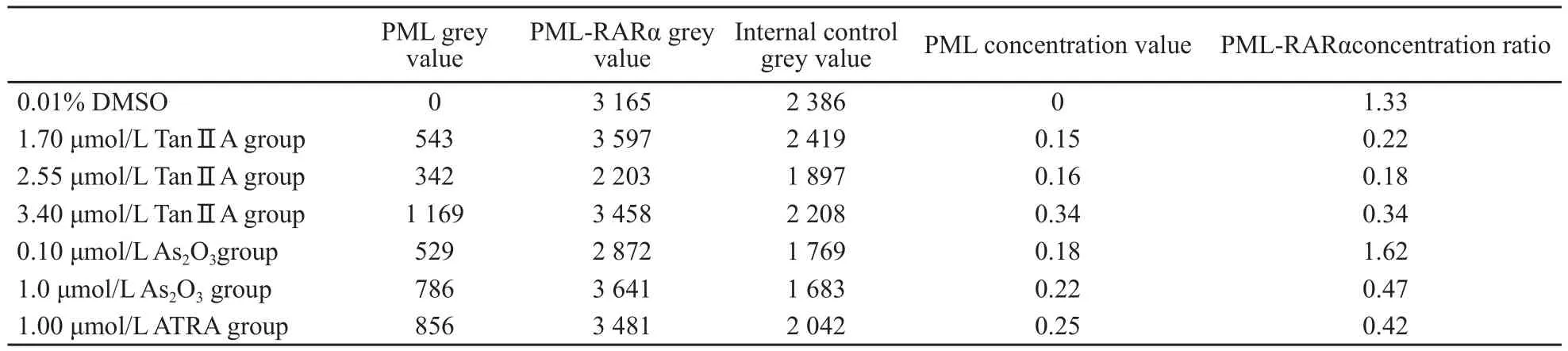
表6 各组24 h PML-RARα融合蛋白融合蛋白表达的比较Tab.6 Effects of Tan ⅡA, ATRA and As2O3 on the PML/RARα fusion protein expression of NB4 cell lines for 24 h
在本实验中,我们发现TanⅡA能明显抑制NB4细胞生长。从形态学观察,TanⅡA能促进NB4细胞分化。同时发现,NB4细胞在TanⅡA的作用下,在粒细胞早期表达的CD33表达逐渐减少,而在成熟粒细胞高表达的CDllb表达逐渐增多,从免疫表型上再一次证实了TanⅡA诱导NB4细胞分化的能力[8]。许多研究证实TanⅡA能诱导急性早幼粒细胞性白血病分化[5,9-10],但其作用机制并不明确。
我们的研究证实,TanⅡA能恢复PML在NB4细胞核体定位。抗PML荧光单抗可很好地显示PML在NB4细胞中的定位,TanⅡA作用前为散布于细胞内小斑点形的细颗粒,3种不同浓度的TanⅡA作用后12 h即可见粗颗粒状PML小体,以后逐渐增加,到72 h NBs结构与数量即与正常的粒细胞无异。TanⅡA恢复核体结构的能力与其浓度有关,1.70 μmol/L TanⅡA的作用弱于其他两剂量组,2.55和3.40 μmol/L TanⅡA组作用相似,显示2.55 μmol/L为最适作用浓度。
通过实时定量PCR对不同浓度的TanⅡA处理后的NB4细胞进行动态观察发现,12~168 h NB4细胞PML-RARα融合基因表达mRNA差异无统计学意义,证实TanⅡA对PML-RARα融合基因的表达无直接作用,不能影响PML-RA Rα融合蛋白的表达。
在实 验中我们发现,TanⅡA处理NB4细胞1 2 h时,可见PML-RARα条带灰度值下降,PML条带显现,表明TanⅡA能降解PMLRARα,使PML-RARα与复合物解离,解救RARα和PML,恢复PML功能,促进RARα的靶基因的激活,使细胞分化得以恢复。经过比较可见,TanⅡA降解PML-RARα作用有剂量依赖性,3种不同浓度TanⅡA组PML的条带灰度值不同,2.55 μmol/L 和3.40 μmol/L TanⅡA组灰度值较高。
从以上实验,我们可见TanⅡA具有诱导分化APL细胞的作用,我们也证实了TanⅡA是通过降解PML-RARα融合基因表达的蛋白而产生诱导分化作用的。那么TanⅡA是通过什么途径降解PML-RARα融合蛋白的呢,我们可以从ATRA诱导分化和降解PML-RARα融合蛋白中得到某些启示。ATRA是通过两种途径降解PML-RARα融合蛋白,即半胱天冬酶(caspases)途径与泛素(ubiquitin)途径。ATRA诱导Caspase-3样活性,降解PML-RARα,切割位点位于螺旋盘状结构的羧基端。前期的研究证实TanⅡA能激活caspase3[11],由此我们可以推论:TanⅡA诱导APL分化是通过激活caspases降解PML-RARα融合蛋白,恢复NBs功能,解除PML-RARα对RAR a靶基因转录抑制而实现的。TanⅡA诱导APL凋亡是否存在泛素途径作用,是否存在其他途径,有待进一步探讨。同时,我们也发现TanⅡA产生诱导分化作用的时间较ATRA长,这可能与ATRA作用的位点不同,也可能激活的信号传导途径不同,也可能导致基因表达调控网络的变化不同,这有待我们进一步探讨研究。
[参 考 文 献]
[1] KASTNER P, LAWRENCE H J, WALTZINGER C, et al.Positive and negative regulation of granulopoiesis by endogenous RARalpha[J].Blood, 2001, 97(5): 1314-1320.
[2] GABERT J, BEILLARD E, VAN DER VELDEN V H, et al.Standardization and quality control studies of 'real-time'quantitative reverse transcriptase polymerase chain reaction of fusion gene transcripts for residual disease detection in leukemia-a Europe Against Cancer program[J].Leukemia,2003, 17(12): 2318-2357.
[3] VILLAMOR N, COSTA D, AYMERICH M, et al.Rapid diagnosis of acute promyelocytic leukemia by analyzing the immunocytochemical pattern of the PML protein with the monoclonal antibody PG-M3[J].Am J Clin Pathol, 2000,114(5): 786-792.
[4] TREASURE J.Herbal medicine and cancer: an introductory overview[J].Semin Oncol Nurs, 2005, 21(3): 177-183.
[5] LIU J J, ZHANG Y, LIN D J, et al.Tanshinone ⅡA inhibits leukemia THP-1 cell growth by induction of apoptosis[J].Oncol Rep, 2009, 21(4): 1075-1081.
[6] ZHU J, ZHOU J, PERES L, et al.A sumoylation site in PML/RARα is essential for leukemic transformation[J].Cancer Cell, 2005, 7(2): 143-153.
[7] LANOTTE M, MARTIN-THOUVENIN V, NAJMAN S, et al.NB4, a maturation inducible cell line with t(15;17) marker isolated from a human acute promyelocytic leukemia (M3)[J].Blood, 1991, 77(5): 1080-1086.
[8] TAN S M, HYLAND R H, Al-SHAMKHANI A, et al.Effect of integrin beta 2 subunit truncations on LFA-1 (CD11a/CD18)and Mac-1 (CD11b/CD18) assembly, surface expression, and function[J].J Immunol, 2000, 165(5): 2574-2581.
[9] YANG L, GONG Y P, YANG Y M, et al.A successful case of tanshinone Ⅱ A treatment for relapsed acute promyelocytic leukemia after maintainance therapy of all-trans retinoic acid and arsenic trioxide[J].Sichuan Da Xue Xue Bao Yi Xue Ban, 2010, 41(6): 1065-1067.
[10] ZHANG K, LI J, MENG W, et al.C/EBPbeta and CHOP participate in tanshinone ⅡA-induced differentiation and apoptosis of acute promyelocytic leukemia cells in vitro[J].Int J Hematol, 2010, 92(4): 571-578.
[11] 羊裔明, 粱效功, 邓承祺, 等.丹参酮ⅡA诱导NB4细胞凋亡时Caspase3的活性变化[J].四川大学学报, 2003, 34(3):549-551.

