新生幼鼠缺血缺氧性脑损伤模型的实验研究①
陈刚,王伟哲,陈明钊,刘伟,高峰,支宏,钱心炜,赵丽辉
·基础研究·
新生幼鼠缺血缺氧性脑损伤模型的实验研究①
陈刚1,王伟哲2,陈明钊1,刘伟3a,高峰3a,支宏1,钱心炜1,赵丽辉3b
目的探讨缺血缺氧脑损伤的新生鼠功能及形态学改变情况。方法出生7 d的健康W istar幼鼠25只,分为对照组(n= 12)和模型组(n=13)。模型组结扎一侧颈总动脉,置8%氧气、92%氮气缺氧箱内2 h,对照组切开幼鼠颈部皮肤后缝合,不置于缺氧环境。出生4周时进行行为学、水迷宫及病理学检测。结果模型组后足重复间距长于对照组(P<0.05),平衡木通过时间明显长于对照组(P<0.01);水迷宫实验逃避潜伏期明显长于对照组(P<0.01)。大体观察发现,模型组损伤侧脑组织体积变小、萎缩。HE染色发现,损伤侧脑室周围细胞肿胀,细胞数量较对侧少;损伤侧大脑皮层神经细胞明显减少,神经细胞变性坏死,胶质细胞反应性增生。结论应用一侧颈总动脉结合缺氧的方法可复制新生乳鼠缺血缺氧模型。
缺血缺氧脑损伤;动物模型;行为学;水迷宫实验;病理;大鼠
[本文著录格式]陈刚,王伟哲,陈明钊,等.新生幼鼠缺血缺氧性脑损伤模型的实验研究[J].中国康复理论与实践,2012,18 (7):612-614.
小儿脑瘫是指出生前及出生后1个月内因各种原因所致的非进行性脑损伤,主要表现为中枢性运动障碍及姿势异常,同时常伴有智力发育迟缓、学习困难、行为和情感异常等障碍[1-4]。国内外报道小儿脑瘫并发智力障碍的发病率为60%~75%[5-7]。本实验应用一侧颈总动脉结合缺氧的方法制作新生乳鼠缺血缺氧脑损伤动物模型,观察其行为学、学习记忆功能及脑组织病理变化,探讨新生乳鼠缺血模型的评价方法。
1 材料与方法
1.1 实验动物及仪器 出生7 d的健康W istar幼鼠25只,体重13~15 g,清洁级,雌雄不限,购自新疆地方病研究所动物中心,许可证号:SCXK(新) 2003-0002。饲养条件为室温(23±2)℃,光照控制12 h (7:00 a.m.~7:00 p.m.),自由饮食水。实验动物缺氧箱:上海儿科医学研究所;OX/11型测氧仪:上海昶艾电子科技有限公司;手术显微镜:镇江中天光学仪器有限责任公司;显微神经外科手术器械、恒温水浴箱。
本实验研究符合动物保护委员会要求,实验中尽可能减少使用动物的数量和减轻动物的痛苦。
1.2 脑损伤模型的制作及试验分组 将以上动物随机分为对照组(n=12)和模型组(n=13)。模型组生后7 d异氟醚麻醉,消毒,手术显微镜下行颈正中纵切口,仔细分离一侧颈总动脉后以6-0丝线双重结扎颈总动脉并离断,缝合皮肤切口。术后恢复2 h后放置于37℃恒温,8%氧气+92%氮气缺氧箱中2 h。对照组麻醉后仅行颈正中切口,然后缝合切口。完全复苏后放回母鼠身边自由饮食水。手术、幼鼠缺氧及复苏过程中保持局部环境温度35℃~37℃。
1.3 脑损伤模型的评价
1.3.1 神经行为学评价 根据Catter等[8]的方法,于出生后4周,分别进行平衡木试验、足印重复间距试验,观察平衡木通过时间和后足重复间距,每只观察3次。
1.3.2 M orris水迷宫 于出生后4周进行。记录实验鼠从入水至爬上隐匿性逃逸平台的时间,即逃逸潜伏期(s)。实验过程中保持实验室的光线、环境布局不变及周围环境安静。
1.3.3 病理检查 完成行为学检测后,实验鼠腹腔麻醉,活体心脏灌注,取脑组织固定,大体观察;石蜡包埋、切片,行HE染色。
1.4 统计学分析 采用SPSS 11.5软件进行统计分析。采用正态检验和t检验,显著性水平α=0.05。
2 结果
2.1 神经行为学观察结果 足印重复间距试验显示,模型组右侧前后肢足印重复性差,重复间距大于对照组(P<0.05)。平衡木试验显示,模型组动物在通过平衡木横杆时,神态迟疑不定,探索行为较多;双侧后肢关节活动僵硬,右侧更明显;协调能力差。通过平衡木时间明显长于对照组(P<0.01)。见表1。
2.2 Morris水迷宫实验 第1次训练时,各组大鼠先绕池壁快速游动,航行没有方向性、目标性。对照组经过几次尝试后,开始以对角线在水池中航行,第1天后以缩小圆圈的方式搜索平台,并很快找到平台,运动轨迹多呈直线。模型组环绕池壁航行16~28次而几乎没有在水池中寻找平台的倾向,游动方式以边缘式和随机式为主。各组逃避潜伏期随训练次数的增多而逐渐缩短。对照组隐匿平台逃避潜伏期明显短于模型组(P<0.01)。见表2。
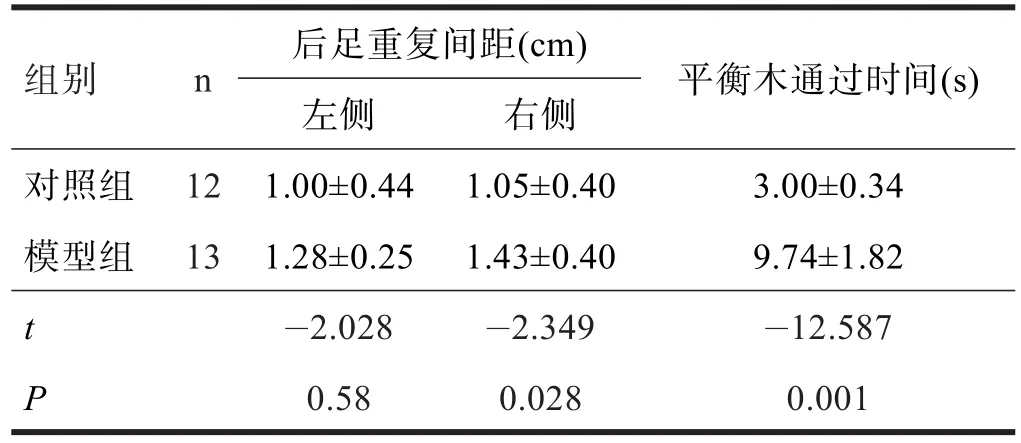
表1 两组后足重复间距和平衡木通过时间比较
2.3 形态学表现 大体观察:对照组脑组织双侧对称,饱满(图1A);模型组损伤一侧脑组织萎缩,体积变小(图1B)。HE染色:对照组脑室旁细胞形态正常,排列规则(图1C);模型组一侧脑室旁正常组织结构破坏,可见散在的不规则囊腔,周围细胞肿胀、变性、排列紊乱,并可见大小不等圆形软化灶,细胞数量较对侧少,神经细胞明显减少,神经细胞变性坏死,胶质细胞反应性增生(图1D)。
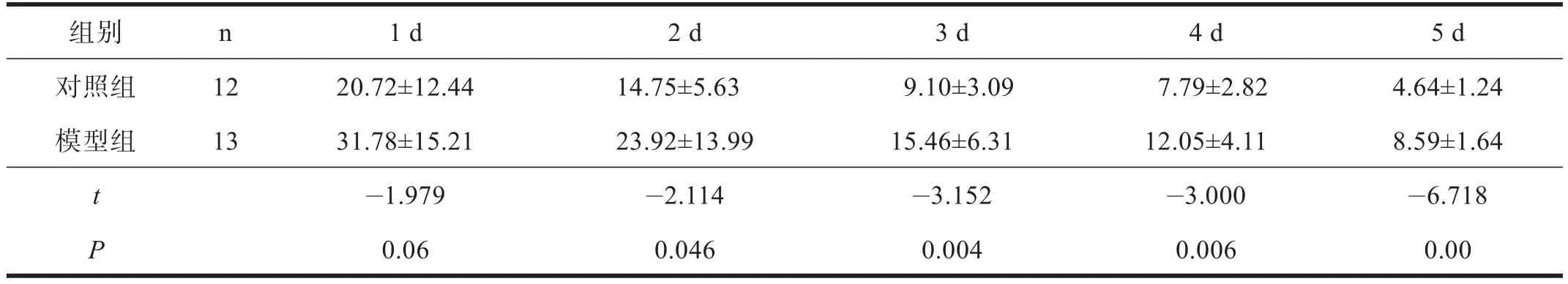
表2 出生后4周M orris水迷宫测试小鼠逃避潜伏期(s)
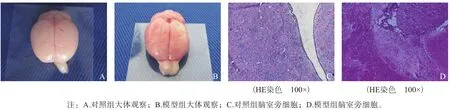
图1 实验动物出生4周时脑室旁组织大体观察和病理观察
3 讨论
动物模型的制备是研究疾病发生发展及探索其防治方法最基本最重要的步骤。目前脑瘫动物模型评价的研究主要以行为学和形态学为主,缺乏认知功能方面的评价。
智力损伤是脑瘫的主要并发症之一,在注意力、记忆力及空间思维方面的损伤尤为显著[9]。我们在前期研究[10]的基础上,评价新生幼鼠缺血缺氧动物模型的认知功能情况。
神经行为学检验显示:与对照组比较,模型组后肢足印步态重复性差,表现为后足重复间距增大,且间距不稳定;平衡木通过时间延长,存在运动障碍。
M orris水迷宫实验是一种评价空间学习记忆能力的经典方法,被广泛应用于认知功能的检测[11-15]。本实验显示,随着训练次数的增加,模型组与对照组比较,逃避潜伏期明显延长。提示实验鼠学习记忆功能下降,空间记忆能力明显受损。
人类新生儿及围产期脑损伤后特征性的病理表现为脑室周围白质弥漫性或局灶性软化灶,残留大片完整的灰质[16-19]。本组病理观察符合脑室周围白质局灶性软化,与人类新生儿围产期脑损伤形态学改变相似。
综上所述,本实验应用单侧颈总动脉结扎并离断,合并环境缺氧的方法制作幼鼠脑损伤模型,行为学、认知功能及组织病理方面符合新生儿缺血缺氧性脑病的特征,为研究提供了理想的动物模型。
[1]中国康复医学会儿童康复专业委员会,中国残疾人康复协会小儿脑瘫康复专业委员会.小儿脑性瘫痪的定义、分型和诊断条件[J].中华物理医学与康复杂志,2007,29(5):309.
[2]Sundrum R,Logan S,Wallace A,et al.Cerebral palsy and socioeconom ic status:a retrospective cohort study[J].A rch Dis Child,2005,90:15-18.
[3]K rigger KW.Cerebral palsy:an overview[J].Am Fam Physician,2006,73:91-100.
[4]Jones MW,Morgan E,Shelton JE,et al.Cerebral palsy:introduction and diagnosis[J].J Pediatr Health Care,2007,21: 46-52.
[5]Back SA,Riddle A,M cClure MM.Maturation dependent vulnerability of perinatal white matter in premature birth[J]. Stroke,2007,38:724-730.
[6]Murata Y,Itakura A,Matsuzawa K,et al.Possible antenatal and perinatal related factors in development of cystic periventricular leukomalacia[J].Brain Dev,2005,27(1):17-21.
[7]许小艳,梁琨.早产儿脑室周围白质软化的防治进展[J].医学综述,2009,15(9):1337-1339.
[8]Carter RJ,M orton J,Dunnett SB.Motor coordination and balance in rodents[J].Curr Protoc Neurosci,2001,Chapter 8: Unit8.12.
[9]李林.小儿脑性瘫痪并发智力障碍的研究现状[J].中国康复理论与实践,2010,16(3):230-232.
[10]Chen G,Hu YR,Liu W,et al.An animalmodel of cerebral palsy induced by prenatal exposure to lipopolysaccharide and hypoxia[J].Neural Regen Res,2010,5(14):1100-1103.
[11]Vorhees CV,Williams MT.Morriswatermaze:procedures for assessing spatial and related forms of learning and memory[J]. Nature Protocols,2006,1(2):848-858.
[12]Iivonen H,Nurm inen L,HarriM,et al.Hypotherm ia in m ice tested in Morris water maze[J].Behav Brain Res,2003,141: 207-213.
[13]Kallai J,M akany T,Karadi K,et al.Spatial orientation strategies in Morris-type virtual water task for humans[J].Behav Brain Res,2005,159(2):187-196.
[14]Porte Y,Buhot MC,Mons NE.Spatialmemory in The Morrisswatermaze and activation of cyclic AMP response element binding(CREB)protein w ithin the mouse hippocampus[J]. Learn M em,2008,15(2):885-894.
[15]薛丹,徐淑萍,刘进修.水迷宫实验中三种品系小鼠学习记忆能力的比较[J].中国实验动物学报,2010,18(2):149-152.
[16]Uehara H,Yoshioka H,Kawase S,et al.A new model of whitematter injury in neonatal ratsw ith bilateral carotid artery occlusion[J].Brain Res,1999,837(1-2):213-220.
[17]Roohey T,Raju TN,Moustogiannis AN.Animal models for the study of perinatal hypoxic-ischem ic encephalopathy:a criticalanalysis[J].Early Hum Dev,1997,47:115-146.
[18]张莉莉,蔡玲玲,张伟,等.脑缺血缺氧性脑病动物模型实验治疗的病理观察[J].中华病理学杂志,1996,25:102-104.
[19]Riddle A,Luo NL,Manese M,et al.Spatial heterogeneity in oligodendrocyte lineage maturation and not cerebral blood flow predicts fetal ovine periventricularwhitematter injury[J]. JNeurosci,2006,26:3045-3055.
Newborn Hypoxic-ischem ic Brain Dam age M odeling in Rats
CHEN Gang,WANG Wei-zhe,CHEN M ing-zhao,et al.Department of Neurosurgery,the Fourth Affiliated HospitalofSoochow University,Wuxi214026,Jiangsu,China
Ob jectiveTomodel the newborn hypoxic-ischem ic brain damage in rats.M ethods25 7-day-old healthy W istar ratswere divided into control group(n=12)and model group(n=13).2 h after ligating andmutilating the unilateral common carotid arteries,the rats in themodel group were put into an airtighted box w ith the volume fraction of 8%oxygen and 92%nitrogen for 2 h.4 weeks after operation, all the rats were assessed behaviorally and pathologically.Resu ltsThe footprint repeat space of rats were larger and more instable in the model group than in the control group(P<0.05).The time the rats crossing the balance beam w as longer in themodel group than in the control group(P<0.05).The escape latency of the watermaze testwas longer in themodel group than in the control group(P<0.05).The right brain became smaller than the contralateral.HE staining showed that the cells around impaired periventricle were swelling,and cell number was less than the contralateral.The neurons decreased,some degenerated and necrosisneurocytesappeared in the impaired side.ConclusionThemodelof hypoxic-ischem ic brain damage hasbeen established.
hypoxic-ischem ic brain damage;animalmodel;neuroethology;w atermaze test;pathology;rats
R742
A
1006-9771(2012)07-0612-03
2012-02-27
2012-05-28)
1.国家自然科学基金资助项目(No.30960393);2.新疆维吾尔自治区“十一五”科技攻关和重点科技项目(No.200633128(2))。
1.无锡市第四人民医院,苏州大学附属第四人民医院神经外科,江苏无锡市214062;2.新疆维吾尔自治区昌吉市人民医院神经外科,新疆昌吉市831100;3.新疆维吾尔自治区人民医院,a:神经外科;b:病理科,新疆乌鲁木齐市830001。作者简介:陈刚(1970-),男,重庆市人,博士,副主任医师,主要研究方向:中枢神经系统损伤修复。
10.3969/j.issn.1006-9771.2012.07.005

