人脐带源神经干细胞的培养和分化①
周剑云,孙炜,张新,王建军,陈慧,张庆俊
人脐带源神经干细胞的培养和分化①
周剑云1,2,孙炜1,2,张新1,2,王建军1,2,陈慧1,3,张庆俊4
目的研究诱导人脐带间充质干细胞(hucMSC)分化为神经干细胞样细胞(hucNSC)的方法。方法体外培养hucMSC,流式细胞仪鉴定细胞表型的表达。用碱性成纤维细胞生长因子、表皮生长因子添加B27诱导,流式细胞学、免疫细胞化学鉴定。用胶质源性神经营养因子(GDNF)、白介素-1β(IL-1β)和全反式维甲酸(ATRA)等诱导分化,免疫组化染色、RT-PCR鉴定。结果hucMSC表达CD105、CD44、CD29。诱导后聚集成细胞球悬浮生长,并不断增殖,流式细胞仪鉴定失去hucMSC的表面标志物特征,而表达Nestin、CD133。再经RA、GDNF、IL-1β诱导,细胞表达胶质纤维酸性蛋白、神经元特异性烯醇化酶和酪氨酸羟化酶。结论hucMSC能分化为具有神经干细胞样生长、增殖、分化特征的细胞。
人脐带间充质干细胞;神经干细胞;多巴胺能神经元;分化
[本文著录格式]周剑云,孙炜,张新,等.人脐带源神经干细胞的培养和分化[J].中国康复理论与实践,2012,18(7):615-618.
1 材料和方法
1.1 主要试剂 B27添加剂(B27 supplement)、RT-PCR试剂:INVITROGEN公司;重组人bFGF、重组人EGF、重组人白介素-1β(Interleukin-1β,IL-1β)、重组人胶质源性神经营养因子(glial-derived neurotrophic fator,GDNF):PEPROTECH公司;全反式维甲酸(all-trans retinoic acid,ATRA)、DAPI:SIGMA公司;CD44(PE)、CD29(APC)单克隆抗体:BD PHARM INGEN公司;CD105(FITC)单克隆抗体:ANCELL公司;小鼠抗人神经元特异性烯醇化酶(neuron specific enolase,NSE)单克隆抗体:THERMO公司;兔抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)多克隆抗体、兔抗酪氨酸羟化酶多克隆抗体(tyrosine hydroxylase,TH)、兔抗巢蛋白(Nestin)多克隆抗体、兔抗CD133多克隆:北京博奥森生物技术技术有限公司。
1.2 hucMSC的培养 脐带取自北京大学人民医院足月新生儿剖宫产脐带,均经新生儿父母授权同意。方法见前期研究[4]。
1.3 向神经干细胞样细胞诱导(预诱导) 取第3、4代生长状态良好的hucMSC,0.25%胰蛋白酶消化,10%FBS中和后离心,配制预诱导液。用该培养基重悬细胞,按1×105/m l接种于预先放置有多聚赖氨酸包被的消毒盖玻片的24孔板中培养。
诱导方案分为3组:1组:DMEM/F12+bFGF+ EGF+B27;2组:DMEM/F12+bFGF+EGF;3组:DMEM/F12+bFGF+EGF+B27+1%FBS。药物剂量:bFGF 20 ng/m l,EGF 20 ng/m l,B27为2%。在形成悬浮生长的细胞球后终止诱导。倒置显微镜(日本Olympus)每8小时观察细胞形态变化。
1.3.1 流式细胞仪检测 分别取第3代hucMSCs和hucNSCs,去掉培养液,用PBS洗2遍,0.25%胰蛋白酶消化,PBS洗涤后制成浓度为3.0×106/m l单细胞悬液。分别加入抗人的CD44(PE)、CD29(APC)、CD105(FITC)单抗各5μl,4℃孵育30 m in,流式细胞仪检测。
1.3.2 免疫荧光染色 1组、2组部分在形成悬浮生长的细胞球后终止诱导,免疫组织化学染色检测Nestin、CD133、NSE、GFAP、TH表达,并检测第1、3、5天时Nestin、CD133表达变化。
吸取细胞悬液100μl,滴加在多聚赖氨酸处理过的防脱载玻片上,超净台内风干,4%多聚甲醛固定15m in,0.3%TritonX-100通透15m in,3%H2O2溶液封闭10m in,山羊血清室温孵育10m in,加一抗4℃过夜;加Rhodam ine或fluorescein标记的羊抗兔、羊抗小鼠IgG(1∶100)二抗工作液37℃孵育30 m in,DAPI复染。抗荧光衰减封片剂封片。相应的荧光染料染色,免疫荧光显微镜下识别细胞。以不加入一抗处理的作为阴性对照染色。每步间经0.01mol/L PBS (pH 7.2~7.4)浸洗3次,每次5m in。一抗分别为NSE(1∶1000)、CD133(1∶400)、Nestin(1∶400)、GFAP(1∶400)、TH(1∶400)。
1.4 向神经细胞诱导 预诱导1组有悬浮生长的细胞球形成后,继续培养14 d,去掉诱导液,将细胞球接种于预先放置有多聚赖氨酸包被的消毒盖玻片的24孔板中培养。根据在DMEM/F12培养液中加用诱导剂的不同分4组:1组:10%FBS;2组:ATRA;3组:GDNF+IL-1β;4组:ATRA+GDNF+IL-1β。2、3、4组培养液中添加1%FBS、1%B27。10 d后分别取部分有细胞生长的玻片行免疫组织化学检查。药物剂量浓度为:GDNF 10 ng/m l,IL-1β10 ng/m l,ATRA 1.0 μmol/L。倒置显微镜观察细胞形态变化
通过网络分析仪调试的结果如图8所示,其频段为4.5 GHz~10 GHz。图中通带的边频点插损值分别达到了0.76 dB和0.57 dB,比图4中协同仿真曲线上的A1、A2两点值偏大,这是由低通滤波器、测试接头及电缆线自身的损耗引起的;带外两边的抑制分别达到了74 dB和35 dB,这与图4中的协同仿真B1、B2值相比没太大变化;而全腔仿真远端(6 GHz~10 GHz)的抑制均超过了34 dB,与图4中协同仿真结果相比有极大的改善。
1.4.1 免疫荧光染色 诱导10 d后,各组细胞终止培养、诱导,取出玻片,加一抗4℃过夜,加Rhodam ine或fluorescein标记的羊抗兔、羊抗小鼠IgG(1∶100)二抗工作液37℃孵育30m in,DAPI复染核。以不加入一抗的作为阴性对照染色。一抗分别为NSE(1∶200)、GFAP(1∶400)、TH(1∶400)。免疫荧光显微镜下观察。每种抗体标记的细胞至少计数10个低倍镜视野(10×),计算阳性细胞百分率。
1.4.2 RT-PCR 各组分别取诱导分化后的细胞5×106,Trizol常规提取总RNA。逆转录反应为20μl体系,含1μg总RNA、12.5μg/m l随机引物。NSE:94℃预变性5m in,94℃变性30 s,53℃退火30 s,72℃延伸30 s,30次循环后72℃延伸10m in;GFAP:94℃预变性5m in,94℃变性30 s,57℃退火45 s,72℃延伸45 s,30次循环后72℃延伸10m in;TH:95℃预变性5m in,94℃变性45 s,57.5℃退火45 s,72℃延伸2m in,35次循环后72℃延伸10m in。同时在相同条件下扩增GAPDH。引物序列见表1。

表1 引物序列
2 结果
2.1 预诱导
2.1.1 形态学 预诱导1组加入预诱导液后24 h内,细胞聚集成丛、成堆,由细长梭形变为胞体为圆形或短梭形,折光性强,细胞团可由数个至数百个不等细胞胞体聚集,周围伸出不规则短突起。随着时间的延长,胞体逐渐融合,镜下细胞界限不清,突起逐渐缩短直至形成悬浮生长的细胞球(图1~图3)。将细胞球机械吹打为单细胞悬液,单个细胞能继续悬浮生长,并逐渐扩增形成小的细胞球,小的细胞球直径逐渐增大形成大的细胞球。

图1 hucM SC原代培养第7天(倒置相差显微镜,100×)

图2 预诱导1组诱导24 h (倒置相差显微镜,100×)
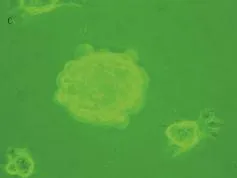
图3 悬浮细胞球形成(预诱导1组) (倒置相差显微镜,400×)
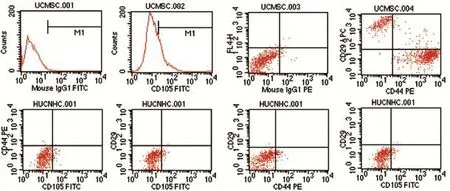
图4 流式细胞学细胞表型鉴定

图5 预诱导1组表达Nestin (免疫荧光,罗丹明标记二抗,200×)

图6 诱导1组(倒置相差显微镜,100×)

图7 诱导1组(倒置相差显微镜,200×)

图8 RT-PCR分析
预诱导2组细胞形态有类似变化,随着培养时间延长,无细胞聚集且无细胞球形成,细胞逐渐发生脱颗粒萎缩死亡。
预诱导3组细胞形态未发生变化,未见细胞聚集、成球;培养5~7 d后,可见少量由密集细胞集合成的细胞团,罕见悬浮细胞球生成。
2.1.2 流式细胞学检测 hucMSCs的 CD29、CD44、CD105表面标志为阳性表达,同时表达CD29、CD44的细胞占5%,CD105阳性率为35%;hucNSC CD29、CD44、CD105表达阴性(图4)。
2.1.3 免疫荧光染色 预诱导1组细胞形成的悬浮细胞球Nestin(图5)、CD133呈强表达,而不表达GFAP、NSE、TH等;预诱导2组1 d内多数细胞Nestin弱表达,而CD133阳性表达细胞占(49±1.7)%;第3天CD133和Nestin分别有(80±3.3)%、(91±3.1)%阳性表达。
2.2 向神经细胞诱导
2.2.1 形态学观察 诱导1组细胞球逐渐分解,放射状伸出细胞,细胞形态与hucMSC和神经细胞的典型形态均不类似,少数细胞有较长的突起。
诱导4组培养2~3 d后,可见细胞呈长梭形,有的伸出很长的突起,胞核清晰;聚集的细胞逐渐分散生长。10~17 d后,许多细胞体积逐渐缩小,变成卵圆形或圆形,无突起或向两极伸出突起;有的细胞呈短梭形带长突起,或小圆胞体带多突起;胞体折光性强;有的胞体不规则但突起较多,细胞突起可见连接成网(图6、图7)。
诱导2、3组形态无明显变化。
2.2.2 免疫荧光染色 各组间GFAP、NSE、TH阳性细胞百分率均有显著性差异(P<0.05)。见表1。

表1 各神经细胞诱导组表面标志表达
2.2.3 RT-PCR RT-PCR示NSE、GFAP、TH mRNA表达(图8)。
3 讨论
NSCs体外在存在生长因子的无血清培养基中呈悬浮生长,不断增殖,形成由单一细胞组成的细胞球;撤去生长因子,接种于涂有粘着剂的平皿中,则分化为神经元、神经胶质细胞、少突胶质细胞[1]。我们在无血清培养基中加入EGF、bFGF、B27培养诱导hucMSC,细胞具有NSCs相似的悬浮、成球生长、自我更新,表达Nestin、CD133等特征。
据报道,间充质干细胞在向神经细胞分化过程中,先转变为表达Nestin的细胞;进一步诱导后,Nestin消失,但没有形成NSCs样细胞。我们推测这与培养基中残留血清有关(预诱导3组)。我们也注意到,当接种于孔板的细胞密度大时,细胞密集聚集,有的形成梭形球状,但无悬浮生长。无血清培养基中仅加入EGF、bFGF,可出现细胞聚集现象,但罕见形成细胞球,提示B27有较关键的作用,机理不清。
NSC在含10%血清培养基中会分化为各型神经细胞。但hucNSC加含10%血清培养基后,没有分化出形态上典型的神经细胞,仅分化出少数表达GFAP的神经胶质细胞。经联合应用RA、GDNF、IL-1β诱导,(57±4.3)%可分化为神经元,其中多巴胺能神经元占(9±3.1)%。提示hucNSC经适当诱导,可以获得神经细胞。
中枢神经系统损伤及退行性病变的修复与再生一直是神经科学研究的热点。NSCs取材困难、不易获得及伦理、法律方面的诸多问题。很多人致力于将易获取的干细胞于体外诱导分化为神经细胞,以提供新的可移植神经细胞来源。如骨髓间充质干细胞已成功地在体外诱导分化为神经细胞[5-6];我们前期也成功地诱导脐带间充质干细胞向神经细胞分化[4];有报道将脐带间充质干细胞诱导为多巴胺能神经元[7]。但诱导得到的神经细胞存在数量少、纯化难、是否真正具备神经细胞的生理功能、存活时间短等问题[8]。未分化的NSCs可能更适合细胞移植。将间充质干细胞来源的NSCs用于细胞移植逐渐成为近年的研究热点[2-3,9]。
脐带为分娩废弃物,来源广泛,取材方便,无伦理及法律障碍。我们对脐带源NSCs的生物特性做了初步探讨,如何使脐带源NSCs更接近于真正的NSCs,值得进一步深入研究。
[1]M ckay R.Stem cell in central nervous system[J].Science, 1997,276(5309):66-71.
[2]Hermann A,Gastl R,Liebau S,et al.Efficient generation of neural stem cell-like cells from adulthuman bonemarrow stromal cells[J].JCell Sci,2004,117(19):4411-4422.
[3]A rshak RA.Neural stem cells induce bone-marrow-derived mesenchymal stem cells to generate neural stem-like cells via juxtacrine and paracrine interactions[J].Exp Cell Res,2005, 310:383-391.
[4]范存刚,张庆俊,韩忠朝.人脐带间充质干细胞向神经细胞分化的研究[J].中华神经外科杂志,2005,21(7):387-392.
[5]Brazelton TR,Rossi FM,Keshet GI,et al.From marrow to brain:expression of neural in adult m ice[J].Science,2000, 290:1775-1779.
[6]Woodbury D,Schw arz EJ,Prockop DJ,et al.Adult rat and human bonemarrow stromal cells differentiate into neurons[J].J NeurosciRes,2000,61(4):364-370.
[7]Fu YS,Cheng YC,Lin MY,etal.Conversion of human umbilical cord mesenchymal stem cells in W harton's jelly to dopam inergic neurons in vitro:potential therapeutic application for Parkinsonism[J].Stem Cells,2006,24:115-124.
[8]Laguna Goya R,Tyers P,Barker RA.The search for a curative cell therapy in Parkinson's disease[J].JNeurol Sci,2007,11: 233-239.
[9]Janow skiM,Lukomska B,Domanska-Janik K.M igratory capabilities of human umbilical cord blood-derived neural stem cells(HUCB-NSC)in vitro[J].Acta Neurobiol Exp(Wars), 2011,71(1):24-35.
Conversion of Hum an Um bilical Cord M esenchym al Stem Cells to Neural Stem Cell-like Cells in Vitro
ZHOU Jian-yun,SUNWei, ZHANG Xin,etal.Department ofNeurosurgery,CapitalMedical University School ofRehabilitation Medicine,Beijing Bo'aiHospital,China Rehabilitation Research Centre,Beijing 100068,China
Ob jectiveTo study the efficient conversion of human umbilical cord mesenchymal stem cells(hucMSC)into a neural stem cell-like population(hucNSC).M ethodsMSCs derived from umbilical cord were cultured and identified w ith fluorescence-activated cell sorting(FACS).They w ere induced w ith epidermal grow th factor(EGF),basic fibroblastgrow th factor(bFGF)and B27,and identified w ith FACS and immunocytochem istry.Then they w ere induced w ith glial-derived neurotrophic fator(GDNF),interleukin-1β(IL-1β)and all-trans retinoic acid(ATRA),and identified w ith immunocytochem istry and RT-PCR.Resu ltshucMSC expressed CD105,CD44and CD29.Induced w ith EGF,bFGF and B27,they expressed CD133and Nestin.Induced w ith GDNF,IL-1βand ATRA,they expressed glial fibrillary acidic protein,neuron specific enolase and tyrosine hydroxylase.ConclusionhucMSCmay be induced into hucNSC,namely the cellsw ith the characteristic grow th,proliferation and differentiation like NSCs.
human umbilical cordmesenchymalstem cells;neural stem cell;dopam inergic neurons;differentiation
R318.5
A
1006-9771(2012)07-0615-04
2011-11-02
2012-05-18)
1.首都医科大学康复医学院,北京市100068;2.中国康复研究中心北京博爱医院神经外科,北京市100068;3.中国康复研究中心医学所,北京市100068;4.北京大学人民医院神经外科,北京市100044。作者简介:周剑云(1970-),男,北京市人,博士,副主任医师,主要研究方向:颅脑外伤、脑血管病、神经康复医学。通讯作者:张庆俊。
10.3969/j.issn.1006-9771.2012.07.006

