大黄与易混伪品土大黄、虎杖原植物的ITS2序列鉴定
李美妮 韩蕊莲 韩建萍 姚辉 罗焜 宋经元
大黄Radix et Rhizoma Rhei为蓼科植物掌叶大黄RheumpalmatumL.、唐古特大黄RheumtanguticumMaxim.ex Balf.或药用大黄RheumofficinaleBaill.的干燥根及根茎[1]。掌叶大黄及唐古特大黄商品习称西大黄;药用大黄商品习称雅黄、南大黄。大黄具有泻肠通便、凉血解毒、逐瘀通经的功效。大黄为常用中药,用量较大,当药源供不应求时,有些地方用土大黄代替大黄使用[2],这就影响了大黄准确、安全的临床效用。土大黄为蓼科植物钝叶酸模RumexobtusifoliusL.、羊蹄RumexjaponicusHoutt.、尼泊尔酸模RumexnepalensisSpreng、网果酸模RumexchalepensisMill.和巴天酸模RumexpatientisL.的根及根茎[3]。土大黄具有止血、清热解毒和消肿的功效。以往的研究已经从来源、性状、显微、理化、功能及主治等几方面对大黄和土大黄进行了鉴别[4]。另外,《中国药典》记载的药材虎杖的原植物蓼科植物虎杖PolygonumcuspidatumSieb. et Zucc.与大黄也常常容易被混淆。虎杖具有祛风利湿、散瘀定痛、祛痰的功效。
植物DNA条形码就是利用一个或少数几个标准的DNA片段快速、准确识别和鉴定植物种类[5],已成为近年来生物分类学研究的热点之一和物种鉴定的一种有力工具。自陈士林等和Yao等[6,7]提出ITS2序列可以作为药用植物乃至植物潜在的候选条形码以来,对于不同科属如蔷薇科、大戟科、菊科、豆科、芸香科、景天属、黄芪属、重楼属、豆蔻属[8-16],该序列均能成功鉴定相关近缘物种,而且在中药及其混伪品鉴定中显示了极大的应用前景,如筋骨草、砂仁、金钱草、京大戟、党参、藁本、小茴香、威灵仙、大青叶、赤芍、高良姜、垂盆草[13,17-27]。ITS2序列短,一般为200 bp左右,容易被成功扩增和测序,甚至对一些降解的药材及粉末也能进行分析。实验研究所需材料少,结果不受环境因素及物种发育阶段的影响,对于形态学上难鉴定的密切相关种具有鉴定准确的优势。宋经元等[28]已经用trnH-psbA序列成功区分开了包括大黄、虎杖在内的蓼科18个物种,本文拟用已经被广泛使用的ITS2序列对中药大黄与其混伪品土大黄、虎杖原植物进行鉴定。
1 材料与方法
1.1 材料来源
材料来源如表1所示,由中国医学科学院药用植物研究所林余霖副研究员鉴定。其中有标本号的为实验材料的序列,实验原材料为硅胶干燥的叶片。其余序列信息下载自GenBank,下载时间为2011年9月。
1.2 方法
提取DNA、PCR和测序:参见前人研究[6]。
数据分析:拼接序列去除引物序列,然后去除5.8S和26S编码区得到ITS2序列,最后计算K2P遗传距离并基于此建立系统发生树[27]。
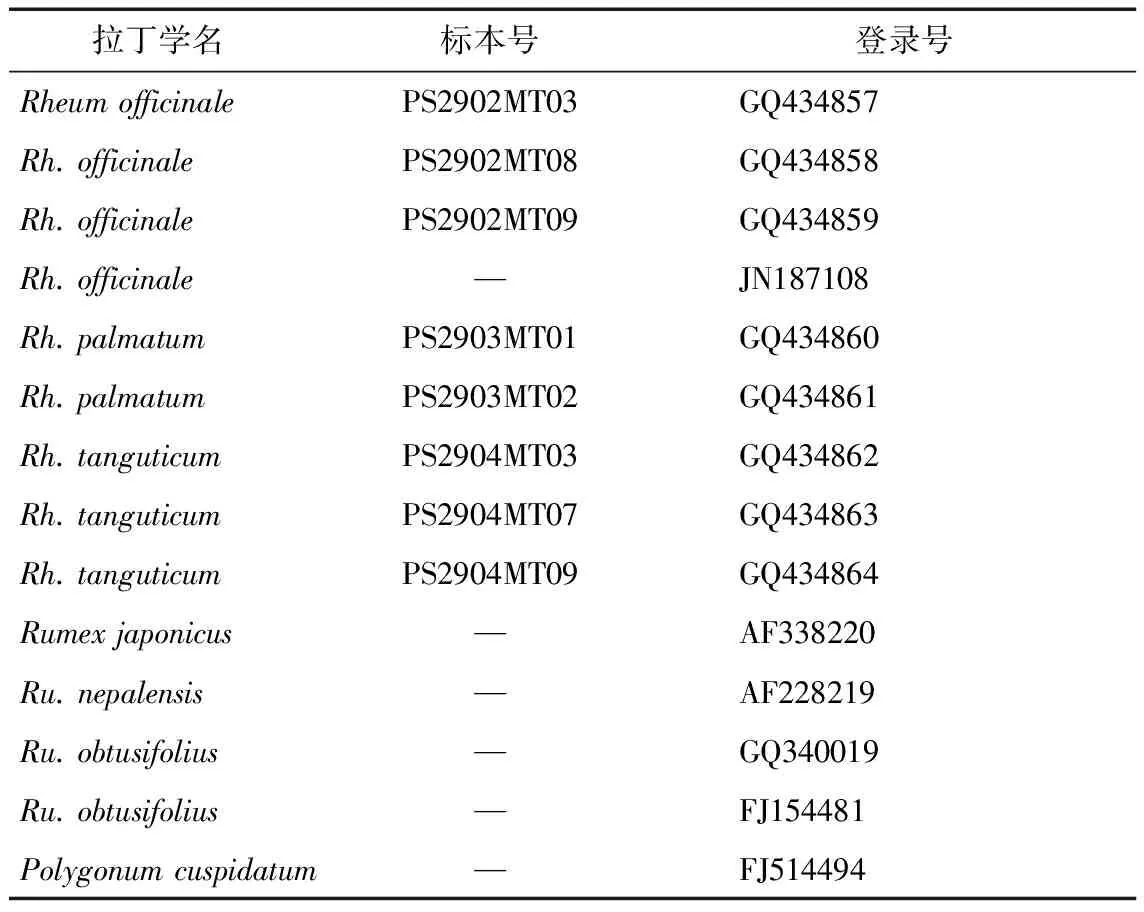
表1 材料来源
2 结果
2.1 大黄种内序列比对分析
由于中药大黄属于多基原药材,所以分析时不仅考虑了各个基原内的种内序列比对,还有基原间的种间序列比对。除了药用大黄种内序列有1个碱基插入缺失外,供试掌叶大黄和唐古特大黄的种内序列均完全相同。大黄种内比对长度为187 bp,有14个碱基变异。见图1。
2.2 大黄与其混伪品土大黄、虎杖的种间序列比对分析
将土大黄的三个基原植物作为一个整体,与大黄的三个基原整体序列进行比对,比对后序列长度为218 bp,有83个碱基的变异,另有41个碱基插入或缺失。虎杖与大黄的三个基原整体比对后序列长度为201 bp,有61个碱基变异,另有17个碱基插入或缺失。如图1所示。
2.3 大黄与其混伪品土大黄、虎杖的K2P遗传距离分析
大黄的三个基原种内、种间的K2P距离,大黄的三个基原分别与土大黄的三个基原、虎杖间的K2P距离如表2所示。根据表2计算大黄的种内K2P距离,与土大黄、虎杖的种间K2P距离,结果见表3。种间最小K2P距离(38.6%)大于种内最大K2P距离(8.0%),因此ITS2序列能够识别大黄原植物及其混伪品土大黄和虎杖。

图1 大黄、土大黄、虎杖种内种间ITS2序列比对

Rh.officinaleRh.palmatumRh.tanguticumRh.officinale0Rh.palmatum1.10Rh.tanguticum6.88.00Ru.japonicus45.544.547.6Ru.nepalensis47.546.748.7Ru.obtusifolius47.146.449.4Polygonumcuspidatum39.939.638.6
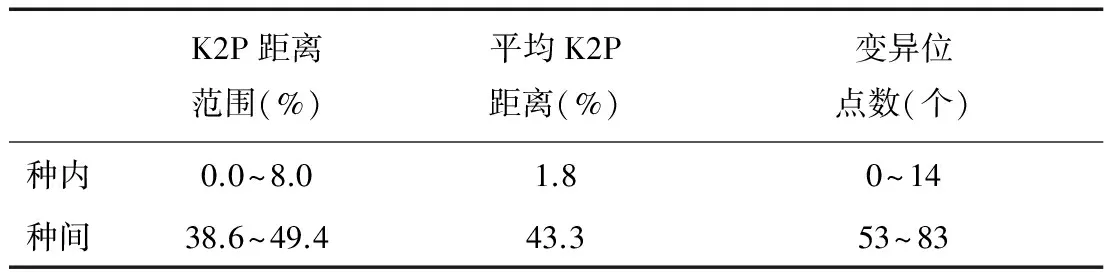
表3 大黄及其混伪品的种内种间K2P距离统计
2.4 聚类分析
从系统聚类树中,可以看出中药大黄的三个基原植物聚为一支,支持率为100,基于ITS2序列的K2P模型系统聚类树能够将大黄与土大黄、虎杖成功地区分开。中药土大黄三个基原植物聚为一支,支持率为99,土大黄能够与虎杖相区别。基于聚类分析表明,ITS2序列可以准确区分大黄原植物及其混伪品土大黄和虎杖。见图2。
3 讨论
本文分析了大黄、土大黄、虎杖基原植物编码核糖体RNA的核基因的ITS2序列的K2P距离,并基于K2P距离建立了系统进化树,均证明ITS2序列可以准确鉴定这三种药材及不同基原植物,为大黄及其混伪品的鉴别提供了新的分子水平的研究方法。虽然对于土大黄3个基原没有完全区别开,但条形码技术并非只局限于单个物种,如一群聚集的个体、一群界限不明的物种[29],因此本文将土大黄作为一个整体的研究思路是可以接受的。另外从系统进化树可以看出土大黄的其中三个基原植物先聚在一起成为一支后,支持率为99,再与虎杖聚为一大支,说明土大黄与虎杖的亲缘关系较大黄近,这与临床应用上虎杖和土大黄经常混淆的现象一致。从系统发生树又可以看出药用大黄的4个不同样品来源先与掌叶大黄的2个不同样品来源聚为一支,支持率为91,然后再与唐古特大黄聚为一支,即药用大黄与掌叶大黄的亲缘关系较唐古特大黄更近。这与索风梅等[30]通过分析大黄三个基原AFLP,研究其亲缘关系的结果一致。从而更进一步说明植物DNA条形码技术为中药鉴定提供了有力的依据,也对植物系统分类工作起到了辅助作用。值得提醒的是,提取大黄DNA时应特别关注真菌污染,尤其是根部。可以通过BLAST方法对所获序列进行比对查错,保证后续的分析结果的准确性。
中药是一个复杂化学物质体系,发挥疗效通过多成分、多层次、多靶点和多途径作用于人体,所以难以从某1~2种成分对其进行鉴定,反应药品的内在质量。因此,在结合传统的形状鉴定、显微鉴定和理化鉴定等传统鉴定方法的基础上,能够成功利用一些现代化分析技术例如近几年的研究热点技术——DNA条形码技术鉴别中药真伪,这一结论无疑给中药鉴定工作带来了极大的促进和希望。

图2 基于K2P模型的ITS2序列的NJ系统发生树图(bootstrap 1000次重复,枝上数值仅显示自展支持率≥50%)
参考文献
[1] 国家药典委员会.中华人民共和国药典(一部)[S].北京:化学工业出版社,2005:17.
[2] 杨兆起,封秀娥.中药鉴别手册:第三册[M].北京:科学出版社,1994:22.
[3] 孔增科,傅正良,熊南燕,等.易混淆中药品种辨析与临床应用[M].天津:天津科技翻译出版公司,2007:46.
[4] 果艳凤,王会丽.大黄与土大黄的鉴别及应用[J].河北中医,2010,32(10):1546-1547.
[5] Kress WJ, Wurdack KJ, Zimmer EA, et al. Use of DNA barcodes to identify flowering plants[J]. Proc Natl Acad Sci USA,2005,102(23):8369-8374.
[6] Shilin Chen, Hui Yao, Jianping Han, et al. Validation of the ITS2 Region as a Novel DNA Barcode for Identifying Medicinal Plant Species[J]. PLoS ONE,2010,5(1):e8613.
[7] Hui Yao, Jingyuan Song, Chang Liu,et al.Use of ITS2 Region as the Universal DNA Barcode for Plants and Animals[J].PLoS ONE,2010,5(10):e13102.
[8] Pang X, Song J, Zhu Y, et al. Applying plant DNA barcodes for Rosaceae species identification[J]. Cladistics, 2011, 27(2): 165-170.
[9] Pang X, Song J, Zhu Y, et al. Using DNA barcoding to identify species within Euphorbiaceae[J]. Plant Medica,2010,76(15):1784-1786.
[10] Gao T, Yao H, Song J, et al. Evaluating the Feasibility of Using Candidate DNA Barcodes in Discriminating Species of the Large Asteraceae Family[J].BMC Evolutionary Biology,2010,26(10):324.
[11] Gao T, Yao H, Song J, et al. Identification of medicinal plants in the family Fabaceae using a potential DNA barcode ITS2[J].Journal of Ethnopharmacology,2010,130(1):116-121.
[12] 罗焜,陈士林,陈科力,等.基于芸香科的植物通用DNA条形码研究[J].中国科学:生命科学,2010,40(4):342-351.
[13] 李妮,陈科力,刘震,等.景天属药用植物DNA条形码研究[J].世界科学技术-中医药现代化,2010,12(3):463-467.
[14] 高婷,姚辉,马新业,等.中国黄芪属药用植物DNA条形码(ITS2)鉴定[J].世界科学技术-中医药现代化,2010,12(2):222-227.
[15] 朱英杰,陈士林,姚辉,等.重楼属药用植物DNA条形码鉴定研究[J].药学学报,2010,45(3):376-382.
[16] 石林春,宋经元,陈士林,等.豆蔻属药用植物DNA条形码鉴定研究[J].世界科学技术-中医药现代化,2010,12(3):473-479.
[17] 韩建萍,石林春,陈士林,等.ITS2序列鉴定筋骨草及其近缘种[J].世界科学技术-中医药现代化,2008,10(6):86-89,81.
[18] 韩建萍,李美妮,石林春,等.砂仁及其混淆品的ITS2序列鉴定[J].环球中医药,2011,4(2):99-102.
[19] 庞晓慧,宋经元,孙超,等.中药金钱草及其混淆品的ITS2序列分析与鉴别[J].环球中医药,2011,4(2):95-98.
[20] 石林春,宋经元,李莉,等.基于ITS2条形码序列的京大戟及其易混品的DNA分子鉴定[J].环球中医药,2011,4(2):103-108.
[21] 刘美子,刘萍,李美妮,等.党参及其易混伪品的ITS2分子鉴定[J].世界科学技术-中医药现代化,2011,13(2):412-417.
[22] 高婷,姚辉,陈士林,等.基于ITS2序列的藁本与常见混伪品的分子鉴定[J].世界科学技术-中医药现代化,2011,13(2):418-423.
[23] 刘义梅,罗焜,陈科力,等.ITS2序列鉴定小茴香及其常见混伪品[J].环球中医药,2011,4(4):260-263.
[24] 曾旭,李莉,业宁,等.基于ITS2条形码的中药材威灵仙与其易混伪品的鉴定[J].环球中医药,2011,4(4):264-269.
[25] 孙稚颖,罗红梅,陈士林,等.大青叶及其混淆品的ITS2序列鉴定研究[J].世界科学技术-中医药现代化,2011,13(2):395-399.
[26] 孙稚颖,宋经元,姚辉,等.基于ITS2条形码的中药材赤芍及其易混伪品的DNA分子鉴定[J].世界科学技术-中医药现代化,2011,13(2):407-411.
[27] 罗焜,陈科力,刘义梅,等.高良姜及其混淆品的分子鉴定[J].世界科学技术-中医药现代化,2011,13(2):400-406.
[28] Jingyuan Song, Hui Yao, Ying Li, et al. Authentication of the family Polygonaceae in Chinese pharmacopoeia by DNA barcoding technique[J]. Journal of Ethnopharmacology, 2009,124(3):434-439.
[29] 陈念,赖小平.药用植物DNA条形码物种鉴定技术[J].中药材,2010,33(4):648-650.
[30] 索风梅,宋经元,陈士林,等.AFLP分析唐古特大黄、掌叶大黄和药用大黄的亲缘关系研究[J].中草药,2010,41(2):292-296.

