胃酸分泌的调节
吴 静 综述 李学良 审校
南京医科大学第一附属人民医院消化科(210029)
一、胃酸分泌
胃酸是消化、吸收不可或缺的因子,生物体可根据自身需要分泌胃酸。基础胃酸分泌是生长抑素长期抑制壁细胞、肠嗜铬细胞(enterochromaffin cell,ECL)和G细胞的结果。胃酸分泌包括三个阶段,即脑期、胃期和肠期。脑期即进食准备(食物刺激嗅觉、味觉、视觉)刺激中枢神经,通过迷走神经传出支节前神经元与肠神经节后神经元形成突触联系,以此刺激肠神经元释放神经递质,通过将信号传递至胃黏膜,刺激相关细胞,以此调节胃酸分泌;胃期,即受食物膨胀和胃腔内营养物质的刺激,经以下途径分泌胃酸:①胃体和胃窦部扩张感受器刺激迷走神经;②胃腔内氨基酸、钙离子等刺激钙离子敏感受体(calcium-sensing receptor,CaR)[1];③食物对胃酸起缓冲作用,升高胃内pH,以此刺激胃酸分泌。肠期,当胃内容物到达十二指肠时,即为肠期的开始,可在肠腔脂肪的刺激下,通过释放胆囊收缩素(cholecystokinin,CCK)、促胰液素(secretin)、胰高血糖素样肽 1(glucogon like peptide-1,GLP-1)等肠抑胃素,刺激胃窦部D细胞分泌生长抑素,从而抑制胃酸分泌。
人体可通过上述三个重要的生理过程调节胃酸分泌,每个时期又可通过不同的受体和信号通路促进或抑制胃酸分泌。
二、组胺激活途径
组胺(histamine)由 L-组氨酸在组氨脱羧酶(histidine decarboxylase,HDC)的作用下形成,由ECL细胞分泌,可促进胃酸分泌。胃泌素或垂体腺苷酸环化酶激活肽(pituitary adenylate cyclase activating peptide,PACAP)可刺激 ECL细胞分泌组胺。组胺可经旁分泌途径与壁细胞底膜H2受体结合;亦有研究[2]发现,ECL细胞可通过神经纤维样延伸结构与壁细胞直接接触,由前者分泌的组胺可经神经内分泌机制参与壁细胞的泌酸过程。H2受体通过与Gs/Gq蛋白耦联,激活腺苷酸环化酶(adenylate cyclase,AC),致壁细胞内第二信使cAMP浓度升高(见图1),激活蛋白激酶A(PKA),活化的PKA可致下游效应器磷酸化反应[3],最终使壁细胞膜、骨架重新排列,为胃酸分泌作好准备。磷酸化反应相关下游效应器包括:①Ezrin(分子质量为 80 kDa,1 Da=0.9921 u),属细胞骨架蛋白,可对壁细胞顶膜起重塑作用。Ezrin磷酸化位点突变(Thr567)可影响壁细胞的极化和含H+-K+-ATP酶的管状囊泡的重新生成[4];Ezrin减少可致管状囊泡向壁细胞顶膜融合受阻,胃酸分泌减少[5];②Lasp-1(分子质量为40 kDa),是一种F-actin结合蛋白,组胺升高壁细胞内cAMP可致Lasp-1磷酸化,此过程与胃酸分泌相关。Lasp-1基因敲除小鼠基础胃酸分泌不受影响,但由组胺刺激的胃酸分泌明显增加,提示其具有负性调节胃酸分泌的作用[6]。
其中,细胞内cAMP水平受以下因素调节:①磷酸二酯酶,可水解cAMP为非活性状态[7];②三磷酸肌醇激酶(PI3K),可激活PKB/Akt,抑制cAMP形成[8]。
胃泌素、PACAP、血管活性肠肽(vasoactive intestinal peptide,VIP)、ghrelin等均可刺激组胺分泌;生长抑素、降钙素基因相关肽(CGRP)、前列腺素、PYY、甘丙肽(galanin)等可抑制组胺分泌[9]。
三、胆碱能物质途径
乙酰胆碱(acetylcholine,Ach)可直接作用于肠神经(enteric nervous system,ENS)节后纤维,刺激壁细胞分泌胃酸。Ach受体分为烟碱型受体(nicotinic acetylcholine receptor,nAChRs)和毒蕈碱型受体(muscarinic acetylcholine receptors,mAChRs),Ach主要通过结合mAChRs,调控胃酸分泌。
目前认为mAChRs包括五种亚型(M1~M5),上述受体亚型存在于包括胃肠道在内的多种外周脏器中,参与调节相关脏器的自主功能。其中M3受体位于壁细胞,由其介导的信号通路在调控胃酸分泌方面具有重要作用。研究[10]发现,M3受体基因敲除小鼠的胃酸分泌减少,有活性的壁细胞比例下降,可致高胃泌素血症;卡巴胆碱、组胺、胃泌素刺激所致小鼠胃酸分泌受抑,但卡巴胆碱刺激下约30%的胃酸分泌作用仍保留,但可被哌仑西平(M1受体阻断剂)或法莫替丁(H2受体阻滞剂)所阻断,由此提示M3受体在调节基础胃酸分泌中发挥重要作用,而M1受体亦可能参与其此过程。但Aihara等[11]的另一项研究发现,卡巴胆碱可能通过M3和M5受体而非M1受体调节胃酸分泌。
Ach的作用包括:①结合壁细胞M3受体,直接刺激胃酸分泌,此效应与胞内Ca2+浓度升高有关;②刺激G细胞分泌胃泌素,后者通过刺激ECL细胞释放组胺,直接或间接刺激胃酸分泌;③结合D细胞M2、M4受体,抑制生长抑素的分泌,间接增加胃酸分泌。其中,Ach可结合壁细胞M3受体,通过Gq蛋白升高胞内Ca2+浓度(见图1),此过程与三磷酸肌醇(IP3)相关[12]。 Ochi等[13]发现,胆碱能物质、胃泌素可分别结合壁细胞M3受体和CCK2受体,通过cAMP介导的信号通路调节胃酸分泌,此过程依赖胞外Ca2+浓度。
四、胃泌素途径
胃泌素是进食刺激胃酸分泌的主要物质之一,主要由胃窦部G细胞分泌。胃泌素和CCK含相同的羧基末端五肽序列,其受体包括CCK1受体和CCK2受体。其中CCK1受体特异性结合CCK,CCK2受体与CCK和胃泌素的亲和力均较高。CCK2受体位于壁细胞和ECL细胞。胃泌素在结合壁细胞CCK2受体后,其信号通路亦与胆碱能物质类似,可通过增加壁细胞内Ca2+浓度,由此调节胃酸分泌(见图1)[14];胃泌素基因敲除小鼠中的研究[15]发现,胃酸分泌减少,壁细胞内Ezrin蛋白含量减少、分布异常,组胺、胃泌素和胆碱能物质不能刺激此类小鼠分泌胃酸。但Ezrin蛋白异常是否足以减少胃酸分泌,还有待进一步实验证实。胃泌素与ECL细胞CCK2受体结合,可促进其分泌组胺,由此促进胃酸分泌,是胃泌素刺激胃酸分泌的主要方式[14]。
Ach、胃泌素释放肽(GRP)、secretin、2/3-肾上腺素能激动剂、Ca2+、芳香族氨基酸、酒精性饮料等均可刺激胃泌素释放;生长抑素、galanin、腺嘌呤等可抑制胃泌素释放。
五、生长抑素途径
D细胞分泌的生长抑素是抑制胃酸分泌的主要物质,可作用于壁细胞2型生长抑素受体(somatostatin receptor-2,SSTR-2)[9]。CCK或血管活性肠肽(VIP)可激活D细胞,释放生长抑素。SSTR-2可与壁细胞、ECL细胞的Gi蛋白偶联,由此抑制与CCK2受体或M3受体偶联的Gq蛋白,抑制磷脂酶C活化,抑制胞内Ca2+释放,由此减少胃酸分泌[16](见图1)。D细胞可通过紧密接触长期抑制壁细胞分泌胃酸、抑制ECL细胞分泌组胺、抑制G细胞分泌胃泌素[17]。但胆碱能神经元亦可通过D细胞M2、M3受体消除这种抑制作用,这是刺激胃酸分泌的重要生理机制。
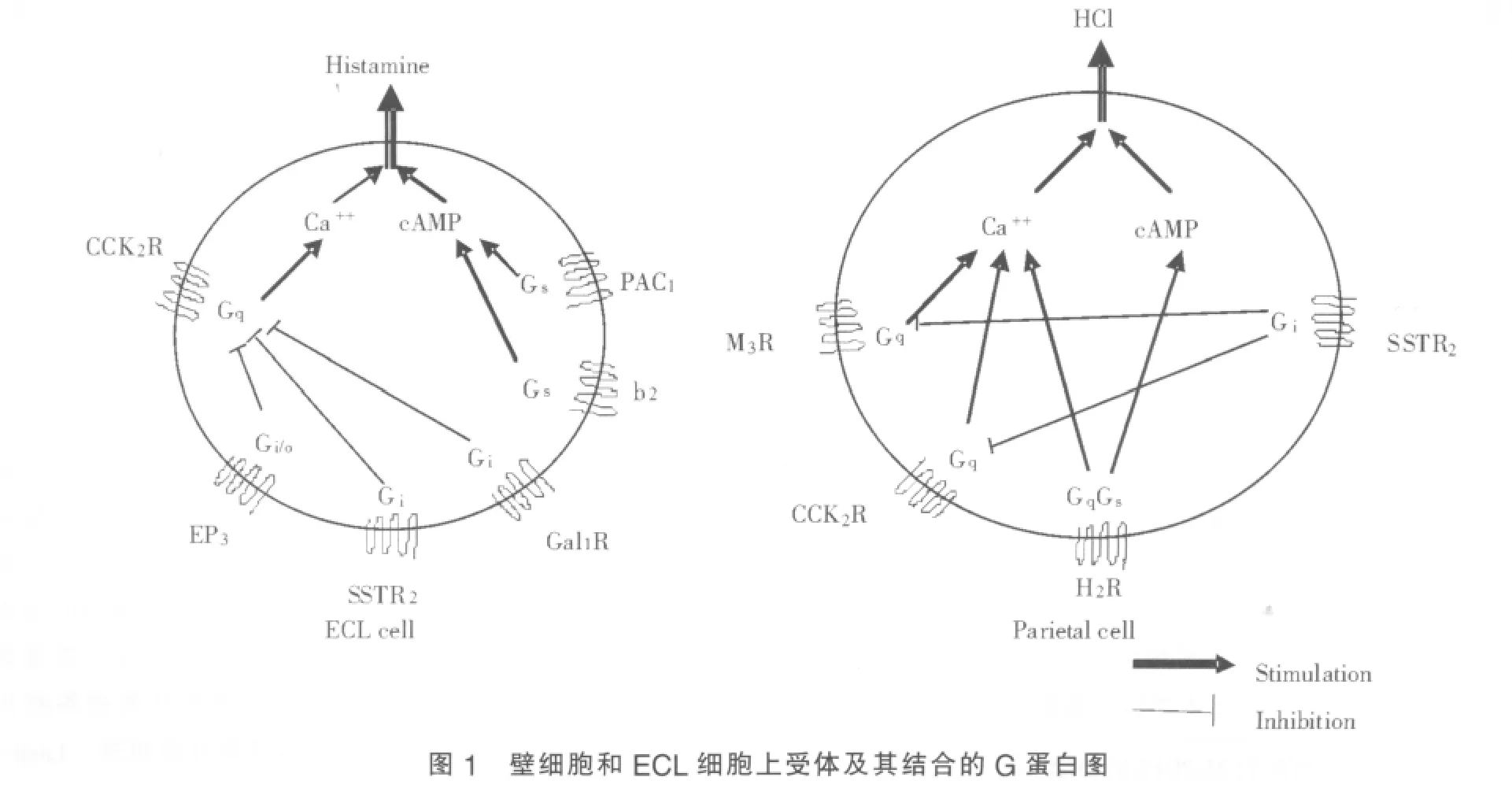
研究发现,ECL细胞膜甘丙肽1型受体(galanin receptor type 1,GalR1)可通过与其偶联的Gi蛋白抑制CCK2受体(见图1)。SSTR-2基因敲除小鼠的ECL细胞膜GalR1含量上升,外源性甘丙肽可明显抑制胃酸分泌,提示甘丙肽是抑制胃酸分泌的代偿机制之一[9]。另有研究[18]发现,腺苷酸及其类似物可通过减少胃酸分泌,抑制应激诱导的胃溃疡的形成。特定腺苷酸受体基因敲除小鼠的研究发现,腺苷酸可通过浓度依赖性方式双相调节生长抑素的释放。高浓度腺苷酸可刺激D细胞分泌生长抑素,低浓度腺苷酸则抑制生长抑素的释放。
胃泌素、GRP、VIP、PACAP、2/3-肾上腺素能激动剂、促胰液素、心房钠尿肽(artrial natriuretic polypeptide,ANP)、肾上腺髓质激素、amylin、腺嘌呤、CGRP、Ach、干扰素等可抑制生长抑素分泌。胃酸分泌增多可刺激生长抑素的分泌。
六、钙离子敏感受体(CaR)
CaR是G蛋白耦联受体家族C(C family of G proteincoupled receptors,GPCR)成员之一,可维持细胞外Ca2+稳定。目前认为CaR是一种多通道感受器,多价阳离子、多胺类物质、L-氨基酸、pH 值、Ca2+、Mg2+等可调节其活性[1]。 胃黏膜 CaR主要表达于壁细胞基底膜、黏液细胞、G细胞和D细胞[19]。Feng等[20]认为,胃幽门腺G细胞CaR可感受胃腔各种营养物质的变化,进而作为一种生理性多通道感受器刺激胃泌素分泌、维持G细胞数量的恒定,由此提示CaR在胃期胃酸分泌的调控中发挥重要作用。
七、迷走神经-肠神经节后神经纤维
胃组织神经系统包括肠神经系统(ENS)、迷走神经传入和传出神经元。迷走传出神经纤维为节前神经元,不直接分布于壁细胞或神经内分泌细胞,而是与ENS节后神经元形成突触连接。ENS节后神经元可分泌多种神经递质,包括Ach、GRP、VIP、PACAP、一氧化氮(NO)和 P 物质[21],以此刺激G细胞分泌胃泌素、ECL细胞分泌组胺、D细胞分泌生长抑素、EC细胞分泌ANP,直接或间接调节胃酸分泌。
八、局部释放的细胞因子
1.表皮生长因子(epidermal growth factor,EGF)/转化生长因子:EGF可维持胃黏膜完整,抑制壁细胞分泌胃酸,促进黏膜细胞DNA、RNA和蛋白合成等,亦可通过结合胃肠黏膜细胞特异性表皮生长因子受体(epidermal growth factor receptor,EGFR)发挥作用。EGFR是一种单跨膜受体酪氨酸激酶,可与配体结合诱导受体二聚化,进而磷酸化激活EGFR上多个羧基末端酪氨酸激酶,由此激活下游信号通路[22]。研究[23]示,大鼠活体实验中抑制EFGR可增强由组胺刺激的胃酸分泌,推测EGF可通过多种信号转导通路调节胃酸分泌,但其具体机制尚待进一步研究。
转化生长因子(transforming growth factor,TGF)-α是EGF的同源多肽,存在于多种生物体壁细胞和上皮细胞内,其与EGFR结合可通过旁分泌或近分泌调节胃酸分泌[24]。短期予TGF-α、EGF可抑制组胺刺激的胃酸分泌。但长期EGF刺激可增强组胺刺激的胃酸分泌,推测与ERKs信号通路有关[24]。此外,Bastaki等[25]发现,TGF-α非肠道给药方式可抑制dimaprit(H2受体激动剂)和五肽胃泌素刺激的胃酸分泌,提示TGF-α可能通过影响cAMP和PKC调控的胞内第二信使系统,以此抑制胃酸分泌。而EGF可能仅通过影响cAMP信号通路,抑制胃酸分泌。
2.前列腺素类(prostaglandins,PGs):胃的诸多生理过程需PGs的参与,包括胃酸分泌、黏液产生和胃黏膜血流量的调节,因此是保护胃黏膜的重要物质。花生四烯酸可在磷脂酶A2和环氧合酶同工酶的作用下生成PGs。环氧合酶是合成PGs的关键酶,包括环氧合酶1(cycloxygenase1,COX1)和COX2两种同工酶。COX1可在正常胃黏膜组织中持续表达,由此生成的PGs可维持重要的生理功能。COX2由各种前炎症因子诱导产生,可在炎症部位促进病理性PGs的生成[26]。
前列腺素(PG)E2对胃酸分泌具有双重调节作用,其可通过EP3受体抑制胃酸分泌,通过EP4受体促进胃酸分泌。抑制胃酸分泌的作用可能通过直接抑制壁细胞和ECL细胞实现,而促进胃酸分泌可能通过促进ECL细胞释放组胺实现[27]。
九、其他
胃酸分泌需要消耗大量能量,因此壁细胞内含大量线粒体,用以保证胃酸分泌的能量供应。研究[28]发现,AMPK可下调关键酶的活性,降低能量消耗,致AMP/ATP比值升高,以此激活AMPK,降低H+-K+-ATPase活性,以此减少胃酸分泌。此外,AMPK亦可通过抑制壁细胞顶膜氯离子通道,即囊性纤维化跨膜转导调节因子(cystic fibrosis transmembrance regulator,CFTR),抑制胃酸分泌。但AMPK调节细胞H+-K+-ATPase活性的确切机制尚不清楚。
综上所述,胃酸是胃内消化吸收过程中的重要因子,亦是部分上消化道疾病的重要病因,对胃酸分泌调节过程的深入了解,可有助于预防和治疗上消化道酸相关性疾病。
1 ConigraveAD,Brown EM.Tastereceptorsin the gastrointestinal tract.Ⅱ.L-amino acid sensing by calcium-sensing receptors:implications for GI physiology[J].Am J Physiol Gastrointest Liver Physiol,2006,291(5):G753-G761.
2 Gustafsson BI,Bakke I,Hauso Ø,et al.Parietal cell activation by arborization ofECL cellcytoplasmic projections is likely the mechanism for histamine induced secretion of hydrochloric acid[J].Scand J Gastroenterol,2011,46(5):531-537.
3 Chew CS.Parietalcellprotein kinases.Selective activation of typeⅠcAMP-dependent protein kinase by histamine[J].J Biol Chem,1985,260(12):7540-7550.
4 Zhou R,Zhu L,Kodani A,et al.Phosphorylation of ezrin on threonine 567 producesa change in secretory phenotype and repolarizes the gastric parietal cell[J].J Cell Sci,2005,118(Pt 19):4381-4391.
5 Tamura A,Kikuchi S,Hata M,et al.Achlorhydria by ezrin knockdown:defects in the formation/expansion of apical canaliculi in gastric parietal cells[J].J Cell Biol,2005,169(1):21-28.
6 Chew CS,Chen X,Bollag RJ,et al.Targeted disruption of the Lasp-1 gene is linked to increases in histaminestimulated gastric HCl secretion[J].Am J Physiol Gastrointest Liver Physiol,2008,295(1):G37-G44.
7 Okuda S,Honda M,Ito Y,et al.Phosphodiesterase isozymes involved in regulating acid secretion in the isolated mouse stomach[J].J Physiol Pharmacol,2009,60 Suppl 7:183-190.
8 Rotte A,Pasham V,Bhandaru M,et al.Regulation of gastric acid secretion by PKB/Akt2[J].Cell Physiol Biochem,2010,25(6):695-704.
9 Zhao CM,Martinez V,Piqueras L,et al.Control of gastric acid secretion in somatostatin receptor 2 deficient mice:shiftfrom endocrine/paracrine to neurocrine pathways[J].Endocrinology,2008,149(2):498-505.
10 Aihara T,Fujishita T,Kanatani K,et al.Impaired gastric secretion and lack of trophic responses to hypergastrinemia in M3 muscarinic receptor knockout mice[J].Gastroenterology,2003,125(6):1774-1784.
11 Aihara T,Nakamura Y,Taketo MM,et al.Cholinergically stimulated gastric acid secretion is mediated by M(3)and M(5)but not M(1)muscarinic acetylcholine receptors in mice[J].Am J Physiol Gastrointest Liver Physiol,2005,288(6):G1199-G1207.
12 Kajimura M,Reuben MA,Sachs G.The muscarinic receptor gene expressed in rabbit parietal cells is the m3 subtype[J].Gastroenterology,1992,103(3):870-875.
13 Ochi Y,Horie S,Maruyama T,et al.Necessity of intracellular cyclic AMP in inducing gastric acid secretion via muscarinic M3 and cholecystokinin2 receptors on parietal cells in isolated mouse stomach[J].Life Sci,2005,77(16):2040-2050.
14 Schmitz F,Göke MN,Otte JM,et al.Cellular expression of CCK-A and CCK-B/gastrin receptors in human gastric mucosa[J].Regul Pept,2001,102(2-3):101-110.
15 Pagliocca A,Hegyi P,Venglovecz V,et al.Identification of ezrin as a target of gastrin in immature mouse gastric parietal cells[J].Exp Physiol,2008,93(11):1174-1189.
16 Chen D,Zhao CM.Complexity of gastric acid secretion revealed by targeted gene disruption in mice[J].Curr Pharm Des,2010,16(10):1235-1240.
17 Hou W,Schubert ML.Treatment of gastric carcinoids[J].Curr Treat Options Gastroenterol,2007,10(2):123-133.
18 Yang GK,Chen JF,Kieffer TJ,et al.Regulation of somatostatin release by adenosine in the mouse stomach[J].J Pharmacol Exp Ther,2009,329(2):729-737.
19 Nakamura E,Hasumura M,Gabriel AS,et al.Functional role of calcium-sensing receptor on somatostatin release from rat gastric mucosa[J].Gastroenterology,2010,138:S404.
20 Feng J,Petersen CD,Coy DH,et al.Calcium-sensing receptor is a physiologic multimodal chemosensor regulating gastric G-cell growth and gastrin secretion[J].Proc Natl Acad Sci U S A,2010,107 (41):17791-17796.
21 Smith VC,Dhatt N,Buchan AM.The innervation of the human antro-pyloric region:organization and composition[J].Can J Physiol Pharmacol,2001,79(11):905-918.
22 Podolsky DK. Peptide growth factors in the gastrointestinal tract.In:LR Johnson,KE Barret,FK Gishan,eds.Physiology of the Gastrointestinal Tract[M].4thed.NewYork:Raven Press,2006:129-167.
23 Ancha HR,Ancha HB,Tedesco DS,et al.Inhibition of epidermal growth factor receptor activation enhances in vivo histamine-stimulated gastric acid secretion in the rat[J].Dig Dis Sci,2006,51(2):274-281.
24 Kusayanagi S, Takeuchi Y, Todisco A, et al.Extracellular signal-regulated protein kinases mediate H(+),K(+)-ATPase alpha-subunit gene expression[J].Biochem Biophys Res Commun,2002,290(4):1289-1294.
25 Bastaki SM,Chandranath SI,Singh J.Comparison of the antisecretory and antiulcer activity of epidermal growth factor,urogastrone and transforming growth factor alpha and its derivative in rodents in vivo[J].Mol Cell Biochem,2002,236(1-2):83-94.
26 Takeeda M,Hayashi Y,Yamato M,et al.Roles of endogenous prostaglandins and cyclooxygenase izoenzymes in mucosal defense of inflamed rat stomach[J].J Physiol Pharmacol,2004,55(1 Pt 2):193-205.
27 Kato S,Aihara E,Yoshii K,et al.Dual action of prostaglandin E2 on gastric acid secretion through different EP-receptor subtypes in the rat[J].Am J Physiol Gastrointest Liver Physiol,2005,289(1):G64-G69.
28 Sidani S,Kopic S,Socrates T,et al.AMP-activated protein kinase:a physiological off switch for murine gastric acid secretion[J].Pflugers Arch,2009,459(1):39-46.

