吉非替尼治疗表皮生长因子受体基因突变的晚期非小细胞肺癌患者疗效的meta分析
侯彦丽,杨拴盈,李 维,明宗娟,戎彪学,张学德,刘晓丽
(西安交通大学医学院第二附属医院呼吸科, 西安 710004)
近年来,肺癌已居全球首位,全球范围内肺癌仍是癌症中导致死亡的最主要原因之一[1],2009年我国卫生统计年鉴显示,肺癌导致的死亡高居所有癌症死亡的首位(30.83/10万)。非小细胞肺癌(non-small cell lung cancer, NSCLC)早期通常无症状,70%~80%患者在确诊时已属晚期。含铂类的化疗药物是目前晚期 NSCLC的标准一线化疗方案,但总有效率仅为30%~40%,中位生存期仅为8~11个月[2]。近年来随着对基因和信号转导研究的进展,分子靶向治疗为肿瘤的治疗提供了新的思路。
靶向表皮生长因子受体(epidermal growth factor receptor, EGFR)的治疗,是近年来出现的确有疗效的抗肿瘤治疗。EGFR是erbB受体酪氨酸激酶家族成员之一。该家族包括EGFR(erbBl/HERl)、erbB2(HER2/neu)、erbB3(HER3)和 erbB4(HER4)。EGFR是细胞信号转导的必要条件。EGFR被激活后,通过其下游信号转导通路,影响细胞的分化、增殖、游动、侵入、黏附、细胞修复和血管再生等过程。EGFR酪氨酸激酶抑制剂——吉非替尼是一种能口服的小分子苯胺喹唑啉类化合物。该药能进入细胞内,与ATP竞争EGFR的特定结合位点,从而抑制酪氨酸激酶的活性。研究发现,吉非替尼通过多种机制发挥抗肿瘤的作用:诱导细胞周期阻滞在G0期;增加凋亡和抑制细胞增殖;抗血管生成和抗转移;逆转肿瘤细胞的耐药性;增强细胞毒性药物的效应。
国外有研究认为[3,4],EGFR突变可以预测吉非替尼治疗 NSCLC患者的疗效。研究都是受肿瘤靶向药物Imatinib和Trastuzumab研究结果的启发,即c-kit突变可以预测Imatinib对胃肠间质瘤的疗效;HER2/neu基因的扩增可以有效预测Trastuzumab治疗乳腺癌的疗效。他们通过对肺癌组织和正常组织的EGFR基因的测序,以及对肿瘤细胞系基因突变的生化效应的评价,认为EGFR突变与吉非替尼的敏感性相关。
本文将根据国内外有关吉非替尼治疗EGFR基因突变的晚期 NSCLC患者的研究报道,对其作用于 EGFR基因突变的晚期NSCLC患者的疗效进行系统评价。
1 对象与方法
1.1 纳入标准
1.1.1 研究类型 国内外公开发表的随机对照试验,无论是否采用盲法。
1.1.2 研究对象 (1)年龄>18 岁;(2)ECOG 0~3分;(3)预计生存期>3个月;(4)经肿瘤细胞病理诊断为ⅢB期~Ⅳ期;(5)有肿瘤标本可进行EGFR基因检测;(6)患者自愿接受吉非替尼治疗,并根据其意愿决定继续或者终止治疗;(7)以往接受化疗的方案不限。
1.1.3 干预措施 服用吉非替尼,每日1次,每次250 mg。
1.1.4 结局指标 完全缓解(complete response,CR)、部分缓解(partial response, PR)、病情稳定(stable disease, SD)、疾病进展(progress of disease,PD)、总有效率(overall response rate, ORR)、疾病控制率(disease control rate, DCR)。
1.1.5 判效标准 ORR=(CR+PR)/总例数,DCR=(CR+PR+SD)/总例数,进展率=PD/总例数。
1.2 检索策略
计算机检索维普数据库(2000—2011.06)、万方数据库(2000—2011.06)、CNKI(2000—2011.06)、OVID(2000—2011.06)、Karger Online Jounals(2000—2011.06)。检索词包括:非小细胞肺癌、吉非替尼、易瑞沙、表皮生长因子受体、基因突变、non-small cell lung cancer、NSCLC、gefitinib、iressa、EGFR mutation等。
1.3 资料提取和质量评价
由两位研究者按照设计好的资料提取表,独立提取资料并交叉核对,保证数据的准确性。文献的质量分级主要参照循证医学指南中的“证据分级水平及依据”,分为5个等级。A级:设计良好的随机对照试验;B级:设计较好的队列或病例对照研究;C级:病例报告或有缺点的临床试验;D 级:个人的临床试验;E级:没有足够的证据以形成一种意见。
1.4 统计学处理
统计学分析采用RevMan 5.1版统计软件。计数资料选择优势比(RR)作为效应尺度指标,计算95%可信区间(CI)。RR>1表示试验组的效应量大于对照组,RR<1时表示试验组效应量小于对照组。假设检验采用卡方检验,P<0.05为差异有统计学意义。当纳入研究统计学异质性检验结果为P>0.05,I2<50%,认为各项研究同质,采用固定效应模型,当纳入研究统计学异质性检验结果为P<0.05,I2>50%,认为各项研究异质,采用随机效应模型。
2 结 果
2.1 检索结果和纳入研究的一般特征
检索结果及纳入研究的一般特征见表1。
2.2 吉非替尼治疗晚期NSCLC患者的有效率
2.2.1 纳入研究情况(表 2) 纳入研究均为前瞻性研究,共860人,9项研究,其中8项研究来自于亚洲,1项研究来自于欧洲,男性 380人,女性480人;提供吸烟史的7项研究共818人,其中吸烟者273人,非吸烟者545人;提供明确病例组织学类型8项研究共830人,其中临床确诊为腺癌者689人,其他细胞类型者141人。
2.2.2 meta分析结果 共纳入9项研究860人,其突变组397人,非突变组463人,经异质性检验,I2=21%,自由度为8,P=0.26,认为各项研究同质,采用固定效应模型。结果RR=4.42,95% CI(3.49~5.60)。总体效应检验,Z=12.29,P<0.05,差异具有统计学意义。认为吉非替尼治疗晚期 NSCLC患者突变组的总有效率明显优于非突变组(图1)。

表1 纳入研究的一般特征Table 1 General characteristics of included studies

表2 吉非替尼治疗晚期NSCLC患者疾病有效率数据统计Table 2 Efficiency of gefitinib for patients with advanced NSCLC disease
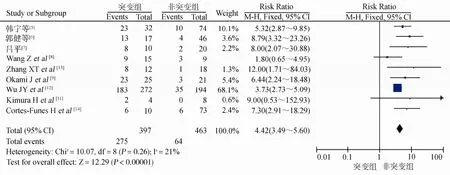
图1 突变组与非突变组疾病有效率的meta分析Figure 1 Meta-analysis for efficiency of mutation group and non-mutation group
2.2.3 敏感性分析 对随机效应模型与固定效应模型之间进行敏感度分析;全部入选文献与单纯的病例对照研究之间进行敏感度分析,结果见表3。
随机效应模型与固定效应模型之间进行敏感度分析,未发现明显差异。总体来讲,剔除某一单一研究,对最终结果影响不大。
2.2.4 发表性偏倚的识别 如图2所示,所有资料对应的点位于95% CI内,但漏斗图对称性差,表明可能存在发表性偏倚,分析原因:(1)样本量小;(2)基于已经公开发表的研究结果,有统计学意义的占多数,从而夸大效应量而导致发生偏倚。
2.3 吉非替尼治疗晚期NSCLC患者疾病控制率
2.3.1 纳入研究情况(表 4) 纳入研究均为前瞻性研究,共833人,7项研究,其中6项研究来自于亚洲,1项研究来自于欧洲,男性 365人,女性468人;其中病理细胞类型为腺癌者 698人,其他细胞类型者35人;提供吸烟史的6项研究共821人,其中吸烟者272人,非吸烟者549人。
2.3.2 Meta分析结果 共纳入7项研究833人,其突变组397人,非突变组436人,经异质性检验,I2=92%,自由度为 6,P<0.00001,认为各项研究异质,采用随机效应模型。结果RR=1.79,95% CI(1.23~2.61)。总体效应检验,Z=3.04,P<0.05,差异具有统计学意义。认为吉非替尼治疗晚期NSCLC患者突变组的疾病控制率明显优于非突变组(图3)。
2.3.3 敏感性分析 对随机效应模型与固定效应模型之间进行敏感度分析;全部入选文献与单纯的病例对照研究之间进行敏感度分析,结果见表5。
随机效应模型与固定效应模型之间进行敏感度分析,未发现明显差异。总体来讲,剔除某一单一研究,对最终结果影响不大。
2.3.4 发表性偏倚的识别 如图4所示,漏斗图基本对称,所有资料对应的点位于95% CI内,表明发表性偏倚得到了控制。
2.4 吉非替尼治疗晚期NSCLC患者疾病进展率
2.4.1 纳入研究情况(表 6) 纳入的 7项研究均为前瞻性研究,来自于亚洲者 6项,其中男性 365人,女性 468人;其中病理细胞类型为腺癌者 698人,其他细胞类型者35人;提供吸烟史的6项研究共821人,其中吸烟者272人,非吸烟者549人。
2.4.2 Meta分析结果 共纳入7项研究833人,其突变组397人,非突变组436人,经异质性检验,I2=0%,自由度为6,P=0.81,认为各项研究同质,采用固定效应模型。结果RR=0.24,95% CI(0.18~0.32)。总体效应检验,Z=10,P<0.05,差异具有统计学意义。认为吉非替尼治疗晚期 NSCLC患者突变组的疾病进展率明显低于非突变组(图5)。
2.4.3 敏感性分析 对随机效应模型与固定效应模型之间进行敏感度分析;全部入选文献与单纯的病例对照研究之间进行敏感度分析,结果见表7。
随机效应模型与固定效应模型之间进行敏感度分析,未发现明显差异。总体来讲,剔除某一单一研究,对最终结果影响不大。
2.4.4 发表性偏倚的识别 如图6所示,漏斗图基本对称,所有资料对应的点位于95% CI内,表明发表性偏倚得到了控制。
3 讨 论
本文章采用meta分析的方法,对国内外吉非替尼用于治疗 EGFR基因突变的晚期 NSCLC患者研究的有效性进行了定量分析。结果显示,吉非替尼治疗晚期NSCLC患者,EGFR基因突变者相比较于非突变者而言,疾病总有效率明显增加(RR=4.42,95%CI:3.49~5.60),疾病控制率明显增加(RR=1.79,95% CI:1.23~2.61),疾病进展率明显降低(RR=0.24,95% CI:0.18~0.32)。
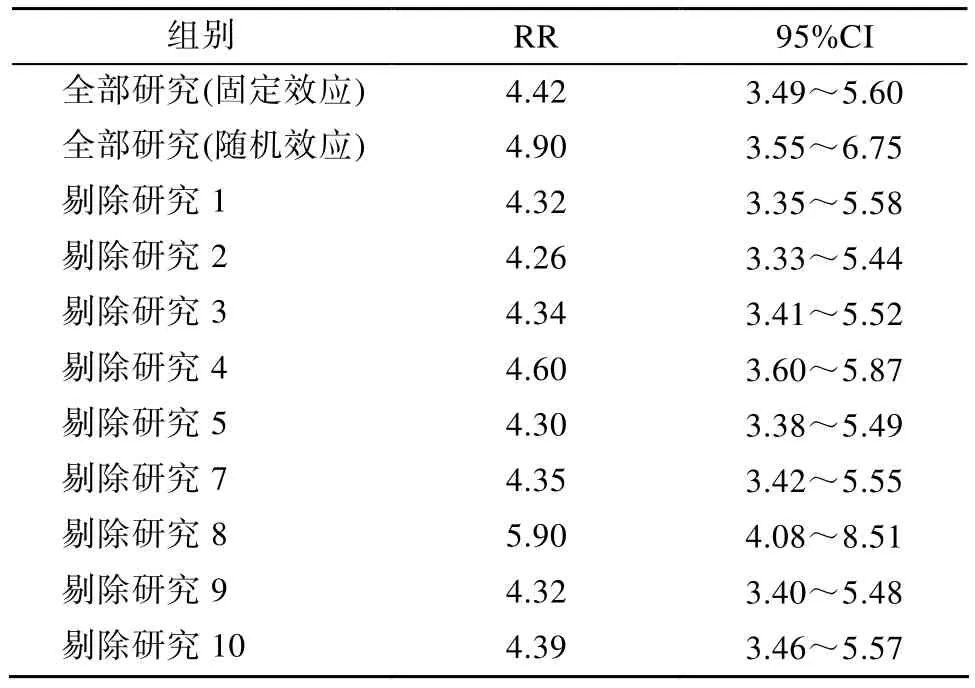
表3 突变组与非突变组疾病有效率的敏感性分析Table 3 Sensitivity analysis for efficiency of mutation group and non-mutation group

图2 突变组与非突变组疾病有效率纳入研究的漏斗图Figure 2 Funnel plot of disease efficiency of mutation group and non-mutation group

表4 吉非替尼治疗晚期NSCLC患者疾病控制率数据统计Table 4 Disease control rate of gefitinib for patients with advanced NSCLC

图3 突变组与非突变组疾病控制率的meta分析Figure 3 Meta-analysis for control rate of mutation group and non-mutation group

表5 突变组与非突变组疾病控制率的敏感性分析Table 5 Sensitivity analysis for control rate of mutation group and non-mutation group
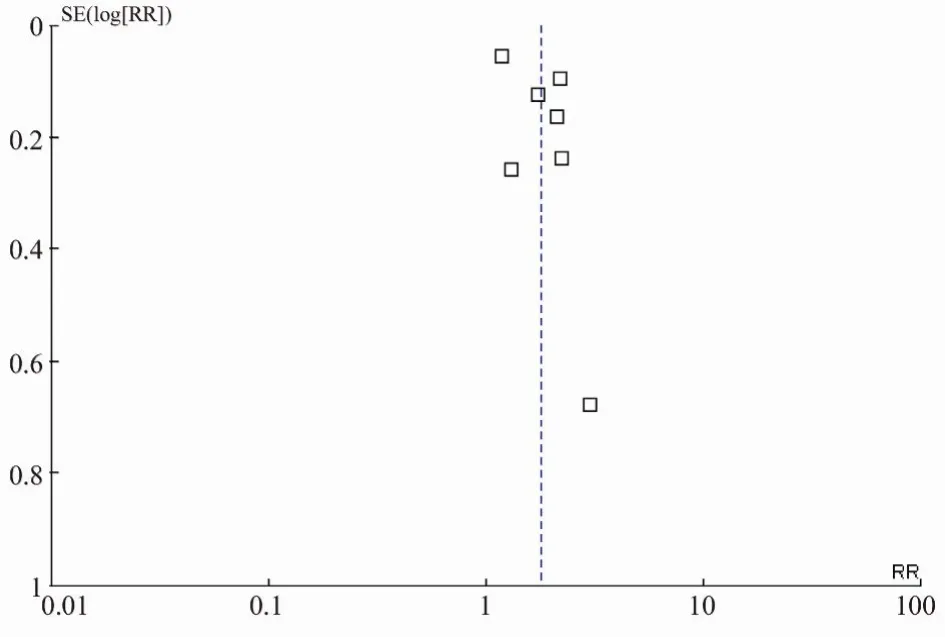
图4 突变组与非突变组疾病控制率纳入研究的漏斗图Figure 4 Funnel plot of disease control rate of mutation group and non-mutation group

表6 吉非替尼治疗晚期NSCLC患者疾病进展率数据统计Table 6 Disease progress rate of gefitinib for patients with advanced NSCLC

图5 突变组与非突变组疾病进展率的meta分析Figure 5 Meta-analysis for progress rate of mutation group and non-mutation group
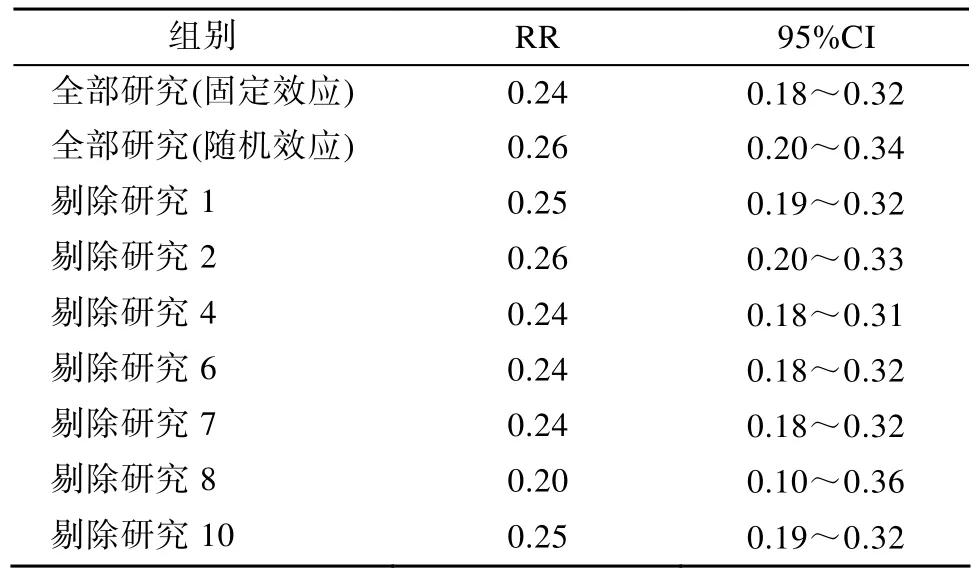
表7 突变组与非突变组疾病进展率的敏感性分析Table 7 Sensitivity analysis for progress rate of mutation group and non-mutation group
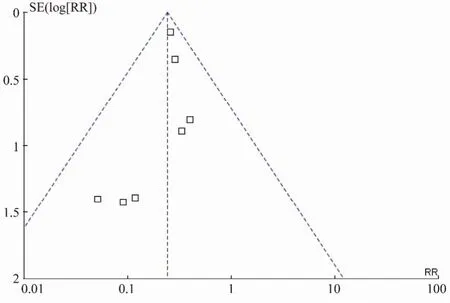
图6 突变组与非突变组疾病进展率纳入研究的漏斗图Figure 6 Funnel plot of disease progress rate of mutation group and non-mutation group
纳入的10个研究,由于受EGFR基因突变的分组条件的限制,属于非随机对照试验,故受控条件差。非英语国家具有阳性结果的研究更容易发表在在世界上主要的医学文献数据库中,检索的文章存在文献库偏倚及英语偏倚。已经有部分临床研究显示,吉非替尼对亚洲人、非吸烟者、女性和腺癌有较好的疗效,由于纳入文章的局限性,研究人群大都是亚洲人,对结果存在影响。除此之外,纳入研究的样本量较小,对结果也产生了影响。
综上所述,与非EGFR基因突变相比较而言,吉非替尼在治疗 EGFR基因突变的晚期NSCLC患者方面具有较好的优势,可作为其化疗的常规药物,但由于纳入研究的局限性,尚需要高质量试验进一步验证其长期的疗效和安全性。
[1]孙 燕, 石远凯. 临床肿瘤内科手册[M]. 北京: 人民卫生出版社, 2008: 388-424.
[2]郭继武, 马 彬, 周慧银, 等. 吉非替尼治疗非小细胞肺癌的meta分析[J]. 中国肺癌杂志, 2011, 14(4): 351-357.
[3]Paez JG, Janne PA, Lee JC,et a1. EGFR mutmions in lung cancer: correlation with clinical response to gefitinib therapy[J]. Science, 2004, 304(5676): 1497-1500.
[4]Lynch TJ, Bell DW, Sordella R,et a1. Plctivating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J].N Eng J Med, 2004, 350(21): 2129-2139.
[5]韩 宇, 徐建明, 段海青, 等. EGFR基因突变与吉非替尼治疗晚期非小细胞肺癌的疗效和预后的关系[J]. 中华肿瘤杂志, 2007, 29(4): 278-283.
[6]郭 健, 周彩存, 张 颉, 等. EGFR基因突变与EGFR酪氨酸激酶抑制剂近期疗效的关系[J]. 中国肿瘤杂志, 2007,10(6): 504-507.
[7]吕 平. 吉非替尼治疗肺腺癌预测的分子生物学研究[D].大连: 大连医科大学, 2010.
[8]Wang Z , Wu YL, Zhang GC,et al. EGFR/KRAS mutations and gefitinib theraphy in Chinese NSCLC patients[J].Onkologie, 2008, 31(4): 174-178.
[9]Okami J, Taniguchi K, Higashiyama M,et al. Prognostic factors for gefitinib-treated postoperative recurrence in non-small cell lung cancer[J]. Oncology, 2007, 72(3-4):234-242.
[10]Masago K, Fujita S, Togashi Y,et al. Clinical significance of pretreatment C-reactive protein in patients with advanced nonsquamous, non-small cell lung cancer who received gefitinib[J]. Oncology, 2010, 79(5-6): 355-362.
[11]Kimura H, Kasahara K, Shibata K,et al. EGFR mutation of tumor and serumin gefitinib-treated patients with chemotherapy-naive non-small cell lung cancer[J]. J Thorac Oncol, 2006, 1(3): 260-267.
[12]Wu JY, Shih JY, Chen KY,et al. Gefitinib therapy in patients with advanced non-small cell lung cancer with or without testing for epidermal growth factor receptor(EGFR)mutations[J]. Medicine, 2011, 90(3): 159-167.
[13]Zhang XT, Li LY, Mu XL,et al. The EGFR mutation and its correlation with response of ge fi tinib in previously treated Chinese patients with advanced non-small-cell lung cancer[J].Ann Oncol, 2005, 16(8): 1334-1342.
[14]Cortes-Funes H, Gomez C, Rosell R,et al. Epidermal growth factor receptor activating mutations in Spanish ge fi tinib-treated non-small-cell lung cancer patients[J]. Ann Oncol, 2005, 16(7): 1081-1086.

