老年冠状动脉支架植入术后患者CYP2C19基因681G>A单核苷酸多态性与氯吡格雷抵抗的相关性
梁振洋,韩雅玲,张效林,李 毅,闫承慧,刘少伟
(沈阳军区总医院心内科, 沈阳 110840)
氯吡格雷可以明显地降低急性冠脉综合征(acute coronary syndrome, ACS)和经皮冠状动脉介入(percutaneous coronary intervention, PCI)术后患者各类缺血事件的发生率[1-3],但由于个体对氯吡格雷治疗的反应性不一致,有一部分PCI术后的患者在氯吡格雷规范剂量的治疗过程中,仍发生了较为严重的血栓事件,此临床现象被称为氯吡格雷抵抗(clopidogrel resistance, CR)[4]。据国外文献报道,CR的发生率多在 4%~30%之间[5,6]。而且,CR患者的主要心脏不良事件(major adverse cardiac events,MACE)发生率可高达 40%,明显高于非CR者,在所有发生MACE的患者中,CR患者约占80%[7]。氯吡格雷本身不具有生物学活性,需经肝细胞色素P450酶系的代谢后,方能具有抑制血小板活化和聚集的生物学活性,近期研究表明,CYP2C19基因[8-14]的多态性可能是影响氯吡格雷抗血小板作用的重要因素之一。
因此,评估CYP2C19基因单核苷酸多态性与老年冠心病患者PCI术后CR发生的相关关系,可为CR的早期诊断和防治提供循证医学依据,对指导老年冠心病患者PCI术后氯吡格雷个体化用药、降低缺血事件再发风险及改善患者的远期预后,具有非常重要的意义。本研究拟通过探讨在中国汉族老年冠心病患者群中CYP2C19基因多态性与CR发生的相关关系,以期为临床早期预测及提早干预血栓事件的发生提供分子遗传学依据。
1 对象与方法
1.1 对象
2010年6月至2011年4月,本研究共连续入选614例在沈阳军区总医院心血管内科住院治疗的老年冠心病患者。入选标准为:(1)年龄≥60岁;(2)经冠状动脉造影确诊为冠心病(包括不稳定性心绞痛、非ST段抬高型心肌梗死及ST段抬高型心肌梗死);(3)接受双联标准抗栓治疗的患者,志愿参加,并签署知情同意书。排除标准为:(1)对阿司匹林或氯吡格雷过敏或不能耐受者;(2)半年内有中风或内脏出血性疾病病史者;(3)严重肝脏疾患和(或)凝血功能异常者;(4)具有抗血小板治疗禁忌证或近期拟行手术者;(5)合并其他终末期疾病者。
1.2 药物治疗方案
所有入选病例口服阿司匹林负荷量 300 mg及氯吡格雷负荷量 600 mg,血小板膜糖蛋白Ⅱb/Ⅲa受体拮抗剂、肝素及低分子肝素由医师根据临床需要应用。
1.3 血小板聚集率的测定及相关定义
所有入选病例确定已口服300 mg阿司匹林+600 mg氯吡格雷24h后,采血5~10ml,收集于含乙二胺四乙酸二钠(EDTA-Na2)的抗凝管中,30 min内送至沈阳军区总医院心血管内科实验室,测定血小板聚集率。光学比浊法测定20µmol/L ADP诱导的最大残余血小板聚集率[15](residual platelet agglutination,RPA)作为评价血小板活化的指标。以光学比浊法浓度为 20µmol/L的 ADP诱导的 RPA≥70%,定义为CR;RPA<70%则为NCR[16-19]。
1.4 人血白细胞基因组DNA提取及目的片段的扩增
采用TIANamp血液白细胞基因组DNA提取试剂盒抽提基因组DNA,引物:F:5'-CCTATGCTATCATCTCCAAA-3',R:5'-TACGCAAGCAGTCACATAAC-3',预变性 94℃4min,(变性 94℃30s-退火 54℃30s-延伸 72℃40s)共 30 个循环-终延伸 72℃7min-保存于4℃。
1.5 酶切检测rs4424285位点SNP基因型
扩增CYP2C19 681G>A单核苷酸多态位点,用内切酶SmaI (NEB公司) 于37℃酶切消化3 h后,2%琼脂糖凝胶电泳鉴定酶切产物(图1)。同时,随机选取60例PCR扩增产物以2%琼脂糖凝胶电泳检样后,送至上海生工生物公司进行焦磷酸测序复检(图2)。
1.6 统计学处理
采用SPSS 17.0软件包进行统计学分析。计量资料用±s表示,应用两样本t检验(计量资料)和χ2检验(计数资料)比较CR组和NCR组间人口学及临床资料之间差异的关联强度。基因型频率和等位基因频率在 CR组和 NCR组之间的差异用χ2检验,OR值和95%可信区间(95% CI)表示基因与氯吡格雷抵抗的关联强度。多项影响因素进行分析时,使用多元logistic回归进行校正。

图1 CYP2C19基因681G>A位点PCR产物酶切电泳结果Figure 1 Enzyme digestion of PCR products of CYP2C19 gene 681G> A locus
2 结 果
2.1 两组基线临床资料比较
614例研究对象20 µmol/L的ADP诱导的RPA≥70%的病例共有126例,即CR组为126例,其余对象为非氯吡格雷抵抗(non-clopidogrel resistance, NCR)组,共488例,CR总体发生率为20.5%。两组研究对象的基线临床资料如表1所示。两组间患者的性别、年龄、体质量指数(body mass index,BMI)等一般资料差异均无统计学意义(P>0.05)。常规实验室检查结果及临床药物治疗差异也无统计学意义(P>0.05)。
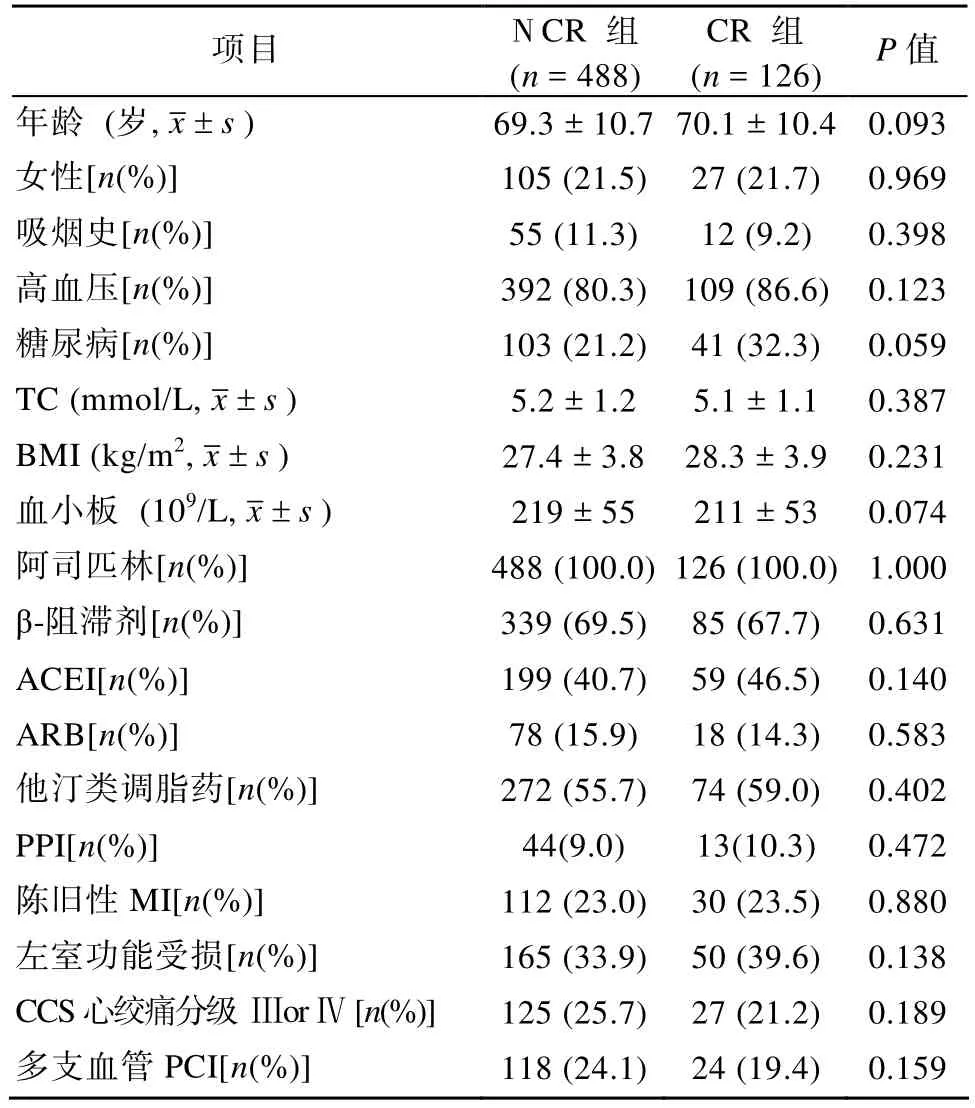
表1 研究对象的基线临床资料Table 1 Baseline demographic and clinical characteristics of the study cohort

图2 CYP2C19 681G>A基因型测序结果鉴定Figure 2 CYP2C19 681G>A polymorphism genotyping
2.2 Hardy–Weinberg平衡检验
采用χ2检验计算CYP2C19基因各标签SNP基因型的观察频率相对于理论频数的偏离后,结果显示,CYP2C19基因9个标签SNP的基因型在CR组和NCR组均符合遗传学Hardy-Weinberg平衡(P均>0.05),提示所入选的研究对象具有良好的群体代表性。
2.3 CYP2C19 681G>A等位基因及基因型在 CR组与NCR组间的分布
运用多元logistic回归校正了性别、年龄、BMI、吸烟、高血压、糖尿病、血总胆固醇、血小板计数、血肌酐、血糖、左室射血分数、他汀类调脂药、β受体阻滞剂、血管紧张素转换酶抑制剂/血管紧张素受体拮抗剂(angiotensin converting enzyme inhibitor/angiotensin receptors blocker, ACEI/ARB)、质子泵抑制剂(proton pump inhibitor, PPI)之后结果显示,CYP2C19 681G>A多态位点AA基因型及A等位基因分布频率在CR组与NCR组之间差异具有统计学意义(P=0.003,P=0.002;表2)。
3 讨 论
对于冠状动脉介入治疗术后的患者,阿司匹林与氯吡格雷联合应用的双联抗血小板治疗仍是目前抗栓治疗的基石。但在临床实际工作中,由于不同个体对抗栓治疗的反应性存在较大差异,故现行治疗指南推荐的抗栓药物治疗剂量并不适合用于所有患者。而对于发生 CR的患者,为降低血栓事件的再发风险,增加氯吡格雷剂量以及合用其他作用机制不同的抗血小板药物是目前较为被认可的方法。近年研究表明,采用上述方法可以在一定程度上改善患者对抗血小板治疗的反应性,但对于所有发生CR的患者均给予长期高维持剂量的氯吡格雷无疑会增加其经济负担及出血事件的风险,所以,理想的抗栓治疗方案应该是个体化的、有针对性的治疗。由于 CR常为多因素所导致,包括可逆性因素(治疗依从性差、药物相互作用等)以及不可逆因素(基因多态性),故而在纠正了可逆性因素后,有些CR患者会得到较明显的改善,并不需要长期高维持剂量的服用氯吡格雷。但对于存在不可逆因素的血栓高危患者,酌情给予个体化的高维持剂量的抗栓治疗是有必要的。此外,由于冠心病的老龄化趋势,老年患者日益增多,强化抗栓治疗不但加重其经济负担,其出血风险较年轻患者亦明显增加,因此,在中国汉族老年人群中大样本、系统地探讨CYP2C19基因多态性对氯吡格雷疗效的影响,具有较为重要的临床意义。
CYP2C19基因位于染色体10q24.1-q24.3,全长约90.2kb,9个外显子,含有38个SNP位点。Mega等[11]的研究证实 CYP2C19基因 681G>A位点多态性可能使氯吡格雷抗血小板聚集的疗效降低,并间接提示了 CYP2C19基因多态性可能影响了相关肝酶的活性,继而对氯吡格雷的生物学代谢产生了作用。Mega等进一步研究证实[20],携带CYP2C19基因681G>A位点A等位基因的患者接受225 mg/d氯吡格雷的维持剂量,方可以达到非携带者 75 mg/d氯吡格雷的相近的血小板抑制率,而携带AA型纯合子的患者即使每天接受高达 300 mg氯吡格雷的维持剂量仍然不能达到理想的血小板抑制率。上述研究对象均为高加索人群,在亚洲人种中CYP2C19编码的酶蛋白里,CYP2C19基因681G>A位点的突变亦可导致酶蛋白的功能缺陷,其突变型纯合子氯吡格雷疗效低反应的发生率约 13%~23%[21],且明显高于高加索人种的 1%~3%。在我们的研究中,所有入选的病例均为中国汉族老年冠心病患者,在治疗期间所给予的治疗方案均为严格遵循治疗指南所进行,故而可能影响氯吡格雷疗效的可逆性因素(治疗依从性差、药物相互作用等)已尽量降至最低,我们的研究结果发现在中国汉族老年冠心病患者中,CR的发生率为20.5%,携带CYP2C19基因681G>A单核苷酸多态位点A等位基因的患者发生CR的风险明显高于非携带者(OR=1.85, 95% CI:1.392~2.459,P= 0.002)。而携带AA型纯合子的患者,发生 CR的风险较其他患者(GG型纯合子及GA型杂合子)高约3倍(OR=3.03, 95% CI: 1.889~5.784,P= 0.003)。本研究通过较大样本的关联研究的分析,首次初步阐明了中国老年冠心病患者 CR发生与CYP2C19基因单核苷酸多态性的相关关系。

表2 CYP2C19 681G>A等位基因及基因型在CR及NCR两组间的分布Table 2 CYP2C19 681G>A allele and genotype between CR and NCR groups [n(%)]
在本研究中,我们将PPI纳为研究因素之一,但在CR及NCR两组间未发现明显差异,即PPI与CR的发生无明显相关关系。当前学术界对于 PPI是否增加 CR的发生风险,尚无定论,多个临床大型试验[22-24]亦得出了不相一致的结论,该问题还需要进行深入探讨和研究。同时,我们的研究是回顾性分析,故不能排除标本选择或其他可能因素通过肝脏对氯吡格雷的代谢产生影响,还需要进行一项注册的前瞻性研究及功能学方面实验,进一步地深入研究与探讨。
目前多数大型医院已开展多种测定血小板聚集功能的方法,检测CYP2C19基因的芯片也已开始应用于临床检验,相信通过更为广泛地开展血小板聚集功能的测定及应用药物遗传学分析方法,必会使心血管病患者的抗血小板治疗更为个体化,使其疗效更为确切。相信在不久的将来,由基因导向的个体化药物治疗必会在临床实践中起到关键性的作用,造福于血栓性疾病的患者。
[1]Gerschutz GP, Bhatt DL. The Clopidogrel in Unstable Angina to Prevent Recurrent Events (CURE) study: to what extent should the results be generalizable[J]? Am Heart J,2003, 145(4): 595-601.
[2]Steinhubl SR, Berger PB, Mann JT 3rd,et al. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial[J]. JAMA, 2002, 288(19): 2411-2420.
[3]A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee[J]. Lancet, 1996, 348(9038): 1329-1339.
[4]Nguyen TA, Diodati JG, Pharand C. Resistance to clopidogrel: a review of the evidence [J]. J Am Coll Cardiol,2005, 45(8): 1157-1164.
[5]Gurbel PA, Bliden KP, Hiatt BL,et al. Clopidogrel for coronary stenting: response variability, drug resistance, and the effect of pretreatment platelet reactivity[J]. Circulation,2003, 107(23): 2908-2913.
[6]Jaremo P, Lindahl TL, Fransson SG,et al. Individual variations of platelet inhibition after loading doses of clopidogrel[J]. J Intern Med, 2002, 252(3): 233-238.
[7]Lev EI, Patel RT, Maresh KJ,et al. Aspirin and clopidogrel drug response in patients undergoing percutaneous coronary intervention: the role of dual drug resistance[J]. J Am Coll Cardiol, 2006, 47(1): 27-33.
[8]Taubert D, Bouman HJ, van Werkum JW. Cytochrome P-450 polymorphisms and response to clopidogrel[J]. N Engl J Med, 2009, 360(21): 2249-2250.
[9]Sibbing D, Stegherr J, Latz W,et al. Cytochrome P450 2C19 loss-of-function polymorphism and stent thrombosis following percutaneous coronary intervention[J]. Eur Heart J,2009, 30(8): 916-922.
[10]Ramaraj R. Cytochrome P450 2C19 polymorphism and clopidogrel after MI[J]. Lancet, 2009, 373(9670): 1172-1173.
[11]Mega JL, Close SL, Wiviott SD,et al. Cytochrome P450 genetic polymorphisms and the response to prasugrel:relationship to pharmacokinetic, pharmacodynamic, and clinical outcomes [J]. Circulation, 2009, 119(19): 2553-2560.
[12]Collet JP, Hulot JS, Pena A,et al. Cytochrome P450 2C19 polymorphism in young patients treated with clopidogrel after myocardial infarction: a cohort study[J]. Lancet, 2009,373(9660): 309-317.
[13]Trenk D, Hochholzer W, Fromm MF,et al. Cytochrome P450 2C19 681G>A polymorphism and high on-clopidogrel platelet reactivity associated with adverse 1-year clinical outcome of elective percutaneous coronary intervention with drug-eluting or bare-metal stents[J]. J Am Coll Cardiol, 2008,51(20): 1925-1934.
[14]Malek LA, Kisiel B, Spiewak M,et al. Coexisting polymorphisms of P2Y12 and CYP2C19 genes as a risk factor for persistent platelet activation with clopidogrel[J].Circ J, 2008, 72(7): 1165-1169.
[15]Efeoglu C, Akcay YD, Erturk S. A modified method for preparing platelet-rich plasma: an experimental study[J]. J Oral Maxillofac Surg, 2004, 62(11): 1403-1407.
[16]Cuisset T, Frere C, Quilici J,et al. High post-treatment platelet reactivity is associated with a high incidence of myonecrosis after stenting for non-ST elevation acute coronary syndromes[J]. Thromb Haemost, 2007, 97(2):282-287.
[17]Cuisset T, Frere C, Quilici J,et al. High post-treatment platelet reactivity identified low-responders to dual antiplatelet therapy at increased risk of recurrent cardiovascular events after stenting for acute coronary syndrome[J]. J Thromb Haemost, 2006, 4(3): 542-549.
[18]Frere C, Cuisset T, Morange PE,et al. Effect of cytochrome p450 polymorphisms on platelet reactivity after treatment with clopidogrel in acute coronary syndrome[J]. Am J Cardiol, 2008, 101(8): 1088-1093.
[19]Buonamici P, Marcucci R, Migliorini A,et al. Impact of platelet reactivity after clopidogrel administration on drug-eluting stent thrombosis[J]. J Am Coll Cardiol, 2007,49(24): 2312-2317.
[20]Mega JL, Hochholzer W, Frelinger AL,et al. Dosing clopidogrel based on CYP2C19 genotype and the effect on platelet reactivity in patients with stable cardiovascular disease[J]. JAMA, 2011, 306(20): 2221-2228.
[21]Lee JM, Park S, Shin DJ,et al. Relation of genetic polymorphisms in the cytochrome P450 gene with clopidogrel resistance after drug-eluting stent implantation in Koreans[J]. Am J Cardiol, 2009, 104(1): 46-51.
[22]Calderon Hernanz B, Pinteno Blanco M, Puigventos Latorre F,et al. Controversy regarding the concomitant use of clopidogrel and proton pump inhibitors (PPI)[J]. Farm Hosp,2009, 33(6): 339-340.
[23]Kenngott S, Olze R, Kollmer M,et al. Clopidogrel and proton pump inhibitor (PPI) interaction: separate intake and a non-omeprazole PPI the solution[J]? Eur J Med Res, 2010,15(5): 220-224.
[24]Sada S, Costantino G. The prophylactic use of a proton pump inhibitor (PPI) in patients treated with clopidogrel and aspirin for an acute coronary syndrome or placement of a coronary stent reduces the rate of upper gastrointestinal bleeding with no apparent increase in cardiovascular events[J]. Intern Emerg Med, 2011, 6(2): 159-160.

