一株产纤维素酶细菌的分离鉴定及其酶学特性研究*
邓先余,邹谋勇,黄志坚,易 俗,
(1.湖南科技大学生命科学学院,湖南 湘潭 411201;2.中山大学生命科学学院,广东 广州 510275)
纤维素是地球上光合作用产量最高的多糖,它是由葡萄糖以β-1,4糖苷键连接而成的线状大分子物质[1-2]。据报道,纤维素全球年产量为1.5×106万t。高效纤维素酶的研究开发是可再生性资源利用的关键,对解决工农业原料、能源、环境等问题十分重要[3-4]。纤维素酶是使纤维素降解生成葡萄糖的一组酶的总称,主要包括 C1酶、CX酶和β-葡萄糖苷酶,它是降解植物纤维素酶的关键酶类[5]。
目前研究较多的是霉菌,其中木霉、青霉、曲霉和根霉均具有较强的酶活力,尤以绿色木霉、里氏木霉和康氏木霉为典型[6-7];而对细菌的研究很少有报道。由细菌所产生的纤维素酶一般最适 pH为中性至偏碱性。近年来,随着中性纤维素酶和碱性纤维素酶在棉织品水洗整理工艺及洗涤剂工业中的成功应用,细菌纤维素酶制剂已显示出良好的应用前景[8]。近年来,国内外学者在产纤维素酶细菌的筛选、工程菌构建方面做了大量的工作,筛选到了多种产纤维素酶细菌。徐庆强等[9]从海洋环境中选到的产碱性纤维素酶菌株 QM11,经分子鉴定为噬纤维菌属细菌Cytophagafucicola。吕静琳等[10]对从腐烂朽木及其附近土壤中分离筛选到一株蜡状芽孢杆菌。并对其发酵条件进行了优化。Cantwell B A等[11]克隆了枯草芽孢杆菌的β-葡萄糖苷酶基因,并在大肠杆菌中进行了表达。Kotchoni OS等[12]对短小芽胞杆菌Bacilluspumilus进行了产纤维素酶研究,认为B.pumilus是一种抗分解代谢物抑制的良好菌株。
本文报道了一株产纤维素酶细菌筛选与鉴定,并对该菌株生长、产酶特性和所产纤维素酶的酶学性质进行了初步研究。
1 材料与方法
1.1 材料
1.1.1 样品 湖南科技大学校园腐烂木芙蓉根部土壤。
1.1.2 培养基 有机氮分离培养基:羧甲基纤维素钠CMC-Na 10 g;胰蛋白胨 5 g;KH2PO41.5 g;MgSO4·7H2O 0.2 g;CaCl20.3 g;NaCl 5 g;小牛浸膏 2.0 g;琼脂粉 15 g;蒸馏水1 000 mL;PH 7.0。
无机氮分离培养基:CMC-Na 10 g;(NH4)2SO42 g;KH2PO41.5 g;MgSO4·7H2O 0.2 g;CaCl20.3 g;NaCl 5 g;小牛浸膏 2.0 g;琼脂粉 15 g;蒸馏水1 000 mL;PH 7.0。
有机氮发酵培养基:(CMC-Na)8 g;葡萄糖 2 g;胰蛋白胨 5 g;KH2PO41.5 g;MgSO4·7H2O 0.2 g;CaCl20.3 g;NaCl 5 g;小牛浸膏 2.0 g;蒸馏水1 000 mL;PH 7.0。
无机氮发酵培养基:CMC-Na 8 g;葡萄糖2 g;(NH4)2SO42 g;KH2PO41.5 g;MgSO4·7H2O 0.2 g;CaCl20.3 g;NaCl 5 g;小牛浸膏 2.0 g;蒸馏水1 000 mL;PH 7.0。
1.1.3 试剂 刚果红,2,4-二硝基水杨酸(DNS),葡萄糖等常规试剂均为国产分析纯。CTAB、溶菌酶、蛋白酶K、SDS等均购自Sigma公司。Taq酶、PCR产物回收试剂盒购自上海生工,PCR引物由上海生工合成。Tiangen细菌基因组总DNA提取试剂盒购自天根生化科技(北京)有限公司。
1.2 方法
1.2.1 样品预处理 取采集到的土壤样品5 g 于一个灭菌的洁净三角瓶,加已灭菌的w=7.5% NaCl溶液10 mL,充分振荡后,37 ℃,180 r/min摇床振荡培养1 h。取500 μL培养液于1.5 mL EP管中,2 000 r/min离心5 min,取上清4 ℃冷藏待用。
1.2.2 目标菌株的分离与筛选 取上述上清液200 μL分别涂布于有机氮分离培养基,同时以无碳培养基作为对照,37 ℃培养24 h,挑取生长状况较好的菌落进一步划线培养。重复划线数次后,用w=0.1%刚果红溶液染色5 min,1 mol/L NaCl溶液洗涤,自来水洗涤至洗出液无色。选取水解圈较大的菌株,并命名为CXB001,接种至有机氮分离培养基斜面,37 ℃培养36 h 后4 ℃冷藏保种。
1.2.3 菌落形态观察与镜检 取CXB001斜面菌种,分别接种于有机氮分离培养基和无机氮分离培养基,37 ℃培养24 h后,观察并记录菌落生长状况和菌落形态。挑取少量菌体进行芽孢染色,并与油镜下观察并记录菌体形态。然后同上法进行刚果红染色,比较水解圈的大小。
1.2.4 生理生化测试 参考东秀珠[13]等《常见细菌系统鉴定手册》对CXB001菌株进行生理生化测试。
1.2.5 CXB001总DNA的提取 采用天根细菌基因组总DNA提取试剂盒提取CXB001菌株总DNA。作为CXB001 16S rDNA PCR扩增的模板。
1.2.6 16S rDNA 的PCR扩增与测序 以提取的总CXB001的基因组总DNA为底物,以F: 5′-AGAGTTTGATCCTGGTCAGAACGAACG-3′为正向引物,R: 5′-TACGG- CTACCTTGTTACGACTTCACCC -3′为反向引物对CXB001菌株进行16S rDNA进行扩增。PCR扩增反应体系为:底物DNA 模板1 μL(约10 ng),DNA聚合酶 Taq 酶1.5 单位,引物F 和R 各1 μL(约25 pmol/L),dNTP:5 mol/L dNTP 2 μL,buffer:10×缓冲液(含15 mol/L MgCl2) 5 μL,去离子水:加ddH2O 至50 μL。扩增反应程序: 94 ℃ 5 min,然后94 ℃ 1 min,55 ℃ 45 S,72 ℃ 1.5 min 共30 个循环,再72 ℃ 10 min。反应完毕分别取6 μL 进行w=0.8%琼脂糖凝胶电泳,凝胶成像系统下分析结果。PCR 扩增产物经DNA纯化试剂盒(上海生工公司)纯化后,直接送南京金斯瑞生物科技有限公司进行DNA 测序。
1.2.7 CXB001分子系统进化树的构建 利用BLAST 在线同源性查询软件查询所测菌株CX001的16S rDNA 序列的属性,将其与从GenBank 数据库中获得的芽孢杆菌属细菌及其他亲缘关系相近的属种的16S rDNA,采用Clustal W1.8 软件进行多序列匹配排列(Multiple Alignments),用系统发生推断软件包MEGA 3.1 进行系统发育分析。在Kimura-2-parameter模型的基础上,用Neighbor-joining 法构建分子系统树,自举分析(Bootstrap)1 000 次重复检测分子系统树的置信度,缺失和不确定的位点在计算中被省略。
1.2.8 PH 耐受性实验 将CXB001斜面菌种分别接种于pH值梯度为5.0,6.0,7.0,8.0,9.0,10.0,11.0,12.0的无机氮发酵培养基中,37 ℃,180 r/min摇床培养5 d,取菌液于650 nm处测定吸光度。间接反映菌株的pH耐受性。并取初酶液测CMC酶活力。
1.2.9 温度耐受性实验 将CXB001斜面菌种分别接种无机氮发酵培养基中,于温度梯度为28,31,34,37,41 ℃下180 r/min摇床培养5 d,取菌液650 nm处测定吸光度。间接反映菌株的温度耐受性。并取初酶液测CMC酶活力。
1.2.10 酶学特性分析
1) 制作葡萄糖标准曲线:取10 支20 mL 具塞刻度试管,并编号,按表1 分别加入质量浓度为1 mg/mL的葡萄糖标准液、蒸馏水和3,5-二硝基水杨酸(DNS)试剂,配成不同葡萄糖含量的反应液。

表1 葡萄糖标准曲线制作参数
将各管摇匀,在沸水浴中准确加热5 min,取出,冷却至室温,用蒸馏水定容至20 mL,加塞后颠倒混匀,在分光光度计上进行比色。调波长540 nm,用0号管调零点,测出1- 6号管的光密度值。以光密度值为纵坐标,葡萄糖质量浓度为横坐标,绘出标准曲线。结果如图1所示。
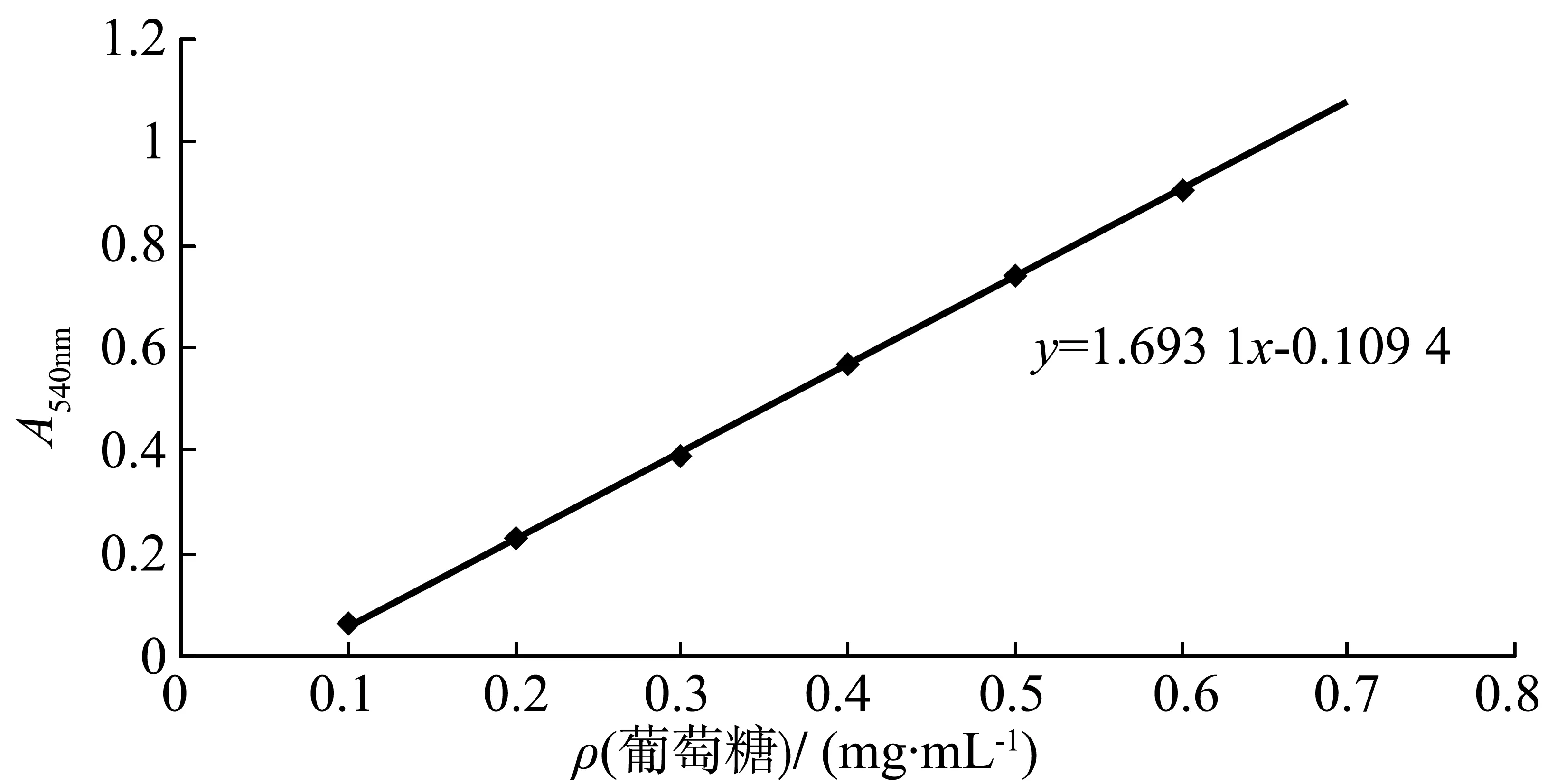
图1 葡萄糖标准曲线
2) CMC酶活的测定[14-15]:每个菌株取4 mL 发酵液,6 000 r/min 离心10 min,取上清液则为粗酶液。在25 mL 刻度试管中先加入1.5 mLw=1%CMC 溶液,再加入0.5 mL粗酶液,摇匀。灭活对照,在25 mL刻度试管中加入1.5 mLw=1%CMC-Na 溶液。再加入0.5 mL灭活的粗酶液(将粗酶液在沸水浴中加热5 min制得),摇匀。样品与灭活对照同时放入(50 ±1) ℃水浴中保温反应1 h 后,立即加入1.5 mL DNS 试剂。之后将各样品及空白对照同时放入沸水浴中反应5 min,取出后立即置于冰水中冷却至室温。酶活力单位的定义: 在一定的反应条件下( pH 值、温度),每小时由底物生成1 μmol葡萄糖所需的酶量定义为1个酶活力单位(U) 。通过研究不同pH值、温度条件及金属离子对酶活的影响,对该菌产的CMC酶学性质进行分析。
3) 酶活计算公式:酶活性[U/(μmol·h)]= 1 000nC/MT式中,C为反应后待测液中的葡萄糖含量(mg);M为葡萄糖的摩尔质量(180 g/mol);n为酶液的稀释倍数;T为水解时间(1 h)。
3 结 果
3.1 CXB001生理生化特性
常规生理生化测试表明,菌株CXB001为革兰氏阳性,具芽孢。菌落为米白色,边缘不光滑且不完整,表面有皱褶,菌落不透明。好氧,化能异养。接触酶阳性,V-P测定为阳性,还原硝酸盐。能水解明胶、淀粉,能利用柠檬酸盐、丙酸盐。利用葡萄糖、阿拉伯糖、木糖、甘露醇产酸。w=7% NaCl,40 ℃正常生长。根据这些特征,初步判断该株菌为芽孢杆菌属Bacillus细菌。
3.2 CXB001 16S rDNA测序结果与系统进化树构建
为进一步确定居住CXB001的分类地位,测定了其16S rDNA 序列,所获得的16S rDNA 序列长度为1 423 bp。图2列出了CXB001的16S rDNA序列。
图2 CXB001菌株的16S rDNA 序列
Fig.2 The sequence of 16S rDNA of strain CXB001
将CXB001 16S rDNA在NCBI中进行同源性检索,发现CXB001与芽孢杆菌属16S rDNA序列自然聚类。在相似性最高的100个序列中芽孢杆菌占95%,CXB001与它们的同源性为99%~100%;从100个序列中挑取7个已经鉴定到种的菌株的的16S rDNA进行分子系统发育树分析,结果如图3所示。CXB001与Bacillusvelezensis聚成一枝,两者的遗传距离为0.000 17。序列相似性99.9%。
图3 菌株CXB001的16S rDNA 系统进化树分析结果
Fig.3 The molecular phylogenetic tree of CX001 based on 16S rDNA sequence
(图中括弧中的序列号为对应菌种的在NCBI中16S rDNA的登录号)
3.3 培养条件对CXB001生长速率和产酶量的影响
3.3.1 发酵时间对CXB001生长速率和产酶量的影响 在接种后12,24,36,48,60,72,84,96,108,120,132,144 h测定菌液650 nm吸光度和粗酶液的CMC酶活力,结果如图4所示。可知培养120 h后CXB001生长速率增加,生长产酶量达到3.423 U/mL,为纤维素酶的最佳收获期。
3.3.2 初始pH对CXB001生长速率和产酶量的影响 分别在初始pH 5.0,6.0,7.0,8.0,9.0,10.0,11.0,12.0的无机氮发酵培养基中培养5 d,测定菌液650 nm吸光度和粗酶液的CMC酶活,结果如图5所示。表明CXB001在pH 6.0~9.0产酶量较高,在pH 5.0~11.0均能生长,最适生长pH 为7.0。
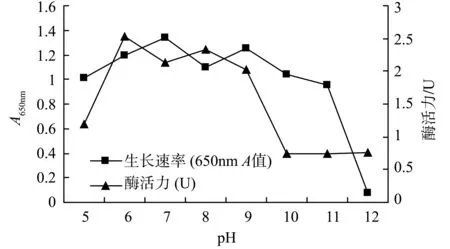
图5 初始pH对CXB001生长和产酶的影响
3.3.3 温度对CXB001生长速率和产酶量的影响
在28,31,34,37,40,43 ℃下,培养5 d测定菌液650 nm吸光度和粗酶液的CMC酶活,结果如图6所示。表明CXB001在34~40 ℃具有较高产酶量,最高达到最适生长温度为34~37 ℃,随着温度升高产酶量和生长速率均受到抑制。

图6 温度对CXB001生长和产酶的影响
3.3.4 盐度对CXB001生长速率和产酶量的影响
分别在盐度为0.5%,1.0%,1.5%,2.0%,2.5%,3.0%,3.5%,4.0%,4.5%,5.0%,5.5%,6.0%,6.5%,7.0%,10.0%的无机氮发酵培养基中培养5 d,测定菌液650 nm吸光度和粗酶液的CMC酶活,结果如图7 所示。表明CXB001在1.5%~3.5%NaCl条件下产酶量较高,NaCl浓度大于4.0%时产酶量急剧降低;1.5%~6.0% NaCl 条件下生长速率稳定,即CXB001具有较高的耐盐能力。
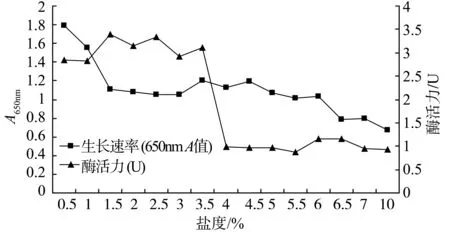
图7 盐度对CXB001生长和产酶的影响
3.4 酶学特性分析
3.4.1 pH对纤维素酶活力和稳定性的影响 分别在pH 3.0,4.0,5.0,6.0,7.0,8.0,9.0,1% CMC溶液中测定初酶液的CMC酶活力;将初酶液分别置于pH 3.0,4.0,5.0,6.0,7.0,8.0,9.0的柠檬酸-磷酸氢二钠缓冲液中,1 h后测定CMC酶活力。结果如图8所示。表明CXB001所产的纤维素酶的最适pH在5.0左右,在pH 5.0 ~7.0具有较高稳定性。
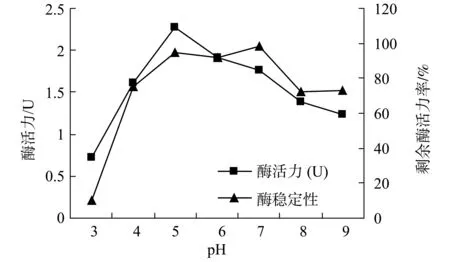
图8 pH对纤维素酶活力和稳定性的影响
3.4.2 温度对纤维素酶活力和稳定性的影响 分别在20,30,40,50,60,70,80 ℃下,测定初酶液的CMC酶活力;将初酶液分别置于20,30,40,50,60,70,80 ℃水浴锅中,1 h后测定CMC酶活力。结果如图9示。表明在50 ℃左右为酶的最适温度,在低温时该酶具有较高稳定性,随着温度的升高酶的稳定性逐渐降低。
3.4.3 金属离子对纤维素酶活力的影响 在纤维素酶反应底物中分别添加Fe2+,Ca2+,K+,Co2+,Mg2+,测定CMC酶活力,结果如图10所示。表明Co2+对CXB001所产纤维素酶具有激活作用,K+和Ca2+对CXB001所产纤维素酶作用不显著,Fe2+和Mg2+对CXB001所产纤维素酶具有抑制作用。
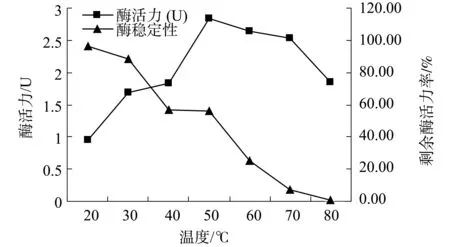
图9 温度对纤维素酶活力和稳定性的影响

图10 金属离子对纤维素酶活力的影响
4 讨 论
纤维素酶是当今微生物界和酶学界的一个研究热点,近年来,科学家们非常注重高产纤维素酶菌种分离筛选。目前主要的研究方向为霉菌,其中木霉、青霉、曲霉和根霉均具有较强的产纤维素酶能力,尤以绿色木霉、里氏木霉和康氏木霉更为突出。Mathesh 等[16]对6种木霉进行了发酵产酶研究,发现Trichodrmacitrinoviride为最高效的纤维素酶产生菌株。Qin等[17]从土壤中分离了一株高产纤维素酶真菌Fusariumchlamydosprum,对其进行了分子鉴定和酶学特性研究。目前对其纤维素酶系统研究的比较多的人工分离纯化的能降解纤维素的细菌主要有瘤胃厌氧细菌白色瘤胃球菌Ruminococcusalbus、产琥珀酸丝状杆菌Fibrobactersuccinogenes、堆肥厌氧细菌热纤梭菌Clostridiumthermocellum、解纤维梭菌Clostridiumcellulolyticum、土壤好氧细菌粪肥纤维单胞菌Cellulomonasfimi、混合纤维弧菌Cellvibriomixtus[18- 21]、蜡状芽孢杆菌[10]等,在国内,枯草芽孢杆菌[22],噬纤维菌属[9]等均有大量报道。
本文从湖南科技大学校园腐烂木芙蓉根部土壤中分离了一株产纤维素酶菌株CXB001,该菌株能以CMC-Na为唯一碳源和能源生长,刚果红染色后有明显的透明圈。常规生理生化测试结果表明菌株CXB001为革兰氏阳性,芽孢椭圆。菌落为米白色,边缘不光滑且不完整,表面有皱褶,菌落不透明。好氧,化能异养。接触酶阳性,V-P测定为阳性。还原硝酸盐。能水解明胶、淀粉,能利用柠檬酸盐、丙酸盐。利用葡萄糖、阿拉伯糖、木糖、甘露醇产酸。w=7% NaCl,40 ℃正常生长。根据这些特征,与芽孢杆菌属Bacillus细菌的表型特性相似。从16S rDNA序列的相似性和分子系统进化树上看,CXB001与B.velezensis聚成一分枝,具有较高(99.9%)的序列同源性,表明CXB001与B.velezensis的亲缘关系最为接近。综上所述,从生理生化、16S rDNA基因序列同源性、系统发育树等方面分析,菌株CXB001可鉴定为B.velezensis。
目前针对B.velezensis的研究主要是将其作为生物防治的益生菌资源[23-25]。王伟等[23]发现B.velezensis对于番茄灰霉病具有一定的拮抗作用。王世英等[24]以健康仔猪的粪便为试样,获得了对腹泻病原菌有拮抗作用的益生菌B.velezensis。田祖光[25]从棉花根际土壤中分离到了一株对大丽轮枝菌有拮抗活性的菌株,将其鉴定为B.velezensis,并对其进行了培养条件优化。Amit Bafana等[26]报道了一株B.velezensis具有解Direct Red 28 (DR28)的能力,并分离了其偶氮还原酶(60 000),研究了其对偶氮染料的解毒能力。Liu等[27]从海洋环境中分离了一株B.velezensis,发现其具有生物表面活性和广泛的抗菌特性,其表面活性可以产生生物乳化剂。国内外对于B.velezensis产纤维素酶活力的研究较少报道,仅有金迪等[28]从吉首旗帜山松树林土壤中分离获得1株高活性纤维素降解细菌B.velezensis;对其产酶条件研究表明:产酶产纤维素酶最佳培养温度、最适初始 pH和培养时间分别为 28 ℃,7.0~7 .5和32 h。
对CXB001菌株的生物特性研究表明,其最适生长温度为37 ℃,在10~50 ℃,pH 5.0~ 11.0;w为1.5% ~6.0% NaCl 条件下中均能生长,可知 CXB001具有较高温度适应性,较强的耐酸碱和耐盐能力。在pH 6.0~9.0,34~40 ℃,w为1.5%~3.5% NaCl 的培养条件下,最适产纤维素酶。CXB001所产纤维素酶最适反应温度为50 ℃,最适反应pH为5.0,可知该酶为中温酸性酶;在20 ℃、pH 5.0~7.0具有较好的稳定性。Co2+对纤维素酶具有激活作用,Mg2+,Fe2+对纤维素酶具有抑制作用。CXB001菌株在没有进行发酵条件优化时,最高酶活力达到3.42 U/mL,是进行诱变育种、纤维素酶基因克隆的良好出发菌株,有望被改良构建成为高效产纤维素酶的工程菌株。
致谢:湖南科技大学生命科学学院的周定港、王立立、杨惠、欧俊、吕芳彪等同学在实验过程中给予帮助,在此表示感谢。
参考文献:
[1]ROSANNE M.Measurement of saccharification by cellulase[J].Enzyme Microb Technol,1985,7:586.
[2]PETER M,ZARNEA G,ADRINA P,et al .Biodegradation and bioconversion of cellulose wastes using bacterial and fungalcells immobilized hydrogels[J].Resources,Conservation and Recycling,1999,27 (5): 309-332.
[3]ZENG R Y,XIONG P J,WEN J J.Characterization and gene cloning of a cold-active cellulase froma deep-sea psychrotrophic bacteriumPseudoalteromonassp.DY3[J].Extremophiles,2006,10: 79-82.
[4]陈亮,迟乃玉,张庆芳.低温纤维素酶菌株 CNY086 选育及发酵培养基优化[J].微生物学通报,2009,36(10): 1547-1552.
[5]兰时乐,李立恒,王晶,等.微波诱变结合化学诱变选育纤维素酶高产菌的研究[J].微生物学杂志,2007,27(1): 22-25.
[6]魏雅琴,李红玉.纤维素高产菌选育研究进展及未来趋势[J].兰州大学学报:自然科学版,2008,44 (7): 107-114.
[7]林远声,列璞怡.降解纤维素的真菌分离、筛选及其酶活测定[J].中山大学学报:自然科学版,2004,43 (Suppl .): 82-85.
[8]赵新刚.洗涤用碱性纤维素酶及其产生菌的分离方法[J].微生物学通报,1999,26 (1): 63-65
[9]徐庆强,张志明,王延明,等.产碱性纤维素酶海洋细菌的筛选、鉴定及酶学性质研究[J].海洋科学,2009,33(7): 1-5.
[10]吕静琳,黄爱玲,郑蓉,等.一株产纤维素酶细菌的筛选、鉴定及产酶条件优化[J].生物技术,2009,19 (6): 26-29.
[11]CANTWELL B A,McCONNELL D J.Molecular cloning and expression of aBacillussubtilisβ-glucanase gene inEscherichiacoli[J].Gene,1983,23(2): 211-219.
[12]KOTCHONI O S,SHONUKAN O O,GACHOMO W E.BacilluspumilusBpCRI 6,a promising candidate for cellulase production under conditions of catabolite repression[J].Afr J Biotechnol,2003,2:140-146.
[13]东秀珠,蔡妙英.常见细菌鉴定手册[M].北京:科学出版社,2001,62- 63.
[14]朱建良,邱晔平,陈晓晔,等.1株产纤维素酶真菌的鉴定及其酶学性质初探[J].安徽农业科学,2008,36(21): 9044-9046,9102.
[15]王晓芳,徐旭士,吴敏,等.一株纤维素分解菌的分离与筛选[J].生物技术,2001,11(2): 27-30.
[16]MATHESH C,ALOK K,PRADEEP K,et al.Cellulase production by sixTrichodrmaspp.Fermented on medincinal plant processings[J].J Ind Microbiol Biotechnol,2009,36: 605-609.
[17]QIN Y L,HE H Y,LI N,et al.Isolation and characterization of a thermostablecellulase-producing Fusarium chlamydosporum[J].World J Microbiol Biotechnol,2010,online.
[18]TOMM E P,WARREN R A J,GILKESEN R.Cellulose hydrolysis by bacteria and fungi[J].Adv Microbiol Physiol,1995,37: 1-811.
[19]LESCHINE S B.Cellulose degradation in anaerobic environments [J] .Annu Rev Microbiol,1995,49: 399-4261.
[20]BHA T,BHA T S.Cellulose degrading enzymes and their potential industrial applications [J].Biotechnology Advances,1997,15: 583-6201.
[21]刘永生,冯家勋,段承杰,等.能降解天然纤维素的地衣芽孢杆菌 GXN151 的分离鉴定及其一个纤维素酶基因 (cel5A) 的克隆和测序分析[J].广西农业生物科学,2003,22(2): 132- 138.
[22]单春乔,曲恩玉,秦淑杰,等.产木聚糖酶,纤维素酶芽孢菌的分离、筛选及鉴定[C].第十三次全国环境微生物学学术研讨会会议论文集,2010:1514-1518.
[23]王伟,李术娜,李红亚.番茄灰霉病拮抗细菌的筛选与X-75菌株鉴定[J].园艺学报,2010,7(2):307-312.
[24]王世英,李佳,王增利,等.猪源抗腹泻芽孢益生菌的分离与Z-27 菌株的鉴定[J].湖北农业科学,2009,48(5): 1200-1203.
[25]田祖光.棉花黄萎病拮抗细菌12-34菌株的分离鉴定及抗菌蛋白纯化[D].保定:河北农业大学,2009.
[26]AMIT B,TAPAN C,SIVANESAN S D.Azoreductase and dye detoxification activities ofBacillusvelezensisstrain AB[J].Appl Microbiol Biotechnol,2008,77: 1139-1144.
[27]LIU X Y,REN B,CHEN M,et al.Production and characterization of a group of bioemulsifiersfrom the marineBacillusvelezensisstrain H3[J].Appl Microbiol Biotechnol,2010,online.
[28]金迪,彭清静,易浪波,等.一株纤维素降解细菌的筛选、鉴定及产酶条件分析[J].中国微生态学杂志,2010,22 (4) : 289-295.

