盐酸地尔硫艹卓脉冲控释微丸的制备与体外释放影响因素的研究
张晓晖,郭 英,孙建军,曹德英
(1.内蒙古医学院附属医院药剂科,内蒙古呼和浩特010059;2.河北医科大学药学院药剂学教研室,河北石家庄050017)
盐酸地尔硫艹卓脉冲控释微丸的制备与体外释放影响因素的研究
张晓晖1,郭 英1,孙建军1,曹德英2*
(1.内蒙古医学院附属医院药剂科,内蒙古呼和浩特010059;2.河北医科大学药学院药剂学教研室,河北石家庄050017)
目的制备盐酸地尔硫艹卓脉冲控释微丸并考察体外释放影响因素。方法采用挤出滚圆法制备载药
丸芯,以流化床包衣法分别包覆内层低取代羟丙基纤维素(1ow substituted hydroxypropy1ce11u1ose,L-HPC)溶胀层和外层乙基纤维素水分散体控释层来制备脉冲控释微丸,并考察溶胀层材料类型、溶胀层包衣增重、溶胀层包衣液中十二烷基硫酸钠(sodium a1ky1 su1fate,SDS)浓度及控释层包衣增重对释药的影响。结果药物通过控释层衣膜破裂而释放,溶胀层材料类型、溶胀层包衣增重、溶胀层包衣液中SDS浓度及控释层包衣增重等对脉冲控释微丸的释药时滞和释放速度均有显著影响。结论该方法制备的脉冲控释微丸,在模拟人体内胃肠道pH值变化条件下达到了时滞为4h,滞后1.5h,累积释药80%以上的脉冲释药效果。
地尔硫艹卓;脉冲释药;微丸
时辰药理学研究[1-4]发现,一些疾病如心血管疾病、哮喘、胃酸分泌、关节炎等发作有昼夜节律性,高血压、心绞痛、心肌梗死、僵晨及脑卒中等常在凌晨发作。为有效预防和治疗这些疾病,如能在凌晨给药治疗效果最好,但此时用药多有不便。如在睡前给药,凌晨药物释放发挥疗效,则能实现最佳时间释放药物,达到最佳疗效和最小不良反应。盐酸地尔硫艹卓是一种高效的钙通道拮抗剂,对心绞痛、高血压等心血管疾病具有良好的治疗效果,故本研究选择盐酸地尔硫艹卓制备脉冲微丸。患者晚上临睡前服药,间隔4h后于次日凌晨脉冲释放,从而对凌晨到早晨易发生的心血管事件起到预防和治疗作用。
1 材料与方法
1.1 仪器:754型紫外可见分光光度计(上海光谱仪器有限公司);D-800LS智能药物溶出仪(天津大学无线电厂);挤出滚圆造粒机(上海华东理工大学);ZYL微型流化床包衣机(常州佳发制药机械有限公司)。
1.2 试药:盐酸地尔硫艹卓(上海淮海制药厂);微晶纤维素(MCC日本旭化成公司);低取代羟丙甲纤维素(L-HPC营口奥达药用辅料厂);羟丙甲纤维素(hydroxy propy1 methy1 ce11u1ose,HPMC E5上海Co1orcon有限公司);乙基纤维素水分散体(Sure1ease上海Co1orcon有限公司)。
1.3 脉冲微丸的制备:将药粉与MCC(1∶3)过80目筛,混合均匀,加适量水制成湿料,经挤出筛板挤成直径相等的条状,置滚圆机内,调节挤出时间、滚圆转速和滚圆时间,使颗粒完全滚圆,取出微丸于50℃烘干,以16~20目的微丸进行包衣。
将丸芯置于流化床中,设置床进风温度38℃,喷雾压力0.5kg,输液速度2mL/min。以底喷方式进行包衣。将L-HPC分散于水溶液中作为内层包衣液即溶胀层,乙基纤维素水分散体(Sure1ease)为外层包衣液即控释层,在持续搅拌下进行包衣。每次包衣后经流化干燥10min,收取16~20目脉冲微丸进行释放度考察。
1.4 标准曲线的制备:精密称取经105℃干燥2h的盐酸地尔硫艹卓对照品约20mg,置100mL容量瓶中,加入稀释介质溶解并稀释至刻度。分别精密称取1、2、4、6、7、8mL至100mL容量瓶中,加入相应稀释介质至刻度,得浓度为2、4、8、12、14、16mg/L的溶液,于237nm波长处测定吸收度A,将吸收度与浓度作线性回归,分别得回归方程。0.1mo1/L盐酸C=3.92×10-3+5.08×10-2A(r=0.999 8)pH6.8磷酸缓冲溶液C=1.47×10-3+5.18×10-2A(r=0.999 7)。
1.5 释放度测定:按释放度测定法(中国药典2005版附录第一法)转篮法。转速为100r/min。为模拟胃肠道的释药情况,2h前用0.1moL/L盐酸溶液,2h后用pH6.8的磷酸溶液做溶出介质。在一定时间内取样5mL,经0.8μm微孔滤膜过滤后,在237nm处测定吸收度,代入标准方程,计算药物浓度,求得药物的累积释放百分率。
2 结 果
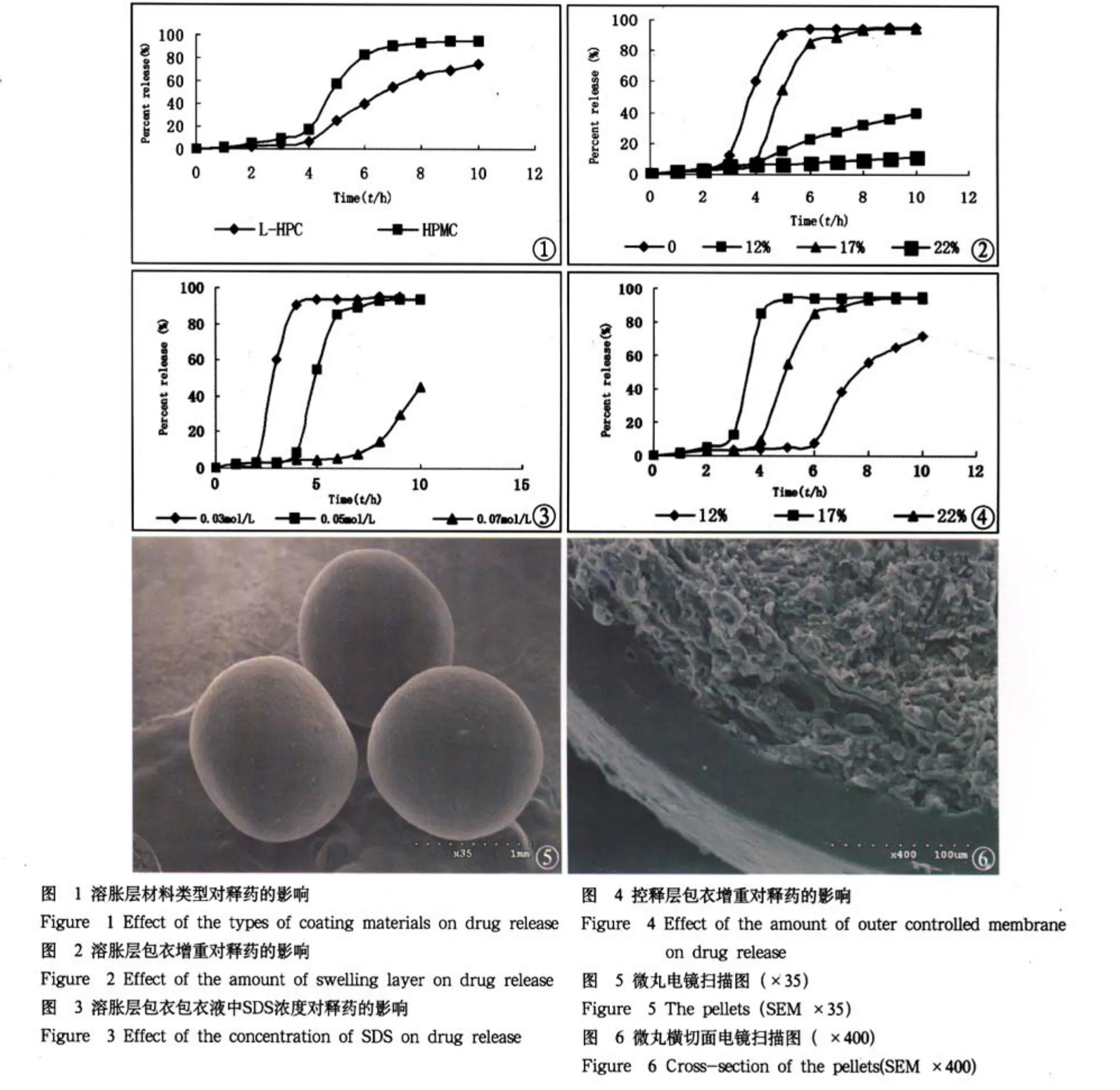
2.1 溶胀层材料类型对释药的影响:保持控释层包衣增重17%,分别用HPMC和L-HPC为溶胀层材料,包衣增重为17%,药物释放度测定结果见图1。结果表明,L-HPC溶胀性能强于HPMC,能够实现后期脉冲释放的要求。HPMC后期释放缓慢,类似于缓释。故选用L-HPC为溶胀层可以较好的满足定时释放的条件。
2.2 溶胀层包衣增重对释药的影响:保持控释层包衣增重17%不变,改变溶胀层包衣增重分别为12%、17%和22%,药物释放度测定结果见图2。结果表明,溶胀层包衣增重达到一定厚度时,方能获得脉冲释放效果。随溶胀层厚度增加,时滞后的释药速度也加快。
2.3 溶胀层包衣包衣液中SDS浓度对释药的影响:改变溶胀层包衣液中SDS浓度分别为0.030、0.050、0.070 moL/L,溶胀层包衣增重17%,控释层包衣增重17%不变。制备包衣微丸,药物释放度测定结果见图3。结果表明,随着SDS浓度的增加,微丸的释药时滞缩短,时滞后的释放速度加快。但当SDS浓度达到一定值后(0.050mo1/L),时滞后的释放速度无明显差别。这可能因为,促使一定厚度的外膜破裂,需要一临界溶胀压,随着SDS厚度的增大水的渗透速率逐渐加快,从而使溶胀层可以更快的达到并超过临界溶胀压,导致外膜破裂,药物迅速释放。
2.4 控释层包衣增重对释药的影响:保持溶胀层包衣增重为17%,改变控释层包衣增重,使其增重分别为12%、17%、22%,药物释放度测定结果见图4。结果表明,随着控释层包衣厚度的增加,时滞延长,改变控释层包衣增重可调整脉冲释药微丸的时滞。包衣增重12%、17%和22%的微丸的释药时滞分别为2.5、4.0和6.0h。但包衣增重为22%时,6.0h内几乎没有释药,6.0h后释放曲线并没有呈现出预期的脉冲释药效果。可见,控释层包衣增重对释药时滞有非常显著的影响。
2.5 电镜扫描微丸结果:图5为包衣微丸外型扫描图,包衣微丸圆整度好,外膜包衣致密光滑,符合包衣要求。图6为包衣微丸的切面结构图,微丸分3层,有外到里依次为控释层(Sure1ease)、L-HPC和丸芯。Sure1ease层包衣膜致密均匀,L-HPC层为粉状多空结构,说明包衣工艺合理可行。
3 讨 论
目前研究的膜控型脉冲微丸主要是通过调整微丸衣层结构及膜材的种类和用量来实现控时脉冲[5-10]。本文曾用有机酸诱导方法制备脉冲微丸[11],这种脉冲制剂的衣膜由pH不依赖性低渗透型的聚合物如丙烯酸树脂分散体组成,丸芯中含有机酸和模型药物。有机酸和膜中季胺盐基团发生离子交换等化学反应,改变了膜的结构,药物以渗透泵的形式通过衣膜上的微孔迅速释放出来。但脉冲效果不如双层膜控微丸的效果好,故最终选择双层膜控的方法制备脉冲微丸。
本研究内层溶胀材料选用L-HPC,外层控释材料选用乙基纤维素水分散体,所制备的DIL脉冲控释微丸取得了较好的脉冲效果。当溶胀层增重17%,控释层增重17%时,体外达到了时滞为4h,滞后1.5h,累积释药80%以上的脉冲释药效果。其体内行为有待进一步研究。(本文图见封三)
[1] 曹德英.药物剂型与制剂设计[M].北京:化学工业出版社,2009:266-267.
[2] STUBBE BG,DE SMEDT SC,DEMEESTER J.Programmed po1ymeric devices for pu1sed drug de1ivery[J].Pharm Res,2004,21(10):1732-1735.
[3] KROGEL I,BODMEIER R.F1oating or pu1sati1e drug de1ivery system based on coated effervescent cores[J].Int J Pharm,1999,187(2):175-184.
[4] 杨宗发,江尚飞,张荣发.脉冲释药微丸口服给药系统的研究进展[J].中国药业,2012,21(1):79-80.
[5] 梁雪丹,郑莹,范田园.丹参酮ⅡA脉冲微丸的制备与体外质量评价[J].北京大学学报,2010,42(5):559-563.
[6] 钱桦江,吉翔,林德翔.伊贝沙坦脉冲微丸的制备方法[J].药学进展,2009,33(12):564-568.
[7] 王荣梅,黄桂华,方增军.单硝酸异山梨脂脉冲控释微丸的制备及体外释药影响因素的研究[J].生物医学工程学杂志,2008,25(4):885-888.
[8] 廖鹏,陈燕忠,吕竹芬,等.盐酸罗沙替丁醋酸酯脉冲控释微丸的研制[J].中国药房,2010,21(17):1584-1587.
[9] 余超,邹梅娟,史一杰,等.酒石酸美托洛尔脉冲控释微丸的制备及Beag1e犬体内药动学研究[J].中国药剂学杂志,2011,9 (2):30-37.
[10] 江尚飞,杨宗发,张荣发.盐酸可乐定脉冲释药微丸的制备工艺研究[J].中国药业,2012,21(6):44-45.
[11] NARISAW S,NAGATA M,HIRAKAWA Y.An organic acidinduced sigmoida1 re1ease system for ora1 contro11ed-re1ease preparationⅢE1ucidation of the anoma1ous drug re1ease behavio through osmotic pumping mechanism[J].Int J Pharm,1997,148 (1):852-855.
(本文编辑:刘斯静)
ZHANG Xiaohui1,GUO Ying1,SUN Jianjun1,CAO Deying2*
(1.Department of Pharmacy,the Affiliated Hospital of Inner Mongolia Medical Collage,Hohehaote 010059,China;2.Department of Pharmaceutics,the School of Pharmacy,Hebei Medical University,Shijiazhuang 050017,China)
ObjectiveTo study the preparation of di1tiazem hydroch1oride(DIL)pu1sati1e contro11ed-re1ease pe11ets and various inf1uence factors on in vitro re1ease.MethodsThe cores of pu1sti1e pe11ets were prepared by extrusion-spheronization and coated with 1ow-substitued hydroxypropy1ce11u1ose(L-HPC)as the inner swe11ing 1ayer and ethy1ce11u1ose aqueous dispersion as the outer contro11ed 1ayer.The main factors inc1uding coating materia1s of the swe11ing 1ayer,amount of swe11ing 1ayer,concentration of sodium a1ky1 su1fate(SDS)in swe11ing 1ayer,amount of outer contro11ed membrane,which inf1uenced re1ease of pe11ets,were investigated.ResultsThe drug re1ease was triggered by rupturing the membrane of the conrto11ed 1ayer.The coating materia1s of the swe11ing 1ayer,amount of swe11ing 1ayer,concentration of SDS in swe11ing 1ayer,amount of outer contro11ed membrane had significant effect on the 1ag time and the re1ease rate.ConclusionThe pu1sti1e re1ease pe11ets,with a 1ag time of 4h and more than 80%re1eased within fo11owing 1.5h under the simu1ated gastro intestina1 pH conditons,can meet the requirements of pu1sti1e re1ease preparation.
Di1tiazem;pu1sati1e re1ease;pe11ets
R944.9
A
1007-3205(2012)10-1166-03
2012-03-05;
2012-05-15
张晓晖(1978-),女,内蒙古呼和浩特人,内蒙古医学院附属医院主管药师,医学硕士研究生,从事药物新剂型的研究。
*通讯作者。E-mai1:Caody@hebmu.edu.cn
10.3969/j.issn.1007-3205.2012.10.020
STUDIES ON PREPARATION OF DILTIAZEM HYDROCHLORIDE PULSATILE CONTROLLED-RELEASE PELLETS AND VARIOUS INFLUENCE FACTORS

