血管活性肠肽的固相合成及其体外抗菌活性研究
徐春兰,尚晓娅,牛卫宁,钦传光
(西北工业大学生命学院 空间生物实验模拟技术国防重点实验室,陕西 西安 710072)
抗菌肽是一类具有广谱抗菌活性(抗细菌、病毒和真菌)的小分子量的阳离子蛋白质[1];而神经肽是一类在调节神经源性炎症中发挥重要作用的神经递质[2],具有与抗菌肽相似的大小、电荷、等电点和氨基酸组成,从而表现出直接的抗菌效应。神经系统可能将作为抗菌剂的神经肽快速准确地递送到神经支配的位点如口腔。研究表明,神经肽如P物质、神经激肽A(NKA)、人降钙素基因相关肽(CGRP)、神经肽Y(NPY)和血管活性肠肽(Vasoactive intestinal peptide,VIP)等存在于人正常和龋坏牙齿的牙髓、龈沟液和唾液中[3~5]。
VIP,又名舒血管肠肽,为直链肽,属胰高血糖素-胰泌素家族,在人体内分布较广,不仅是胃肠道激素,同时又是一种神经肽。许多免疫活性细胞不仅能释放少量的VIP,而且其表面上也有与VIP高亲和力的受体存在。研究表明,VIP是神经系统和免疫系统之间相互作用的一种信号分子,在机体免疫、尤其是在局部粘膜免疫中起着一定的作用;VIP对消化道运动起抑制性调节作用;VIP可以直接杀死各种细菌和酵母菌,是一种潜在的抗菌肽[6~8]。因此,研究VIP的合成及活性意义重大。
作者采用Na-芴甲氧羰基(Fluorenylmethyloxyloxycarbonyl,FMOC)作为α-氨基的保护基,以固相合成法合成VIP,并对其体外抗菌活性进行了评价。
1 实验
1.1 材料、试剂与仪器
受试菌株:大肠埃希菌(EscherichiacoliATCC 25922)、金黄色葡萄球菌(StaphylococcusaureusATCC 25923)、变形链球菌(StreptococcusmutansATCC 25175)、粪肠球菌(EnterococcusfaecalisATCC 29212)、铜绿假单胞杆菌(PseudomonasaeruginosaATCC 27853)、白色念珠菌(CandidaalbicansATCC 10231)和嗜酸乳杆菌(LactobacillusacidophilusATCC 4356),中科院微生物研究所;人牙龈纤维原细胞系(Human gingival fibroblasts,HGF),上海麦莎生物科技有限公司;抗菌肽Cecropin,Sigma公司。
MHB、SB、MRS培养基,中国进出口商品检验技术研究所;MEM培养基:L-谷氨酰胺,10%胎牛血清,100 U·mL-1青霉素,100 μg·mL-1链霉素。
Fmoc-氨基酸、2-(1H-苯并三唑)-1,1,3,3-四甲基脲六氟磷酸盐(HBTU)、N,N′-二异丙基乙胺(DIEA)、Fmoc-His(Trt)-Wang树脂,上海吉尔生化公司;N-甲基吡咯烷酮(NMP)、二氯甲烷(DCM)、哌啶(PIPE)、三氟乙酸(TFA),均为国产分析纯;乙腈(ACN),色谱纯,Fisher公司。
旋转混合仪;Bio-Spin空柱;高效液相色谱仪,美国Waters公司;基质辅助激光解吸电离飞行时间质谱仪(MALDI-TOF-MS),美国Linear Scientific公司;酶标仪,美国Biotex公司。
1.2 血管活性肠肽的合成
1.2.1 树脂的溶胀
称取2 g Fmoc-His(Trt)-Wang树脂,加入NMP 20 mL,溶胀树脂2 h。加入20 mL DCM,混匀1 min,清空反应器,重复2次。加入20 mL 20% PIPE,反应30 min,清空反应器,重复1次。加入20 mL DCM,混匀1 min,清空反应器,再加入20 mL NMP,混匀 1 min,清空反应器,重复2次。
1.2.2 肽链的合成
向溶胀好的树脂中加入1 g Fmoc-His-OH、1 g HBTU(用5 mL NMP溶解)、3 mol·L-1的DIEA溶液40 μL,混匀后加入到反应器中,再加入15 mLNMP反应2 h。清空反应器,加入20 mL DCM,混匀1 min,清空反应器,再加入20 mL NMP,混匀1 min,清空反应器,重复2次。加入20 mL 20% PIPE,反应30 min,清空反应器,重复1次。加入DCM 20 mL,混匀1 min,清空反应器,重复2次。
采用相同的操作步骤,依次缩合Fmoc-Ser(Bzl)-OH、Fmoc-Asp(OtBu)-OH、Fmoc-Ala-OH、Fmoc-Val-OH、Fmoc-Phe-OH、Fmoc-Thr(Bzl)-OH、Fmoc-Asp(OtBu)-OH、Fmoc-Asn(Trt)-OH、Fmoc-Tyr(Boc)-OH、Fmoc-Thr(Bzl)-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Leu-OH、Fmoc-Arg(Pbf)-OH、Fmoc-Lys(Boc)-OH、Fmoc-Gln(Trt)-OH、Fmoc-Met-OH、Fmoc-Ala-OH、Fmoc-Val-OH、Fmoc-Lys(Boc)-OH、Fmoc-Lys(Boc)-OH、Fmoc-Tyr(Bzl)-OH、Fmoc-Leu-OH、Fmoc-Asn(Trt)-OH、Fmoc-Ser(Bzl)-OH、Fmoc-IIe-OH、Fmoc-Leu-OH、Fmoc-Asn(Trt)-OH。
1.2.3 切肽
在最后形成的多肽树脂中,加入切割液TFA,反应4 h,用砂芯漏斗过滤,收集滤液,用冰乙醚离心沉淀,冻干,即得VIP。
1.3 高效液相色谱分离和质谱测定
用高效液相色谱仪进行粗肽的分离。色谱柱为C18柱,检测波长210 nm。洗脱液 A:0.05% TFA+2% ACN;B:0.05% TFA+90% ACN。线性梯度由0% B溶液→30% B溶液,时间30 min,流速1.0 mL·min-1。对收集的主峰进行质谱测定。
1.4 体外抗菌活性测定
采用琼脂糖弥散抗菌实验[9]检测VIP对各种病原菌的抗菌活性,以100 μg·mL-1抗菌肽Cecropin作为阳性对照。
取实验用病原菌于50 mL相应的培养基中培养过夜,E.coli、S.aureus、S.mutans、E.faecalis、P.aeruginosa用MHB培养基,C.albicans用SB培养基,L.acidophilus用MRS培养基。接种50 μL过夜培养基于50 mL合适的新鲜肉汤培养基中,37 ℃培养3 h,获得对数生长中期的病原菌。病原菌于4 ℃、1000×g离心10 min后,用10 mmol·L-1PBS(pH值7.4)漂洗,悬浮在10 mL的PBS中。制备衬底凝胶,其中含有1%的琼脂、5×106个细菌细胞。通过涡旋分散微生物,倒入培养皿中。凝固后用打孔器在琼脂上打孔洞(直径2.5 mm),然后向每个孔加入3 μL的VIP溶液(浓度范围50~500 μg·mL-1),阴性对照孔用无菌水代替。将培养皿置于37 ℃、好氧条件下培养3 h,使肽扩散。然后将10 mL 1%的琼脂上层凝胶(含有细菌特定培养基)倒入上述培养皿以提供病原菌生长所需要的营养,于37 ℃培养18 h,用考马斯亮蓝G-250稀释液染色。
用放大镜(放大8倍)观察抑菌圈,抑菌圈的直径以单位U表示(1 U=0.1 mm),需减去中心孔的直径。
抗菌活性以最小抑菌浓度(Minimal inhibitory concentration,MIC)表示,而MIC值以x轴截距(由自由弥散单位与log10×肽的浓度的关系曲线得到)来确定。当MIC>500 μg·mL-1时被定义为耐药性,MIC取3次独立实验分析平均值。
1.5 对人正常细胞活性的影响
通过MTT实验评价VIP对人正常细胞的毒性。
将HGF接种于96孔培养板,加入MEM培养基培养48 h。加入100 μL 100 μg·mL-1的VIP培养3 h,VIP未处理孔为空白对照组。吸弃培养液,迅速加入 10 μL 5 mg·mL-1的四甲基偶氮唑盐(MTT)溶液,37 ℃培养2 h,取出培养板,小心吸弃孔内液体,每孔加入100 μL二甲基亚砜(DMSO),于37 ℃培养 10 min,待紫色结晶完全溶解后,用酶标仪测定各组细胞在570 nm处的吸光度(A)值。按下式计算细胞存活率:

2 结果与讨论
2.1 高效液相色谱分析(图1)
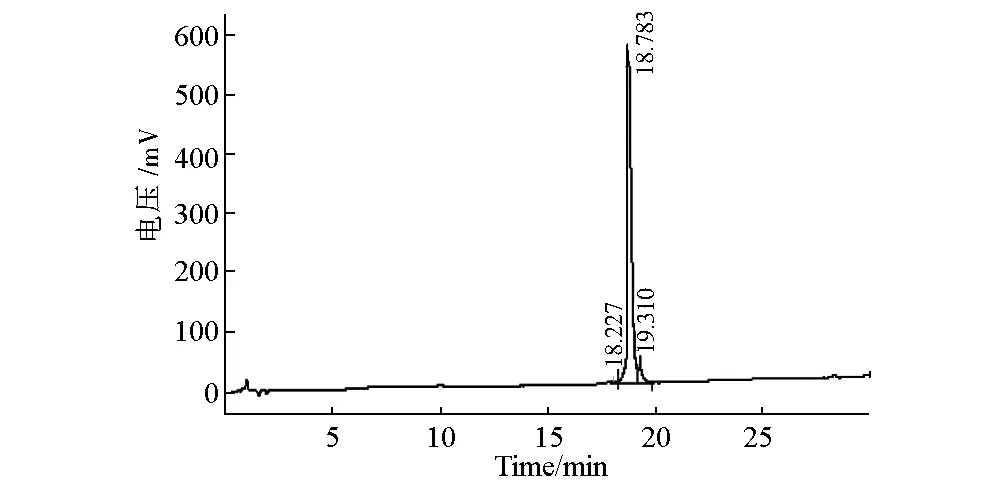
图1 血管活性肠肽的HPLC图谱
从图1可知,主峰面积较大,其它峰面积与主峰面积相比较小,表明合成的VIP杂质少、纯度高。根据HPLC谱图中峰面积计算,VIP纯度达到95.2%。
2.2 质谱鉴定(图2)
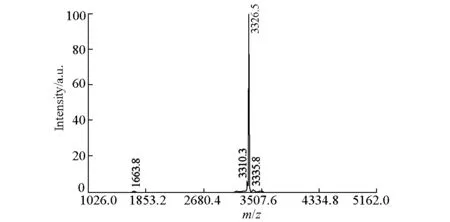
图2 血管活性肠肽的质谱图
从图2可知,实际合成的VIP相对分子质量为3326.5,与VIP的理论分子质量3326.5一致。图2中主峰明显,说明合成的VIP经色谱仪纯化后,可以除去大部分的杂质,得到较纯的VIP。
2.3 体外抗菌活性分析
固相合成的VIP对几种革兰氏阳性菌和革兰氏阴性菌的体外抑制作用见表1。
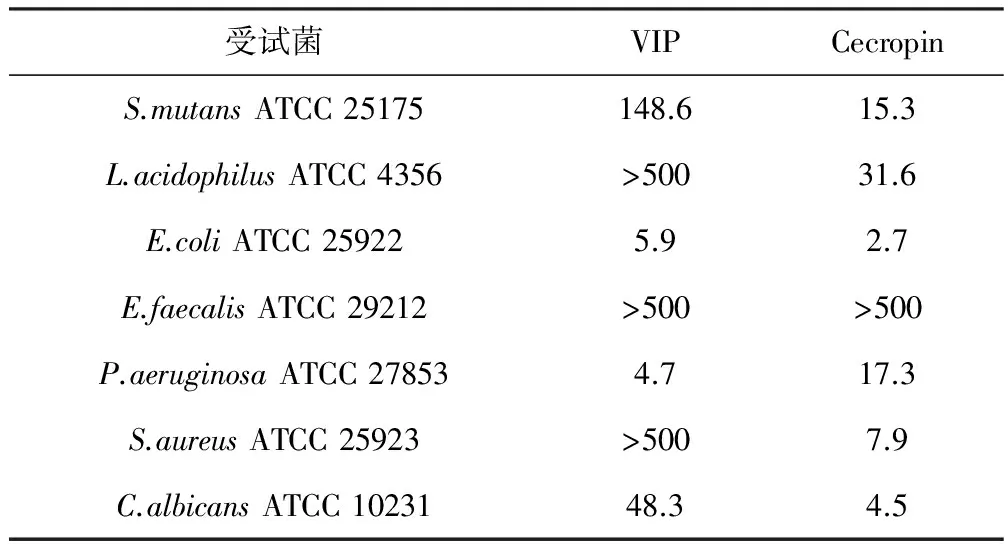
表1 血管活性肠肽对不同受试菌的最小抑菌浓度/μg·mL-1
由表1可知,VIP对病原微生物E.coli、P.aeruginosa、C.albicans和S.mutans表现出不同程度的抗菌活性,其中对E.coli、P.aeruginosa的抑制效果较明显。阳性对照组(100 μg·mL-1Cecropin)能有效地抑制各种受试微生物(E.faecalis除外),而阴性对照组(无菌水)无抗菌活性。
2.4 血管活性肠肽对细胞存活率的影响(图3)
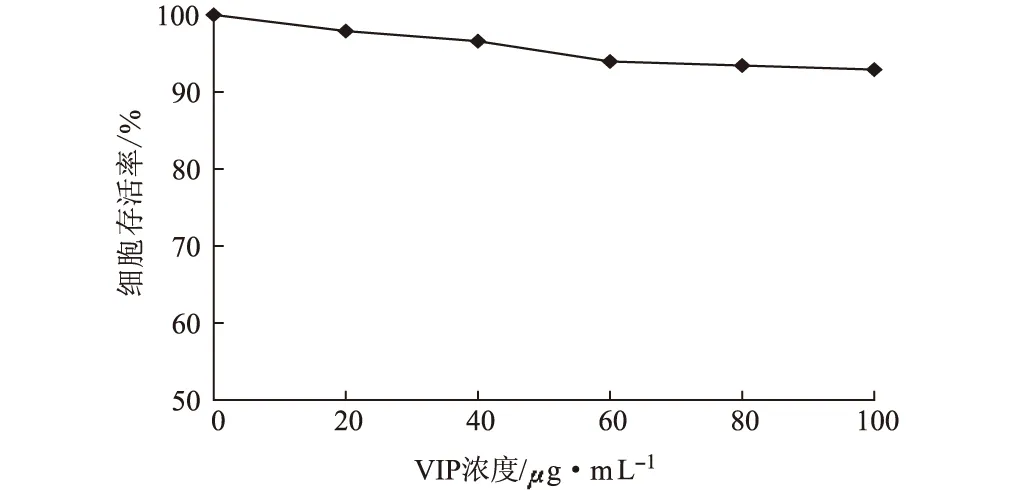
图3 血管活性肠肽对人牙龈纤维原细胞存活率的影响
由图3可知,VIP对人正常细胞系HGF的活性无影响,在作用浓度为100 μg·mL-1时,HGF细胞的存活率为93%。
2.5 讨论
本研究采用FMOC固相方法合成VIP,粗肽经过纯化和分离得到预期活性产物。选用Fmoc-His(Trt)-Wang树脂为合成的起点,将VIP羧端固定在树脂上,向氨基端逐步递加、延长肽链,每一步反应均较易进行,消旋化的可能性小,但要求每步反应都达到高产率。目标肽的粗品经高效液相色谱分析纯度为95.2%,质谱分析其相对分子质量为3326.5,与理论值一致。由于多肽是用固相法合成的,氨基酸的连接顺序固定,证明了合成的VIP结构正确。
神经肽在神经性炎症和疼痛方面起重要作用,还参与免疫调节[10]。越来越多的证据表明,神经肽通过直接的抗菌作用在调节免疫应答中发挥着重要作用[6]。已有报道神经肽对来自皮肤、口腔、呼吸道和胃肠道的一系列微生物都有抗菌活性。作者首次报道固相合成的VIP对病原菌E.coli和P.aeruginosa具有较强的抗菌作用。在口腔组织中,神经肽在调节神经性炎症中发挥着重要的作用。对于细菌引起的炎症状态如牙髓炎和牙周炎,常常可观察到神经肽表达量的上调[3~5]。神经肽在龋齿附近牙髓的成牙质细胞层和成牙质细胞下层的萌芽[5],导致炎症部位神经肽水平的提高,从而发挥直接的抗菌作用。研究还表明,即使在浓度为100 μg·mL-1时,在琼脂糖弥散抗菌实验中具有抗菌活性的VIP对人正常细胞的细胞毒性仍有限,支持其在选择性地杀伤细菌方面的生理作用。
一些种属的细菌如L.acidophilus、E.faecalis和S.aureus对VIP的抗菌效应表现出耐受性。目前这些耐受性还不能解释清楚,但是S.mutans颠覆阳离子抗菌肽的能力被认为是细胞表面静电作用的改变使得其净负电荷减少,导致其和阳离子抗菌肽结合力的降低[11]。
神经肽和抗菌肽在分子大小、氨基酸组成、两亲性设计和阳离子电荷方面的相似性支持了神经肽能作为抗感染分子的假说[6]。研究表明,VIP对E.coli和P.aeruginosa的抗菌活性可以与已经报道的抗菌肽α-防御素相比[12]。本实验结果中神经肽的体外抗菌活性谱也表明其调节内在免疫应答的潜力。由于抗菌肽体内活性受到pH值、离子浓度、与蛋白质和糖胺聚糖的结合力等因素以及[13]体内生理性相互作用的影响,有必要进一步深入研究。神经肽可能的相互协同作用及其对临床分离菌株的活性作用的研究将有助于开发其作为新的治疗剂的潜力。
3 结论
采用Na-芴甲氧羰基(FMOC)作为α-氨基的保护基,以逐个延伸的固相合成法合成了血管活性肠肽,以最小抑菌浓度(MIC)评价其体外抗菌活性。高效液相色谱和质谱分析表明所合成的血管活性肠肽的纯度为95.2%,相对分子质量为3326.5;血管活性肠肽对几种革兰氏阳性菌和革兰氏阴性菌有不同程度的抑制活性,其中对E.coli和P.aeruginosa的抑制效果最好。
参考文献:
[1]Yeung A T Y,Gellatly S L,Hancock R E W.Multifunctional cational host defence peptides and their clinical applications[J].Cell Mol Life Sci,2011,68(13):2161-2176.
[2]Lundy F T,Linden G J.Neuropeptides and neurogenic mechani-sms in oral and periodontal inflammation[J].Crit Rev Oral Biol Med,2004,15(2):82-98.
[3]Awawdeh L,Lundy F T,Shaw C,et al.Quantitative analysis of substance P,neurokinin A and calcitonin generelated peptide in pulp tissue from painful and healthy human teeth[J].Int Endod J,2002,35(1):30-36.
[4]Linden G J,Mullally B H,Burden D J,et al.Changes in vasoactive intestinal peptide in gingival crevicular fluid in response to periodontal treatment[J].J Clin Periodontol,2002,29(6):484-489.
[5]EI Karim I A,Lamey P J,Ardill J,et al.Vasoactive intestinal polypeptide(VIP) and VPAC1 receptor in adult human dental pulp in relation to caries[J].Arch Oral Biol,2006,51(10):849-855.
[6]Brogden K A,Guthmiller J M,Zasloff M.The nervous system and innate immunity:The neuropeptide connection[J].Nat Immunol,2005,6(6):558-564.
[7]Allaker R P,Grosvenor P W,McAnemey D C,et al.Mechanisms of adrenomedullin antimicrobial action[J].Peptides,2006,27(4):661-666.
[8]Chorny A,Gonzalez-Rey E,Varela N,et al.Signaling mechanisms of vasoactive intestinal peptide in inflammatory conditions[J].Regul Pept,2006,137(1):67-74.
[9]Hokfelt T,Bartfai T,Bloom F.Neuropeptides:Opportunities for drug discovery[J].Lancet Neurol,2003,2(8):463-472.
[10]Bost K L.Tachykinin-mediated modulation of the immune res-ponse[J].Front Biosci,2004,9(S):3331-3332.
[11]Peschel A,Otto M,Jack R W,et al.Inactivation of the dlt operon inStaphylococcusaureusconfers sensitity of defensins,protegrins,and other antimicrobial peptides[J].J Biol Chem,1999,274(13):8405-8410.
[12]Lundy F T,Nelson J,Lockhart D,et al.Antimicrobial activity of truncated alpha-defensin(human neutrophil peptide(HNP)-1) analogues without disulphide bridges[J].Mol Immunol,2008,45(1):190-193.
[13]Baranska-Rybak W,Sonesson A,Nowicki R,et al.Glycosaminoglycans inhibit the antibacterial activity of LL-37 in biological fluids[J].J Antimicrob Chemother,2006,57(2):260-265.

