三磷酸肌醇和PTEN基因表达在槲皮素抑制裸鼠肝癌增长中的作用
彭伟 张继红 梁力建

[摘要] 目的 探讨三磷酸肌醇(IP3)和PTEN基因表达变化在槲皮素(quercetin)治疗裸鼠移植人肝癌中的作用。 方法 以裸鼠移植人肝癌为对照组,槲皮素治疗组腹腔注入槲皮素50 mg/(kg·d),对照组腹腔注入含0.04%DMSO的RPMI1640培养基0.05 mL/g,3周后观察肝癌增长情况,并应用同位素试剂盒检测肝癌组织IP3含量,RT-PCR分析癌组织PTEN mRNA表达,Western blotting分析肝癌组织PTEN蛋白表达。 结果 治疗组肝癌体积和重量均显著低于对照组[体积(15.8±10.1) mm3 vs (52.3±26.5) mm3,重量(44.8±10.4) mg vs (91.3±31.4) mg],PTEN mRNA表达显著高于对照组[RI(灰度与面积之积的相对强度)0.81±0.24 vs 0.36±0.09](P < 0.01),PTEN蛋白表达显著高于对照组[RI(灰度与面积之积的相对强度)3.14±0.13 vs 1.08±0.15]。 结论 槲皮素能减少IP3生成,上调肝癌组织PTEN基因表达,抑制裸鼠移植人肝癌增长。
[关键词] 肝细胞癌;染料木黄酮;PTEN基因
[中图分类号] R735.7[文献标识码] A[文章编号] 1673-9701(2012)21-0008-03
机体应激的变化及基因是否表达的过程都受到细胞信号转导机制的影响,而且对细胞整体生命机制的表达过程如细胞的增殖、生长、衰老及死亡起到了重要的作用[1]。对于细胞分化、增殖、凋亡的动态稳态及肝癌的产生,关系十分密切[2,3];恶性肿瘤细胞主要表现为不受控制的生长、凋亡和增殖过程受阻[4]。因此,可通过调节细胞转导的机制从而达到调控机体基因表达的过程,对于肝癌治疗来讲,我们可以使得癌细胞进入到凋亡的程序从而达到抑制细胞繁殖的过程。本文研究中是以三磷酸肌醇(IP3)和PTEN基因的表达为对比指标,探讨其在槲皮素(quercetin)治疗鼠移植人肝癌中具体的表达情况,为磷酸肌醇信号通路抑制剂应用于临床提供一定的实验依据。
1 材料与方法
1.1 实验材料
肝癌细胞株(中山大学实验动物中心细胞库),胎牛血清(Hyclone),β-肌动蛋白鼠抗(Neomarker),Taq酶(Takara),槲皮素(Sigma),dNTP(上海生工生物工程技术服务有限公司),Tris-EDTA(Sigma),Trizol试剂(MRC),核糖核酸(Ambion),逆转录酶(Gibco BRL),胰蛋白酶(Sigma),RPMI1640培养基(Invitrogen),RNase inhibitors(上海生工生物工程技术服务有限公司),IP3检测试剂盒(Amersham),寡糖D(T)18(上海生工生物工程技术服务有限公司),PVDF膜(罗氏),发光materialanti小鼠(第二抗体)(武汉博士德公司),西班牙低熔点琼脂糖(Biowest公司)。流式细胞仪(贝克曼-库尔特公司),PTEN基因单克隆抗体(Santa Cruz),SDS(罗氏),PCR引物(上海生工生物工程技术服务有限公司)。
1.2 实验方法
1.2.1 模型的构造取HepG2细胞加入培养液中,培养成分为链霉素浓度为100 μg/mL,10%胎牛血清,青霉素100 U/mL,在5% CO2和95%湿度空气条件、常温37℃下进行培养,培养基更换时间为3 d。观察细胞为培养基85%左右时,进行传代操作。当传代达到移植要求时,进行裸鼠模型移植操作。
将HepG2细胞培养液制成5×107/mL的悬液,接种时取0.2 mL悬液注射到4只裸鼠的皮下组织,取体积为1 cm3大小的肿瘤为瘤源模型。待处死动物后,将瘤源完整取下,保持肿瘤的独立性,去除周围的组织成分,将生长良好的肿瘤切成直径在2 mm左右的小块,放置到生理盐水中等待使用。取裸鼠27只,发育条件为4~6周,待麻醉操作后沿腹部正中线切开,移植瘤块到动物肝实质中,然后缝合腹部,模型构造完成。待裸鼠饲养2周后进行观察研究。
1.2.2 分组操作标准槲皮素500 mg溶于DMSO 2 mL,将RPMI1640培养基配成1 mg/mL槲皮素溶液。注射标准为每克动物0.05 mL,DMSO浓度控制为0.04%。对照组溶剂制备:将2 mL的DMSO加入到培养基中,调配成浓度为0.04%的500 mL备用。饲养14 d后,随机将动物分为两组,每组9只动物:槲皮素治疗组动物按照50 mg/(kg·d)注入槲皮素;对照组每克动物取0.05 mL,注入培养溶液,待3周后进行后续实验。
1.2.3 测定肿瘤大小快速对动物进行处死,采取正中切口,肝脏游离后,观察肿瘤的浸润类型,对肿瘤就行切除,用电子天平称重。对肿瘤长短进行测量,取最长单位m和最短单位n,按照公式V=πmn2/6对肿瘤的体积进行计算。取肿瘤小部分制成标本,在-70℃的仪器条件下进行保存。
1.2.4 IP3含量的测定首先制作肝癌组织,保持整体环境低温,取肝癌组织进行实验室的离心操作,取上清液调pH值到7.5,再进行离心操作除去KClO4沉淀后,取上清液待测定。
对细胞进行计数后,取样品加入到100 μL缓冲液、100 μL结合蛋白,100 μL[3H]-IP3稀释液中,逐步经过离心、干燥处理,取沉淀物与1 mL去离子水进行混合,进行10 min的孵育操作,待操作完成后在液体中加入液闪,混合均匀后进行计数,与标准参考计数值进行对比后即可得到IP3的测定含量。
蛋白浓度的测定:在碱性条件下,加入蛋白后会有紫色沉淀发生,通过562 nm吸收值的测定可得到蛋白的具体浓度,进而得到IP3含量。
1.2.5 PTEN mRNA是否表达的检测遵照Trizol Reagent法对RNA进行提取操作,完整性检测以1%的琼脂凝胶电泳为准。定量RNA后以2 μg为单位进行逆转录,再进行PCR操作。上游引物:5-CATTATGACACCGCCAAA-3,下游引物:5-AACGGGGCTACATTATTT-3。循环35次。β-actin上游引物:5-GTGGGGCGCCCCAGGCACCA-3;下游引物:5-CTCCTTAATGTCACGCACGATTTC-3。循环35次,72℃进行延伸10 min。在凝胶100 V电泳后进行成像观察,通过半定量分析及面积比,得出相对强度的值,通过比较得出基因的表达规律。
1.2.6 检测PTEN蛋白PENT蛋白的表达测定参照Western blotting法设定的标准,依次进行电泳、转膜,封闭操作,在一抗加入后,去除未结合的抗体后加入二抗进行孵育过程,通过计算机进行成像分析及半定量分析处理。
1.3 统计学处理
采用SPSS 13.0统计学软件对数据进行处理,计量资料用(x±s)表示,采用独立样本t检验。
2 结果
2.1 分组动物模型的观察
通过观察两分组动物均可见肿瘤繁殖生长的表现。对照组模型动物精神不佳,但体重无增减变化,开腹后肿瘤状况较好,腹水未发现,无转移迹象。槲皮素组动物在瘤体的质量和体积测定上均小于对照组,动物检查未发现腹水及肿瘤转移迹象。
2.2 移植瘤
通过公式:抑瘤率=(两组瘤体重量差/对照组瘤体重量)×100%,得到治疗组的抑瘤率为50.3%。
2.3 IP3测定值
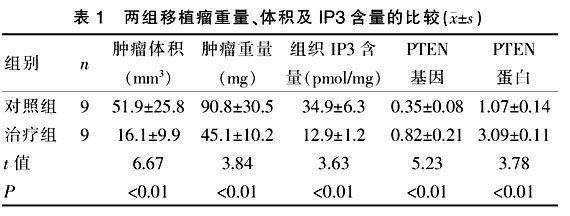
治疗组IP3含量明显小于对照组含量(P < 0.01)。在重量(t = 3.84)和体积(t = 6.67)的比较上,治疗组瘤体均小于对照组(P < 0.01)。见表1。
表1 两组移植瘤重量、体积及IP3含量的比较(x±s)
2.4 PCR结果处理
见表1、图1。经图表分析可得,在PTEN mRNA的表达比较上槲皮素组较对照组增加明显,经图像分析结果和半定量测定均得到证实(P < 0.01)。
2.5 Western blotting法分析
见表1、图2。经图表分析可得,在PTEN蛋白的表达比较上槲皮素组较对照组增加明显,经图像分析结果和半定量测定均得到证实(P < 0.01)。
3 讨论
细胞的整体生命过程都受到基因表达的控制。磷酸酶基因编码的PTEN蛋白可表现为两种不同的表达类型,其底物主要为PIP3与Akt。因此,在表达的过程上来说PTEN蛋白大都是利用PI3K/Akt通路来控制细胞的生命程序,如周期和凋亡变化[5,6]。当机体内出现恶性肿瘤时,PI3K/Akt通路会出现异常的激活表现,具体体现在激发的反应上,PIP2磷酸化以及PKB/Akt的特殊活化[7],后者可出现释放细胞色素C的反应从而使Forkhead家族等转录子磷酸化,是细胞的转录过程出现问题,从而起到影响细胞凋亡的目的[8,9]。
磷酸肌醇通路信号的特殊变化,在化学反应上不仅表现在对反应有催化作用的PIP和PI两种激酶活性的增高,而且也可以体现在反应物IP3和二酰基甘油的增高,这对于实验研究的肝癌细胞的生命过程有着重要的影响[10-12]。笔者通过研究也得到在PI及PIP两种激酶抑制的情况下槲皮素[13,14]可表现出对肝癌PTEN基因的表达的特殊性调节,进而导致细胞的凋亡。
笔者通过以上研究发现,针对槲皮素对磷酸肌醇信号通路进行抑制的研究,通过裸鼠肝癌模型的建立,发现其可使癌细胞内IP3的含量向减少的方向发展,通过对PTEN基因表达的影响可达到抑制肝癌细胞生长的目的。而且槲皮素可对PI和PIP两种激酶进行同时抑制[14,15],说明其可对PTEN基因的表达进行调节,即影响抑制肝癌细胞的生命过程。
本文通过实验研究表明了肝癌细胞磷酸肌醇通路信号转导及PTEN基因对肝癌生长的影响,磷酸肌醇信号通路抑制剂方向的研究,是一种新型治疗肝癌的方向。
[参考文献]
[1]孙大业,郭艳林,马力耕,等. 细胞信号转导[M]. 第2版. 北京:科学出版社,2000:1-9.
[2]Duan XX,Ou JS,Li Y,et al. Dynamic expression of apoptosis-related genes during development of laboratory hepatocellular carcinoma and its relation to apoptosis[J]. World J Gastroenterol,2005,11(30):4740-4744.
[3]Kountouras J,Zavos C,Chatzopoulos D. Apoptotic and anti-angiogenic strategies in liver and gastrointestinal malignancies[J]. J Surg Oncol,2005,90(4):249-259.
[4]Baskin-Bey ES,Gores GJ. Caspase-8, death-receptor signaling, and hepatocarcinogenesis: the Fas and the furious[J]. Gastroenterology,2005, 129(5):1790-1792.
[5]Waite KA,Eng C. Protean PTEN: form and function[J]. Am J Hum Genet, 2002,70(4):829-844.
[6]Hu TH,Huang CC,Lin PR,et al. Expression and prognostic role of tumor suppressor gene PTEN/MMAC1/TEP1 in hepatocellular carcinoma[J]. Cancer,2003,97(8):1929-1940.
[7]Franke TF,Hornik CP,Segev L,et al. PI3K/Akt and apoptosis: size matters[J]. Oncogene,2003,22(56):8983-8998.
[8]Di Cristofano A,Pandolfi PP. The multiple roles of PTEN in tumor suppression[J]. Cell,2000,100(4):387-390.
[9]Kops GJ,Burgering BM. Forkhead transcription factors: new insights into protein kinase B (c-akt) signaling[J]. J Mol Med (Berl),1999,77(9):656-665.
[10]Singhal RL,Yeh YA,Look KY,et al. Coordinated increase in activities of the signal transduction enzymes PI kinase and PIP kinase in human cancer cells[J]. Life Sci,1994,55(19):1487-1492.
[11]Weber G,Shen F,Prajda N,et al. Increased signal transduction activity and down-regulation in human cancer cells[J]. Anticancer Res,1996, 16(6A):3271-3282.
[12]Weber G,Shen F,Prajda N,et al. Regulation of the signal transduction program by drugs[J]. Adv Enzyme Regul,1997,37:35-55.
[13]贺福初,孙建中,叶鑫生,等. 蛋白质科学[M]. 北京:军事医学科学出版社,2009:32-35,51-55.
[14]Teixeira CC,Costas AP,Nemelivsky Y. Apoptosis of growth plate chondrocytes occurs through a mitochondrial pathway[J]. Angle Orthod,2007,77(1):129-134.
[15]Schulte-Hermann R,Bursch W,Low-Baselli A,et al. Apoptosis in the liver and its role in hepatocarcinogenesis[J]. Cell Biol Toxicol,1997,13(4-5):339-348.
(收稿日期:2012-05-07)

