吉非替尼术前化疗对局限性肺切除术后老年非小细胞肺癌患者的疗效影响研究
刘大仲,王 菲,张临友
我国肺癌高发年龄为70~74岁,接近50%的肺癌患者年龄超过70岁[1]。其中非小细胞肺癌 (NSCLC)是老年人最常见的肺癌类型之一。因老年NSCLC起病隐匿,早期症状不典型,多于中晚期才得到确诊,同时老年肺癌患者多合并各种慢性病,心、肺、肾功能减退,病死率高,1年生存率较低。因此对于病变范围大、心肺功能较差的老年NSCLC患者,我们多选择肺段切除术或楔形切除术,减少手术风险。吉非替尼是一种选择性表皮生长因子受体 (epidermal growth factor receptor,EGFR)酪氨酸激酶抑制剂,多用于晚期NSCLC的二三线治疗[2]。目前,针对EGFR基因未测定,癌肿或淋巴结转移侵犯大血管,手术风险大,体质较差,基础合并症多的老年NSCLC患者,术前给予吉非替尼辅助化疗,以降低手术风险的病例罕见报道。我院采用低剂量吉非替尼术前辅助治疗老年NSCLC患者,本研究对其疗效和安全性进行评估分析,现报道如下。
1 资料与方法
1.1 一般资料 选取2008年9月—2010年9月在我科住院治疗的老年NSCLC患者92例,均为局限性肺切除的局部NSCLC患者,年龄55~75岁,平均年龄63.4岁。术前均经胸部、上腹部及头部CT扫描,肺功能检测和其他临床检查确定癌肿局限于一侧胸腔无远处转移,全身骨扫描排除骨转移,Karnofsky(KPS)评分>80分,无其他严重器质性病变,可耐受手术。均经病理学或细胞学检查确诊为NSCLC,依照世界抗癌联盟修订的TNM标准进行术后病理分期。其中,本研究对象中女性、非吸烟患者、腺癌患者的比例较大。患者按照是否接受术前化疗分为两组,其中化疗组52例,接受术前吉非替尼辅助化疗;对照组40例,因经济等原因拒绝接受吉非替尼术前化疗。两组均接受局限性肺切除术,包括肺段切除术或楔形切除术。两组患者在平均年龄、性别、吸烟状况、肺功能、TNM分期、病理分型及并发症等方面比较,差异均无统计学意义(P>0.05,见表1)。

表1 两组患者的一般资料Table 1 General information of the two groups patients
1.2 治疗方法 化疗组:术前辅助化疗予吉非替尼 (易瑞沙,阿斯利康制药生产,批号:1106064),1次/d,每次250 mg,口服。用药1周期 (28 d),化疗期间如出现不良反应,给予对症处理,28 d后复查肺CT,确定无手术禁忌证后行手术治疗。其中32例行肺段切除术,20例行楔形切除术。术后根据病理诊断给予继续放化疗。对照组:经患者及其家属同意,不接受术前辅助化疗,仅给予局限性肺切除术治疗,术后根据病理诊断结果继续放化疗。其中15例行楔形切除术,25例行肺段切除术。两组术后化疗方案均为NP方案,放疗为普通外照射,剂量45~50 Gy,5~6周。术后随访1年。
1.3 观察指标 主要观察指标包括手术切除率、1年期生存率、肿瘤复发和转移、主要并发症、1年期生存质量(QOL)[3]。随访中记录1年内肿瘤复发或转移的情况,局部复发指肿瘤在同侧胸腔或纵隔内复发;远处转移指肿瘤在对侧胸腔或其他部位出现。主要并发症包括心律失常、心肌缺血或心肌梗死、呼吸衰竭、成人呼吸窘迫综合征 (ARDS)、肺炎、肺不张、吻合口狭窄、支气管胸膜瘘等情况。1年期生活质量采用肺癌症状量表 (lung cancer symptom scale,LCSS)[4]进行评分,该量表分值越高代表生活质量越差,分值越低代表生活质量越好。
1.4 统计学方法 采用SPSS13.0统计软件进行统计学分析。计量资料以表示,组间比较采用t检验,计数资料采用χ2检验。以p<0.05为差异有统计学意义。
2 结果
2.1 两组手术切除率、肿瘤复发转移和1年生存率比较 化疗组的手术切除率为92.3%,术后1年期生存率为78.8%,肿瘤复发和转移共2例 (3.8%);对照组手术切除率为77.5%,术后1年期生存率为70.0%,肿瘤复发和转移7例(17.5%)。给予低剂量吉非替尼术前化疗组患者的手术切除率高于对照组,肿瘤复发转移率低于对照组,差异均有统计学意义 (p<0.05);化疗组1年期生存率高于对照组,但两组比较差异无统计学意义 (P>0.05,见表2)。
2.2 两组术后并发症比较 化疗组主要术后并发症发生率为15.4%(8/52),对照组为15.0%(6/40),两组比较差异无统计学意义 (χ2=0.002,P=0.959,见表3)。化疗组肺部并发症5例,包括肺感染3例,肺不张1例,支气管胸膜瘘1例;其他并发症包括心律失常2例,切口感染1例。对照组肺部并发症4例,其中肺感染2例,肺不张2例;其他并发症包括切口感染1例,吻合口狭窄1例。两组均无严重并发症如心肌缺血或心肌梗死、呼吸衰竭、成人呼吸窘迫综合征、脓胸等发生。

表2 两组患者手术切除率、肿瘤复发转移率和1年期生存率比较〔n(%)〕Table 2 Comparison of resection rate,tumor recurrence rate and 1-year survival rate between two groups

表3 两组患者术后主要并发症比较〔n(%)〕Table 3 Comparison of the main postoperative complications between two groups
2.3 两组近期生存质量比较 两组患者治疗前生活质量评分比较,差异无统计学意义 (P>0.05);术后1年生活质量评分均较治疗前有明显下降,差异均有统计学意义 (p<0.05);治疗1年后,化疗组生存质量评分 (35.48±14.52)分低于对照组 (42.35±15.67)分,差异有统计学意义 (p<0.05,见表4)。
表4 两组患者1年期生存质量评分比较 Table 4 Comparison of QOL scores after one year treatment between two groups
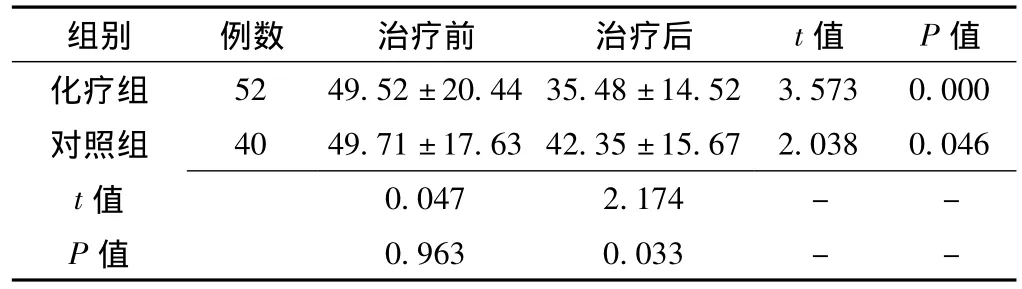
表4 两组患者1年期生存质量评分比较 Table 4 Comparison of QOL scores after one year treatment between two groups
组别 例数 治疗前 治疗后 t值 P值52 49.52±20.44 35.48±14.52 3.573 0.000对照组 40 49.71±17.63 42.35±15.67 2.038 0.046 t化疗组0.047 2.174--P值值0.963 0.033--
3 讨论
研究报道,大于80%的老年肺癌为NSCLC,且生存率和生活质量相对较低。因此对于老年NSCLC患者,选择有效、安全、不良反应少的治疗方法尤为重要。体外和临床试验提示,吉非替尼在有EGFR基因突变及腺癌患者中疗效较好,另外亚裔患者、非吸烟者、女性患者接受吉非替尼化疗时生存期较长[5-7]。在几项针对老年晚期非手术患者的二期临床试验中,与安慰剂比较,吉非替尼能减小癌肿体积,减少不良反应和毒副作用,增加患者耐受性,但尚无证据表明可较安慰剂组明显提高患者的生存质量[8-9]。本研究受试人群均为亚裔中国患者,其中女性及非吸烟者所占比例较高,分别为:化疗组67.3%、82.7%及对照组70.0%、75.0%;腺癌患者比例较鳞癌高,分别为:化疗组73.1%,对照组72.5%。有研究报道吉非替尼疗效并不与EGFR基因是否突变有关,而是与EGFR数量相关[10],也有报道称吉非替尼疗效与EGFR基因突变及EGFR数量均不相关[11]。本研究中未对所有患者进行EGFR基因突变检测,但化疗联合手术治疗效果良好,尚不能证明EGFR基因与吉非替尼疗效的相关性。1年期生存率无明显变化不除外与患者年龄、性别构成、癌肿分型和基因突变有关,需要进行进一步的研究。
迄今对于肺癌,手术治疗仍是最佳治疗手段。但对于老年患者,可切除的局部NSCLC术后5年生存率和复发转移率仍然较高。研究表明,对于局部晚期NSCLC采用外科手术合并多学科的联合治疗,可以有效降低癌肿病理分期,缩小切除范围,提高肿瘤的局控率,同时改善患者的生活质量。目前铂类联合一个第三代药物 (紫杉醇,吉西他滨或长春瑞滨)是NSCLC术前辅助化疗的标准方案[12]。但因老年患者的基础生理特点,对于常规剂量化疗方案带来的毒副反应尚心存芥蒂,若以此标准方案作为术前辅助化疗,大部分老年患者将无法耐受。本研究中,对于老年NSCLC患者进行严格选择,并对可以耐受手术并符合手术适应证者给予积极的手术治疗,术前仅给予常规剂量吉非替尼250 mg口服,发现吉非替尼辅助手术治疗对于老年NSCLC患者整体安全性良好,两组患者术后并发症发生率比较无显著差别,并且有效改善了患者的术后1年期生活质量,降低癌肿复发转移率。术后未见心肌缺血或心肌梗死、呼吸衰竭、成人呼吸窘迫综合征等严重并发症发生,全组患者均可耐受吉非替尼250 mg每天治疗。主要不良反应为咳嗽、一过性乏力、腹泻、皮疹、转氨酶轻度升高 (均于停药后缓解),2例患者出现气急、舌部疼痛感和干咳症状,停药后消失。同时,常规剂量吉非替尼联合手术疗效满意,化疗组32例吉非替尼28 d疗程结束后行肺段切除术,20例行楔形切除术,总切除率达92.3%,明显高于对照组的77.5%。化疗组有2例Ⅳ期鳞癌患者在1年内出现复发和转移后死亡(3.8%),对照组出现复发和转移者占17.5%,两组比较差异明显。术前吉非替尼辅助化疗可提高NSCLC切除率,降低远处转移率。其原因可能包括有:吉非替尼选择性作用于肺癌细胞,抑制肿瘤增生,降低病期,进而缩小切除范围,提高手术根治的可能性。同时可使病灶区血管闭塞,减少血管途径转移,杀灭肿瘤细胞,减少微转移,降低局部复发的可能性。
综上所述,吉非替尼术前化疗在老年NSCLC的治疗中有积极的作用。在严格控制手术适应证,选择靶向治疗对象的基础上,采用吉非替尼化疗+手术治疗方法,对于老年NSCLC患者可以增加治疗耐受性,提高手术切除率,在不增加手术风险的情况下提高患者的近期生存质量,对于肺癌的个体化和靶向治疗具有重要意义。
1 邹小农.中国肺癌流行病学[J].中华肿瘤防治杂志,2007,6(12):881-883.
2 庄蝶微,魏丽娟,王虹,等.吉非替尼治疗合并胸腔积液晚期NSCLC临床观察[J].中国误诊学杂志,2010,10(16):3805.
3 Biesma B.Quality of life,geriatric assessment and survival in elderly patients with non-small-cell lung cancer treated with carboplatin-gemcitabine or carboplatin-paclitaxel:NVALT-3 a phase III study[J].Ann Oncol,2011,22(7):1520 -1527.
4 Hollen PJ,Gralla RJ,Rittenberg CN.Quality of life as a clinical trial endpoint:determining the appropriate interval for repeated assessments in patients with advanced lung cancer[J] .Support Care Cancer,2004,12(11):767-773.
5 Jackman DM.Exon 19 deletion mutations of epidermal growth factor receptor are associated with prolonged survival in non-small cell lung cancer patients treated with gefitinib or erlotinib [J] .Clin Cancer Res,2006,12(13):3908-3914.
6 Hironori S.Low-dose gefitinib treatment for patients with advanced non-small cell lung cancer harboring sensitive epidermal growth factor receptor mutations[J] .JThorac Oncol,2011,6:1413 -1417.
7 Chang A.Gefitinib(IRESSA)in patients of Asian origin with refractory advanced non-small cell lung cancer:subset analysis from the ISEL study[J] .JThorac Oncol,2006,1(8):847 -855.
8 Goss G.Randomized phase II study of gefitinib compared with placebo in chemotherapy-naive patients with advanced non-small-cell lung cancer and poor performance status [J] .J Clin Oncol,2009,27(13):2253-2260.
9 Kim ST.Randomized phase II study of gefitinib versus erlotinib in patients with advanced non-small cell lung cancer who failed previous chemotherapy [J] .Lung Cancer,2012,75(1):82 -88.
10 Costanzo R.Gefitinib in non small cell lung cancer[J] .J Biomed Biotechnol,2011,12:815 -869.
11 Lara-Guerra H.Phase IIstudy of preoperative gefitinib in clinical stage I non - small- cell lung cancer[J] .J Clin Oncol,2009,27(36):6229-6236.
12 Browner I,Purtell M.Chemotherapy in the older patient with operable non-small cell lung cancer:neoadjuvant and adjuvant regimens[J].Thorac Surg Clin,2009,19(3):377-389.

