Enterobacter sp.SYA2乳糖酶酶学性质研究
张卫兵,张 炎,文鹏程,刘芳宁,巨 蕾,梁 琪*
(甘肃农业大学 食品科学与工程学院,甘肃 兰州 730070)
乳糖酶(Lactase)学名为β-D-半乳糖苷半乳糖水解酶(β-D-galactoside galactohydrolase,E.C.3.2.1.23),又名β-半乳糖苷酶(β-galactosidase),是一类催化β-D-半乳糖苷键发生水解的酶,能将乳糖水解成半乳糖和葡萄糖[1]。乳糖酶来源丰富,可以从很多微生物、植物和动物体中获得。利用用微生物发酵法获取乳糖酶的方法具有操作方便、生产效率高、适用于工业化生产等优点[2]。
目前为止,文献报道的产乳糖酶微生物很多,其中包括黑曲霉(Aspergillusniger)、米曲霉(Aspergillus oryzae)、脆壁克鲁维酵母(Kluyveromycesfragilis)、乳酸克鲁维酵母(Kluyveromyces lactis)、热带假丝酵母(Candida tropicalis)、成团肠杆菌(Enterobacter agglomerans)、巨大芽孢杆菌(Bacillus megaterium)、枯草芽孢杆菌(Bacillus subtilis)、环状芽孢杆菌(Bacillus Circulans)、嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)、保加利亚乳杆菌(Lactobacillusbulgaricus)、双歧杆菌(Bifidobacterium)等[3-8]。不同微生物来源的乳糖酶性质及用途不同:霉菌作用最适pH值偏酸性(pH2.5~5.0),主要用于酸性乳清和干酪的水解;酵母所产乳糖酶最适pH值近中性(pH6.0~7.0),适合于牛乳和甜乳清的加工处理;细菌所产的酶与酵母最适pH值接近且具有较高的耐热性[9]。细菌具有体积小、繁殖快、发酵过程易控制等特点,应用于工业化生产有很大的潜力[10]。
本试验以实验室前期从甘肃省天祝牧区牦牛乳酸奶中分离的产乳糖酶菌株Enterobactersp.SYA2[11]为研究对象,对Enterobactersp.SYA2乳糖酶的酶学性质进行了研究,以期为其进一步应用和研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂
ONP(分析纯):南京化学试剂有限公司;X-gal(色谱纯):西安舟鼎国生物技术公司;ONPG(色谱纯):科宏达生物技术有限公司。
1.1.2 培养基
种子培养基:乳糖10g/L、蛋白陈10g/L、酵母膏3g/L、NaCl 3g/L,pH7.0;
发酵培养基:乳糖15g/L、蛋白陈20g/L、酵母膏3g/L、NaCl 3g/L、K2HPO41g/L、MnCl 20.1g/L,pH 7.0。
1.1.3 仪器与设备
净化工作台(型号:SW-CJH-1FD):苏州净化设备厂;电热恒温培养箱(型号:HG303-4):南京实验仪器厂;电子天平(型号:PB203-N):上海精密科学仪器厂;数显pH计(pHS-25):上海精密科学仪器厂;低温高速离心机(型号:SUPRA 22K):韩国HANSON技术公司;紫外可见分光光度计(型号:UV-2450):日本岛津公司;超声波细胞粉碎机(型号:JY96-ПNP):宁波新芝生物科技股份有限公司。
1.2 方法
1.2.1 酶液制备
将分离纯化的菌株接种到种子培养基中,37℃摇床培养8h制备种子液;将种子液按体积分数5%接种于装液量为50mL发酵培养基的250mL三角瓶中,摇床转速176r/min,37℃培养。发酵培养后取培养液20mL,4℃、6000r/min离心20min,收集菌体并用0.1mol/L磷酸盐缓冲溶液洗涤2次,加入0.1mol/L磷酸盐缓冲溶液至20mL,超声破碎15min,4℃、12000r/min离心20min,取上清液测定酶活。
1.2.2 硫酸铵分级沉淀
准确量取一定体积的酶液,将其在冰水浴中,变缓慢搅拌,边慢慢添加经干燥和研磨的硫酸铵细粉末,使硫酸铵的饱和度达30%,4℃静置12h后,在4℃、12000r/min条件下离心15min,取少量上清液测定酶活和蛋白含量,沉淀收集备用。准确称取一定体积的上清液,重复以上操作使硫酸铵饱和度达到50%、60%、70%、80%、90%、100%,测量各饱和度条件下上清液的乳糖酶活。当硫酸铵分级沉淀的起始及终止饱和度确定后,硫酸铵盐析按以下步骤进行操作:在冰水浴条件下,变缓慢搅拌边缓慢添加经干燥和研磨的硫酸铵细粉末,使硫酸铵的饱和度达30%,缓慢搅拌混合2h后,在4℃、12000r/min条件下离心15min,弃去沉淀留取上清夜。继续添加硫酸铵粉末至上清液中硫酸铵饱和度达90%,4℃静置12h后,在4℃、12000r/min条件下离心15min,弃去上清液,用少量0.1mmol/L磷酸盐缓冲液溶解沉淀,于4℃条件下保存备用。
1.2.3 透析
将经过盐析后的浓缩粗酶液置于透析袋中,在4℃缓慢透析24h,透析缓冲液为蒸馏水。用1%BaCl2溶液检查硫酸铵是否透析完毕。
1.2.4 乳糖酶活力的测定
以ONPG为酶作用底物,参照文献[12]并做适当修改。取0.5mL稀释后的酶液,37℃水浴5min,加入已预热至37℃的含5mmol/L ONPG磷酸盐缓冲液(pH 6.5)1.5mL,37℃水浴反应10min,然后立即加入3.0mL 0.5mol/L Na2CO3终止反应,于波长420nm处测定OD值,测定3次取平均值。以加热失活的酶液作为空白。一个酶活力单位定义(U)为:在37℃每分钟水解释放1μmol ONP所需的酶量。
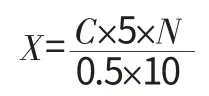
式中:X 为乳糖酶活力;C 为标准曲线上对应的ONP浓度;N 为稀释倍数。
1.2.5 蛋白含量的测定
酶液中粗蛋白含量的测定采用考马斯亮蓝法[13]。
(1)标准曲线的绘制:取6支试管,分别加入0.1mg/mL的牛血清白蛋白标准溶液样品0.0mL、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL,然后用离子水补充到1mL,最后各试管中分别加入5.0mL考马斯亮蓝G250试剂。每加完一管,立即盖塞轻摇试管使之混合,静置显色10min,于波长595nm处测定吸光度值。
(2)酶液测定:取1mL稀释后的酶液,加入5mL考马斯亮蓝G250试剂,静置显色10min,于波长595nm处测定吸光度值,计算蛋白含量。

式中:A 为根据标准曲线计算出的蛋白含量,mg;C 为测定时所用酶液体积,mL;D 为酶液稀释倍数。
1.2.6 最适作用温度
底物ONPG溶液分别在30℃、35℃、40℃、45℃、50℃、55℃、60℃保温5min。酶液适当稀释后35℃保温5min,在不同温度分别加入ONPG溶液中,测定酶活,以获得的最高酶活为100%。
1.2.7 热稳定性
酶液分别在35℃、40℃、45℃、50℃保温10min、20min、30min、40min、50min、60min后,测定酶活,以未保温酶液的酶活为100%。
1.2.8 最适作用pH值
ONPG分别用pH值为4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9的缓冲液配制后,测定酶活,以获得的最高酶活为100%。
1.2.9 pH值稳定性
将酶液分别置于pH值为4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9的缓冲液中,室温静置18h,用缓冲液调至最适pH值,分别测定酶活,以获得的最高酶活为100%。
1.2.10 金属离子酶活力的影响
用浓度为1mmol/L、5mmol/L、10mmol/L的Na+、K+、Mg2+、Ca2+、Fe2+、Zn2+、Mn2+、Cu2+溶液处理酶液,在室温放置40min,测定乳糖酶活力,以未添加金属离子酶液的酶活为100%。
1.2.11 乳清水解试验
Enterobactersp.SYA2乳糖酶在40℃保温10min,选择加酶量为1Um/L和2Um/L(ONPG单位),在40℃水解乳糖,以乳糖水解率表示该酶的水解率。乳清中乳糖含量和葡糖糖含量的测定方法参照GB/T5009.7-2003。

1.2.12 数据处理
用统计分析软件SPSS15.0对试验数据进行统计和分析。
2 结果与分析
2.1 硫酸铵分级沉淀
盐析法是粗分离蛋白质的重要方法之一。当高浓度盐存在时,一方面大量的水同盐分子结合,使蛋白质没有足够的水维持溶解状态,从而破坏了维持蛋白质亲水胶的水膜,蛋白容易沉淀出来;另一方面加入的盐离子中和了蛋白质分子表面的极性基团所带的电荷,减少了蛋白质分子间的相互排斥力,蛋白质分子相互碰撞发生聚集沉淀。一般而言,硫酸铵沉淀只是用于蛋白质的初步纯化,纯化效果有限,但有利于酶液浓缩,以便于后续操作,所以一般选取较宽的硫酸饱和度范围,以保证较高的回收率。

图1 硫酸铵沉淀上清液中乳糖酶酶活的变化曲线Fig.1 Activity of lactase in supernatant during ammonium sulphate precipitation
硫酸铵分级沉淀过程中上清液中酶活力的变化情况见图1,当硫酸铵饱和度小于50%时,上清液中酶活力变化不明显,表明在此饱和浓度下酶蛋白仅有少量沉淀。随着硫酸铵饱和的的继续增加,上清液中酶活力迅速下降,当硫酸铵饱和度至85%时,上清液中基本已经没有酶液,此时酶蛋白已经基本沉淀完全。因此,本试验选取分级沉淀硫酸铵饱和度为30%和85%。
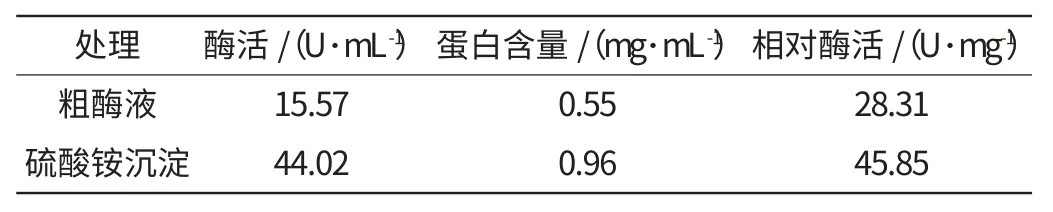
附表 Enterobacter sp.SYA2 乳糖酶硫酸铵沉淀试验结果Attached table Ammonium sulphate precipitation of lactase produced by f Enterobacter sp.SYA2
由附表可以看出,Enterobactersp.SYA2乳糖酶粗酶液在未经硫酸铵分级沉淀前,相对酶活为28.31 U/mg,而经硫酸铵沉淀后相对酶活达45.85 U/mg,说明硫酸铵对酶液起到一定的浓缩作用。
2.2 最适作用温度
温度是影响酶活性的主要因素之一,通常情况下各种酶都会有其最适作用温度,在此温度下酶的活力最高。如果温度太高会影响酶蛋白的次级键,使蛋白质变性,降低其酶活性;温度过低,不利于酶的反应进程。
由图2可知,Enterobactersp.SYA2乳糖酶活性在40℃以下时随温度的升高而上升,高于45℃之后酶活开始下降,表明其最适作用温度范围为40℃~45℃,其最适作用温度较低,在60℃时酶活很低,只有最适酶活的26.97%。根据文献报道,该酶最适作用温度与乳酸克鲁维酵母和脆壁克鲁维酵母乳糖酶的最适作用温度相近[1,14]。主要是由于高温使酶蛋白分子中的氢键、离子键等非共价键的断裂,从而破坏了酶蛋白的天然构像降低酶活性。
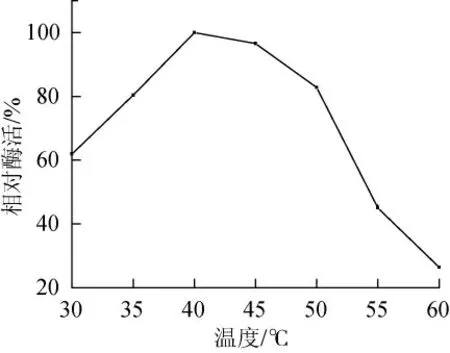
图2 Enterobacter sp.SYA2乳糖酶最适作用温度Fig.2 Optimum temperature of Enterobacter sp.SYA2 lactase
2.3 热稳定性
一般来说,温度越低酶稳定性越好,温度越高其热失活越快。所以在酶蛋白大都需要贮存在较低的温度条件下。

图3 Enterobacter sp.SYA2乳糖酶的热稳定性Fig.3 Thermostability of Enterobacter sp.SYA2 lactase
由图3可知,Enterobactersp.SYA2乳糖酶在不同温度保温10min~60min,酶活基本呈现下降趋势。40℃保温60min酶活低于对照酶活,45℃保温40min酶活低于对照酶活,而50℃保温30min酶活低于对照酶活。据报道,Kluyveromyces marxianusSK 16.001在20℃~45℃的范围内保温30min,酶比较稳定,当温度高于50℃,酶活损失严重[15]。说明Enterobactersp.SYA2乳糖酶与Kluyveromyces marxianusSK 16.001乳糖酶一致,均属于中温乳糖酶。
2.4 最适作用pH值
pH值是影响酶活性的主要因素之一,酶蛋白分子中具有许多极性基团,在不同pH值的溶液中,只有酶蛋白处于解离状态时,酶才能与底物结合,发挥其催化作用。最适pH值的微小偏离,由于使酶活性部位的基团离子化发生变化,而降低酶的活性。pH值发生较大偏离时,维护酶三维结构的许多共价键受到干扰,导致酶蛋白自身变性。底物pH值对乳糖酶的活性有重要影响,在一定的pH值范围内,酶表现出较高的活性,pH值过高或过低都会影响酶的构象,从而影响酶与底物的结合能力[16]。
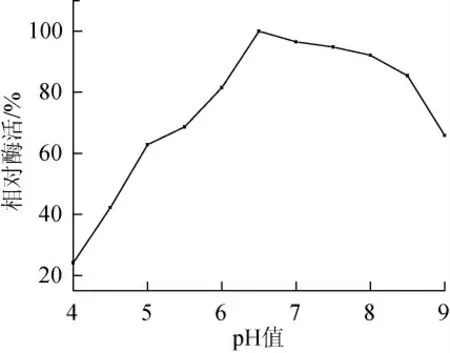
图4 Enterobacter sp.SYA2乳糖酶最适作用pH值Fig.4 Optimum pH o of Enterobacter sp.SYA2 lactase
由图4可以看出,Enterobactersp.SYA2乳糖酶的最适作用pH值为6.5,酶活在pH6.0~8.5范围内表现出较高的酶活性,pH值超过8.5酶活降低,主要原因是由于酸碱的变化影响酶蛋白活性中心氨基酸残基的解离情况所引起的。文献报道,黑曲霉乳糖酶的最适作用pH值为4.0,作用pH值范围为2.5~6.5,而芽孢杆菌EW-220的最适反应pH值与本研究一致为6.5[17-18],说明真菌乳糖酶的pH值作用范围偏酸性,而细菌乳糖酶的pH值作用范围近中性。
2.5 pH值稳定性
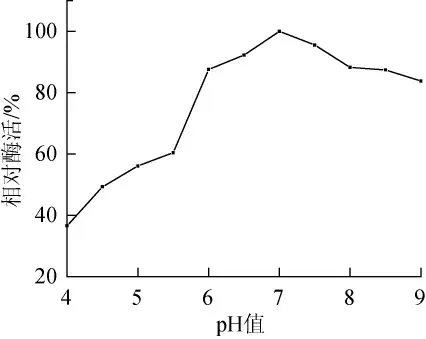
图5 Enterobacter sp.SYA2乳糖酶pH稳定性Fig.5 p H stability of Enterobacter sp.SYA2 lactase
由图5可以看出,Enterobactersp.SYA2乳糖酶在37℃时pH值为4.0~5.5时酶活较低,在6.0~8.5时表现出较高的稳定性和酶活力,当pH值大于8.5时酶活有下降趋势。与不同最适作用pH值范围相似,不同菌株乳糖酶的最适pH值稳定性不同。黑曲霉乳糖酶在pH值2.5~7.0范围内表现出较高的稳定性,而芽孢杆菌EW-220乳糖酶在55℃时pH值的稳定范围为5.5~8.0[17-18]。
2.6 金属离子对酶活的影响
金属离子对酶活的影响主要有激活作用和抑制作用2种类型。一般而言,金属离子与酶蛋白结合后可以作为辅酶,起到激活作用;相反,受化学物质的影响,酶的必须基团或活性部位的生物化学特性改变,从而导致酶活力的降低或丧失就会引起抑制作用。
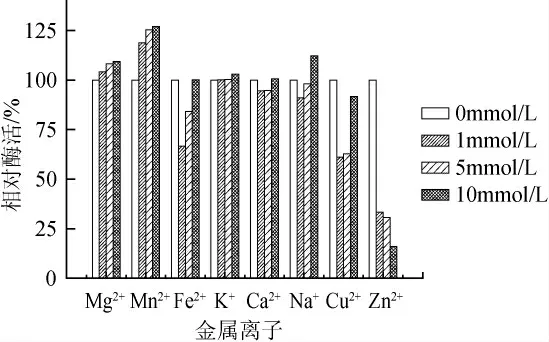
图6 不同金属离子对Enterobacter sp.SYA2乳糖酶酶活影响Fig.6 Effects of metal ions on the activity of Enterobacter sp.SYA2 lactase
不同金属离子对Enterobactersp.SYA2乳糖酶活的影响见图6,Mg2+、Mn2+对酶活有明显的激活作用;Na+在高浓度条件下对酶活有一定的激活作用,在低浓度条件下对酶活影响不显著;Zn2+、Cu2+、Fe2+对酶活有抑制作用;K+、Ca2+对酶活作用不显著。据报道,不同金属离子对不同菌株乳糖酶的作用不同,其中,Mg2+、Mn2+、K+是常见的酶激活剂[19-20]。
2.7 乳清水解实验
Enterobactersp.SYA2乳糖酶在35℃~45℃范围内酶热稳定性较好,最适温度为40℃,所以选择40℃保温水解乳清。乳清中初始乳糖含量为4.55g/100mL,乳糖水解率随水解时间的变化趋势见图7。
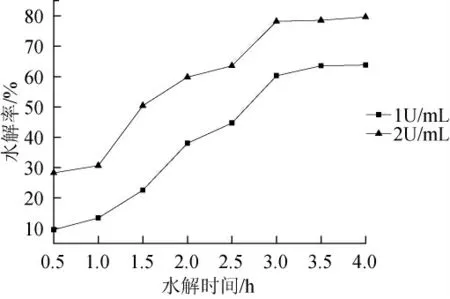
图7 乳清中乳糖水解曲线Fig.7 Hydrolysis of lactose in whey
由图7可看出,Enterobactersp.SYA2乳糖酶在40℃水解条件下水解乳清中乳糖,随着水解时间的延长,水解率几乎呈直线上升趋势。当酶添加量为1Um/L,3h的水解率可以达到50%,水解率到63%趋于平缓;酶添加量为2Um/L,1.5h水解率就可达50%,水解率到85%趋于平缓。在中性pH值范围内,该菌产生的乳糖酶不仅对底物ONPG有较高的水解能力,对乳糖的分解能力也较强,因此,可以将该酶应用到乳品工业中,对废弃物乳清进行处理加工。
3 结论
(1)经硫酸铵盐析分级沉淀试验,选取硫酸铵的饱和度30%~85%为分级沉淀操作条件,分级沉淀后测得Enterobactersp.SYA2乳糖酶的相对酶活为45.85 U/mg。
(2)Enterobactersp.SYA2乳糖酶的最适作用温度范围为40℃~45℃,该酶在35℃时相当稳定,在40℃处理时酶活损失不大,在45℃和50℃处理时酶活损失较大,说明该酶为中温乳糖酶。
(3)Enterobactersp.SYA2乳糖酶最适作用pH值为6.5,在pH 6.0~8.5范围内表现出较高的稳定性,说明该酶为中性乳糖酶。
(4)通过研究金属离子对Enterobactersp.SYA2乳糖酶的影响,可以得出Mg2+、Mn2+对酶活有明显的激活作用;Na+在高浓度条件下对酶活有一定的激活作用,在低浓度下对酶活影响不显著;Zn2+、Cu2+、Fe2+对酶活有抑制作用;K+、Ca2+对酶活作用不显著。
(5)Enterobactersp.SYA2乳糖酶在40℃水解条件下水解乳清中乳糖,当酶添加量为1Um/L,3h的水解率可以达到50%,水解率到63%趋于平缓;酶添加量为2Um/L,1.5h水解率就可达50%,到85%趋于平缓。
[1]张明丽,熊 华,齐金峰,等.乳酸克鲁维酵母乳糖酶性质的研究[J].中国乳品工业,2008,36(1):7-9.
[2]ROLLINI M,TRINETTA V,MUSATTI A,et al.Influence of substrate onβ-galactosidase production byKluyveromycesstrains[J].Annal Microbiol,2008,58(4):705-710.
[3]欧 军,李 威,梁金钟,等.米曲霉生产乳糖酶发酵条件的研究[J].乳业科学与技术,2008(3):110-114.
[4]XIA Y,ZHAO J,CHEN H,et al.Extracellular secretion inBacillus subtilisof a cytoplasmic thermostableβ-galactosidase fromGeobacillus stearothermophilus[J].Dairy Sci,2010,93(7):2838-2845.
[5]CHEN W,CHENH,XIA Y,et al.Production,purification and characterization of a potential thermostable galactosidase for milk lactose hydrolysis fromBacillus stearothermophilus[J].Dairy Sci,2008,91(5):1751-1758.
[6]付金衡,许 杨,孙红斌.乳酸菌产乳糖酶的培养条件研究[J].食品科学,2006,27(12):545-549.
[7]IBRAHIM SA,SULLIVAND.Useof Chemical mutagenesisfor the isolation of food gradeβ-Galactosidase overproducing mutants ofBifidobacteria,LactobacilliandStreptococcus thermophilus[J].Dairy Sci,2000,83(5):923-930.
[8]SØRENSEN HP,PORSGAARD TK,KAHN RA,et al.Secretedβ-galactosidasefrom aFlavobacteriumsp.Isolated from alow-temperatureenvironment[J].Appl Microbiol Biot,2006,70(5):548-557.
[9]张红艳,刘成更,等.乳糖酶的酶学特性及其研究进展[J].食品研究与开发,2004,25(6):34-36.
[10]宋 曦,甘伯中,贺晓玲,等.天祝放牧牦牛生活环境土壤中一株产凝乳酶细菌的分离与鉴定[J].食品科学,2009,30(11):158-162.
[11]巨 蕾,梁 琪,乔海军,等.甘南牧区牦牛乳酸奶中产乳糖酶菌株的筛选、鉴定及产酶条件研究[J].食品工业科技,2012(12):239-254.
[12]ALAZZEH A Y,IBRAHIM SA,SONG D,et al.Carbohydrateand protein sourcesinfluencetheinduction ofα-andβ-galactosidasesinLactobacillusreuteri[J].Food Chem,2009,117(4):654-659.
[13]BRADFORD M M.A rapid and sensitive method for thequantitation of microgram quantities of protein utilizing the principle of protein dye binding[J].Anal Biochem,1976,72:248-254.
[14]谭树华,HADEEL A A M,高向东,等.脆壁克鲁维酵母乳糖酶提取物性质研究[J].药物生物技术,2000,7(3):153-156.
[15]剧淑君.β-D-半乳糖苷酶发酵生产、分离纯化和性质研究[D].无锡:江南大学硕士论文,2011.
[16]张福新.不同因素对羔羊皱胃酶凝乳酶活性的影响[J].农业工程学报,2001,7(4):111-114.
[17]李兴峰.乳糖酶高产菌株分离筛选、发酵产酶及酶学性质的研究[D].保定:河北农业大学硕士论文,2004.
[18]王 兰.耐热的β-半乳糖苷酶产生菌株EW-220的分离、鉴定及发酵产物性质的初步研究[D].成都:四川大学硕士论文,2005.
[19]母智森.乳糖酶高活力菌株的筛选及酶的特性研究[D].呼和浩特:内蒙古农业大学硕士论文,2002.
[20]史应武,娄 恺,常 玮,等.一株产高温β-半乳糖苷酶低温菌株及其酶学性质研究[J].食品与发酵工业,2007,33(2):56-58.

