舒马曲坦胶囊的制备与质量控制*
张敬如,赵 凯,黄复生,王 昆
(中国人民解放军第三军医大学基础部病原生物学教研室,重庆 400038)
偏头痛是一种慢性神经血管紊乱性疾病,全球发病率约为10%~15%,随着生活节奏的加快和工作压力的加大,发病率呈上升趋势。舒马曲坦为选择性5-羟色胺(5-HT)受体激动剂,为目前治疗偏头痛的首选药。舒马曲坦目前已开发出包括皮下注射剂、鼻用气雾剂、直肠用栓剂和口服片剂等多种给药剂型。与口服制剂相比,虽然皮下注射剂和鼻用气雾剂起效快,但价格昂贵,同时注射用药因副作用较大,适用范围较小。因此目前临床应用最广泛的仍然是口服制剂。舒马曲坦口服吸收差,生物利用度低,仅为14%[1],舒马曲坦原料药昂贵,口服用药时剂量相对较大,这不仅增加了用药成本,且易产生不良反应,故一定程度上限制了其临床应用。本研究所制备的胶囊利用磷脂作为辅料,利用优化的冻干技术制成三维结构良好的磷脂舒马曲坦冻干产品,将可能有效改善口服生物利用度,减少用药剂量的同时降低用药成本和不良反应。本试验对舒马曲坦胶囊的制备及质量控制作了较系统的研究,旨在为开发新药提供依据。
1 仪器与试药
色谱系统:Waters 515型高效液相色谱仪泵,Waters2487型紫外检测仪,Sartorius电子天平(德国);Millipore Simiplicy 185纯水仪(法国)。舒马曲坦标准品(美国Sigma公司);舒马曲坦原料药(广州市亿邦医药科技有限公司);磷脂(德国LIPOID公司惠赠),甲醇(色谱纯,美国),磷酸二氢钾,磷酸氢二钠,乳糖,乙醇(分析纯,重庆东方化学试剂厂)。
2 方法与结果
2.1 处方与制备
处方:舒马曲坦200 mg,乳糖2.5g,磷脂1.5g,乙醇5mL,磷酸缓冲液50mL,共制胶囊50粒。
制备:称取适量磷脂和舒马曲坦用乙醇充分溶解,加入用缓冲液溶解的乳糖混匀,在一定温度下高速搅拌,充分水化。将制得的样品经高压均质机处理,用0.45mm滤器过滤,得到一定粒径范围、均匀的磷脂复合物,分装,真空冷冻干燥。冻干后样品粉碎,过筛,加入相同质量微晶纤维素,混匀,分装至胶囊壳,即可。
2.2 性状
本品为胶囊剂,内容物为乳白色粉剂。
2.3 检查
参照[2005年版《中华人民共和国药典(一部)》附录ⅠL]胶囊剂通则项下要求制订本品的检查项目[2]。水分:取供试品3批,每批10粒,依法检测[2],平均含水量为1.7%。装量差异:取供试品3批,每批10粒,依法检测[2],装量差异在±5%范围内,符合要求。崩解时限:取供试品3批,每批6粒,依法检测[2],平均崩解时间为10.5min。微生物限度:按照[2005年版《中华人民共和国药典(一部)》附录ⅩⅢC[2]项下步骤及原则执行,符合要求。
2.4 含量测定
2.4.1 色谱条件与系统适用性试验
色谱柱:Alltech ODSC18柱(250mm×4.6mm,5μm);流动相:0.04 mol/L磷酸二氢钾(pH=6.1)-甲醇(62∶38);流速:1.0mL/min;紫外检测波长:228 nm;进样量:20 mL;灵敏度:0.005 AUFs。在此条件下,色谱图见图1。舒马曲坦峰保留时间大约为7.7 min,与其相邻的杂质峰的分离度为2.5。
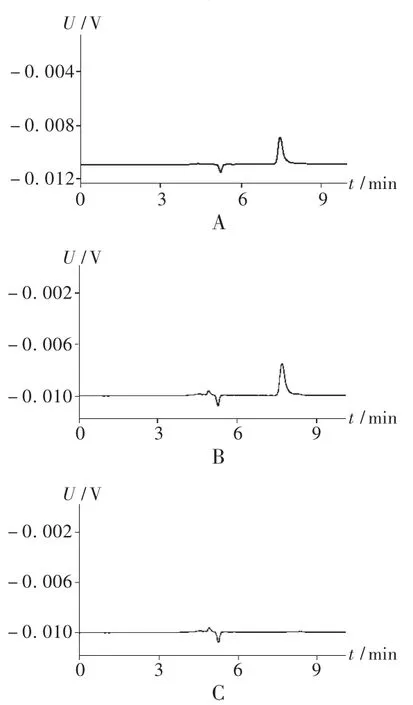
图1 高效液相色谱图
2.4.2 溶液制备
称取16mg舒马曲坦标准品,精密称定,置100mL容量瓶中,加甲醇溶解并稀释至刻度,摇匀,作为贮备液。精密吸取上述溶液1mL,置50mL容量瓶中,加流动相稀释至刻度,摇匀,作为标准品溶液(每1mL含3.2mg舒马曲坦)。取舒马曲坦胶囊(每粒含舒马曲坦4 mg)5粒,取出内容物,用甲醇20 mL溶解,经0.45μm微孔滤膜过滤;精密吸取续滤液1mL置100mL容量瓶中,加流动相溶解并稀释至刻度,摇匀;精密吸取上述溶液2 mL置100 mL容量瓶中,加流动相溶解并稀释至刻度,摇匀,作为供试品溶液。根据处方制备不含舒马曲坦的胶囊作为空白样品,再按供试品溶液制备方法制备空白样品溶液。
2.4.3 方法学考察
标准曲线绘制:将标准品溶液用流动相倍比稀释,配置为1 600,800,400,200,100,50 ng/mL的舒马曲坦溶液,按拟订的色谱条件进样测定,记录峰面积。以峰面积为纵坐标、相应质量浓度为横坐标进行线性回归,得回归方程 Y=341.44X+2 292.6,r= 0.999 9(n=6)。结果表明,舒马曲坦质量浓度在50~1 600 ng/mL范围内与峰面积有良好线性关系。
精密度试验:配制80,320,1 200 ng/mL(低、中、高)3种质量浓度舒马曲坦标准品溶液,进样20mL,连续进样6针,分别测定峰面积,计算日内精密度。另将上述3种质量浓度溶液每天进样1次,连续6 d,计算其日间精密度。结果日内精密度平均 RSD为2.20%(n=6),日间精密度平均 RSD为2.59%(n=6),表明方法的精密度较好。
重复性试验:取同一批样品5份,依法制备供试品溶液并分别进样,测定含量。结果舒马曲坦平均含量为99.3%,RSD为1.28%,表明本方法重复性较好。
稳定性试验:取同一供试品溶液,分别于0,2,4,6,8 h时进样测定含量。结果峰面积的 RSD为0.86%(n=5),表明供试品溶液在8 h内稳定。
加样回收试验:精密量取已知含量的供试品溶液,分别加入40,600,1 200 ng/mL 3种质量浓度的对照品溶液,依法测定含量,计算回收率。结果见表1。
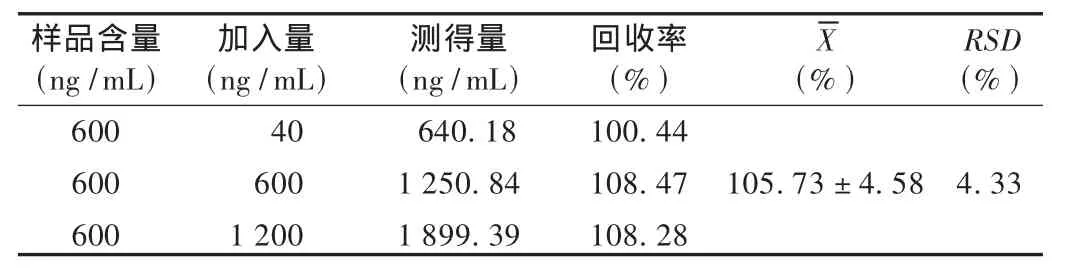
表1 舒马曲坦加样回收试验结果(n=6)
2.4.4 样品含量测定
取3批舒马曲坦胶囊,依法制备成供试品溶液,高效液相色谱法测定,每批样品平行测定3份。结果批号分别为110101,110102,110103的样品中舒马曲坦含量分别为标示量的97.85%,99.12%,98.36%。
2.5 制剂稳定性试验
将样品置室温(20±5)℃下,分别于0,24,48,72 h时观察其外观,并测定含量。结果显示各项指标均无变化。继续留样观察6个月,抽样检查质量,结果各项指标未见明显变化。
3 讨论
磷脂是一种含磷的类脂物质,作为药物辅料可改善原有药物的亲脂性和(或)亲水性,可有效提高活性成分的体内吸收,获得较高的血药浓度,且体内消除较慢,不良反应低,从而显著改善药物生物利用度[3-4]。舒马曲坦水溶性差,生物利用度低,将其与磷脂在一定条件下复合,有可能促进舒马曲坦在体内的吸收,提高药效。
应用高效液相色谱法检测舒马曲坦,文献中涉及检测波长有225[5],228[6],282.7 nm[7]等,本研究应用紫外分光光度仪对标准品和供试品溶液在200~400 nm波长范围内进行扫描,发现舒马曲坦在228 nm和282 nm波长处有吸收峰,因此检测波长选择为228 nm。
[1]Fowler PA,Lacey LF,Keene ON,et al.Effects of prophylacticmigraine medications on the pharmacokinetic and pharmacodynamic profiles of sumatriptan[J].Cephalalgia,1991,11(1):228-229.
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2005:附录10,附录47,附录62,附录70.
[3]Sabrinag,Danielag,Patrizia A,et al.Silybin and its bioavailablephospholipid complex(IdB 1016)potentiate in vitro and in vivo the activity of cisp latin[J].Life Sciences,2002,70(12):1 447-1 459.
[4]吴忠斌,郭 丹,陈建明.依托泊苷磷脂复合物的制备及理化性质研究[J].中国新药杂志,2009,18(13):1 250.
[5]Ge Z,Tessier E,Neirinck L,et al.High performance liquid chromatographicmethod for the determination of sumatriptan with fluorescence detection in human plasma[J].JChromatogr B,2004,806(2):299-303.
[6]Nozal MJ,Bernal JL,Toribio L,et al.Development and validation of an LC assay for sumatriptan succinate residues on surfaces in themanufacture ofpharmaceuticals[J].JPharm Biomed Anal,2002,30(2):285-291.
[7]Femenia Font A,Merino V,Rodilla V,et al.High-performance liquid chromatographic determination of sumatriptan after in vitro transdermal diffusion studies[J].JPharm Biomed Anal,2005,37(3):621-626.

