Mo-Bi系复合氧化物催化剂中Cs对异丁烯选择氧化制甲基丙烯醛的影响
李静霞,汪国军,郭杨龙,陈庆龄
(1.中国石油化工股份有限公司上海石油化工研究院,上海 201208; 2.华东理工大学化工学院,上海 200237)
异丁烯选择性氧化制甲基丙烯酸甲酯(MMA)反应为两步串联,先是异丁烯氧化制甲基丙烯醛(MAL),后甲基丙烯醛进一步氧化酯化生成甲基丙烯酸甲酯,而其中两段催化剂的研究是异丁烯氧化法制备甲基丙烯酸甲酯研究的重点[1-5]。1946年Shell公司首先发现Cu2O催化剂能催化氧化不饱和烯烃,如丙烯和异丁烯等,因此Cu2O成为异丁烯选择氧化制MAL反应研究最早的催化剂。60年代初期,随着Mo-Bi催化剂在丙烯制丙烯腈工业上的应用,标准石油公司、日本旭化成、日本触媒和日本三菱等公司先后将Mo-Bi系多组分复合氧化物催化剂应用于异丁烯选择氧化反应中,催化剂体系包括Mo-Bi-P、Mo-Bi-U、Mo-Bi-Fe-Co、Mo-Bi-W-Fe-Co等。1982年,日本触媒和日本三菱先后实现了Mo-Bi-Fe-Co系多组分复合氧化物催化剂在异丁烯/叔丁醇制MMA工艺上的工业化应用。目前用于该段反应的催化剂主要以钼铋复合金属氧化物体系为主,并添加铁、钴和碱金属等助剂提高反应的选择性和稳定性。碱金属作为助剂在提高烯烃选择性方面的作用在一些反应中都有研究[6-9],如丙烯氨氧化反应和丙烷选择性氧化反应等。一般认为,添加比例很小的碱金属助剂的作用在于它能作用于催化剂的酸性活性中心,抑制深度氧化反应,从而提高反应的选择性。张明森等[6]研究了碱金属对Mo-Bi-Fe系复合氧化物催化剂的影响,研究发现,碱金属的加入能显著提高低温区的反应活性,目标产物的选择性和收率也大幅度提高。田伟等[7]通过研究同样发现Cs的加入能够有效提高催化剂的选择性,但由于催化剂体系复杂,对于碱金属Cs的加入量以及催化剂表面的酸碱性与催化活性的关联并没有进一步探讨。本研究通过X射线衍射(XRD)、激光拉曼(Raman)、吡啶吸附红外光谱(Pyridine-FT-IR)和N2物理吸附(BET)等表征手段对碱金属Cs修饰的Mo-Bi系催化剂的物理化学性质进行了表征,详细探讨了Cs组分对复合氧化物催化剂的物相和酸碱性及其在异丁烯氧化制甲基丙烯醛反应中的影响。
1 实验部分
1.1 催化剂制备
催化剂的制备方法均采用共沉淀方法:首先将需量的钼酸铵溶解在定量的水中,并加入占最终氧化物重量比20%的质量分数为30%的硅溶胶,形成溶液A;将催化剂制备过程中所需要的硝酸铋、硝酸铁、硝酸钴、硝酸镁和硝酸铯等硝酸盐溶解在水中,形成溶液B;将溶液B在剧烈的搅拌下滴加入溶液A中形成催化剂浆料,搅拌陈化,在80 ℃下干燥6 h,500 ℃焙烧2 h,得到的催化剂经过研磨后筛选出350~700 μm目颗粒待用。按元素物质的量比表示的催化剂组成为:Mo12Bi1.5Fe2.5Co1.5Mg1.0Csx,其中Cs的含量为0,0.3,0.5,1.0,1.5,2.0,分别记为Cat-1,Cat-2,Cat-3,Cat-4,Cat-5,Cat-6。
1.2 催化剂活性评价
制备的催化剂在固定床反应器上考评,反应器内径6 mm,长320 mm,催化剂装填量2.0 g。原料气异丁烯、空气和水的体积比为1:12:2。反应的产物采用气相色谱进行分析,氢火焰检测器和热导池检测器用于产物中有机物和无机物的检测。
1.3 催化剂表征
样品物相采用德国Bruker D8 Advance型X射线衍射仪分析,Cu靶X光发生器,扫描范围5~80o,扫描速率5 (o)/min。激光拉曼测试在法国Lab Ram型共焦显微激光拉曼光谱仪上进行,激发光为He-Ne激光,波长为632.8 nm,功率为3.0 mV,分辨率1 cm-1; 样品表面酸碱部位类型的测定以吡啶为探针分子,在德国Thermo Fisher公司的Nicolet380 红外光谱仪上进行,MCT检测器。样品的比表面、孔体积和孔分布在美国麦克仪器公司ASAP2020M型物理吸附仪上由氮吸附分析,操作温度-196 ℃,催化剂的比表面积和孔分布根据Brunauer-Emmett-Teller(BET)和Barret-Joyner-Halenda(BJH)模型分别进行计算。
2 结果与讨论
2.1 X射线衍射及激光拉曼
图1为Mo12Bi1.5Fe2.5Co1.5Mg1.0Csx系列催化剂经过500 ℃焙烧后的XRD谱图。从图1中可以看到,催化剂中加入碱金属Cs后,组成催化剂的主要晶相没有发生改变,均由CoMoO4、MgMoO4和Bi3FeMo2O12等晶相组成。由于催化剂中加入碱金属Cs的含量较低,因此加入的Cs主要是分散或以固溶体的形式存在于催化剂中。
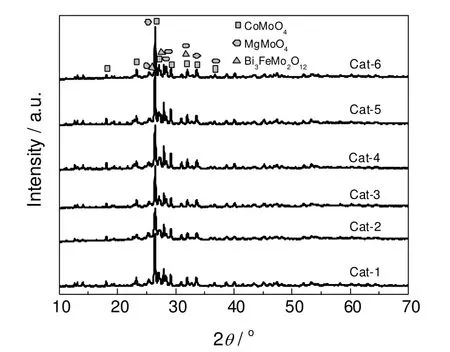
图1 不同Cs含量催化剂的XRD 图谱Fig.1 XRD patterns of catalysts with different Cs content
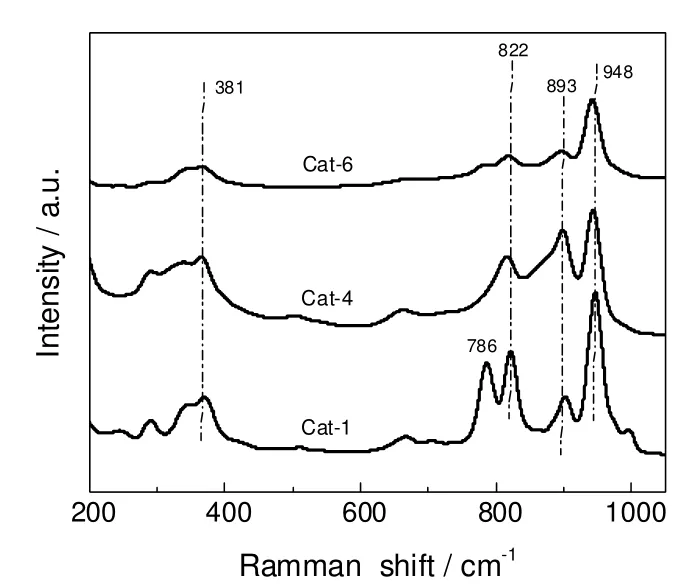
图2 不同Cs含量催化剂的Laman图谱Fig.2 Laman patterns of catalysts with different Cs content
图2分别为Cat-1,Cat-4和Cat-6复合氧化物催化剂拉曼图谱。其中948,893,822和786 cm-1左右的拉曼峰均可归属于Mo═O的对称或反对称伸缩振动峰,而381 cm-1附近的峰可能归属于M(Bi)―O的振动峰以及Mo―O―Mo的变形振动峰。组分Cs加入后,所有样品中的拉曼峰并未发生明显的位移,表明Mo═O,M(Bi)―O,Mo―O―Mo均存在于测试的样品中。但比较948,893,822和786 cm-1处拉曼峰的强度,Cs组分加入后以上峰的强度则明显减弱,表明Mo═O键强度的减弱[8-9]。
异丁烯分子与丙烯分子相比多了个甲基,反应不易控制,反应机理方面研究难度大,但一般认为,异丁烯氧化与丙烯氧化在化学反应途径上是相通的。由于异丁烯氧化研究较少,因此可从丙烯氧化反应的研究中推测催化剂中Mo═O键在异丁烯选择氧化中的作用。Keulks等[12]综述了丙烯选择氧化的机理,认为吸附丙烯分子的活化包括脱除α―H和形成烯丙基中间体。Adams等[13]将动力学中同位素效应测定方法用于研究丙烯催化氧化过程中C―H键断裂反应,研究表明Mo═O是烯烃的化学吸附位,即具有空d轨道的Mo6+作为电子受体活性中心是吸附异丁烯的活性位。如吸附异丁烯的能力较强,则产物来不及脱附易于发生平行副反应和深度氧化,生成CO2和CO等副产物。因此Cs组分加入后的Mo12Bi1.5Fe2.5Co1.5Mg1.0Csx催化剂中Mo═O键能的减弱,部分削弱了对异丁烯的强吸附能力,有利于防止副反应和深度氧化反应发生。
2.2 红外吡啶吸附
烯烃的选择催化氧化反应,与催化剂表面的酸碱性有直接关系[12,13],为了进一步说明碱金属的加入对催化活性的影响,以吡啶为探针分子,利用红外光谱研究催化剂的酸性,表征催化剂表面的酸中心的量以及酸中心的类型(L酸、B酸)。图3分别为Cat-1以及Cat-4两种催化剂的吡啶吸附红外谱图。图3中分别在1 450,1 540和1 610 cm-1处出现特征吸收峰,其中1 450 cm-1和1 610 cm-1处的吡啶红外吸收峰可以归属于L酸,而1 540 cm-1处的吸收峰则归属于B酸。Cat-1催化剂表面主要存在L酸中心,而当催化剂中加入Cs后,催化剂表面的L酸中心量明显减少。
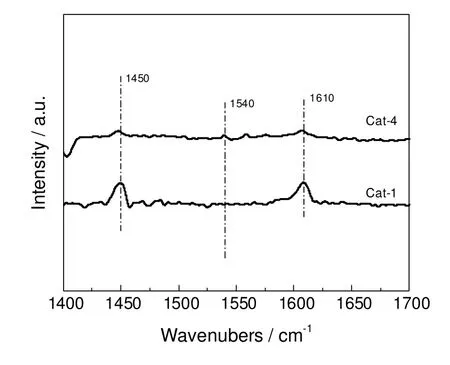
图3 Cat-1和Cat-4催化剂的吡啶红外图谱Fig.3 FT-IR spectra of pyridine adsorbed on Cat-1 and Cat-4 catalysts
从分子结构的角度分析,异丁烯分子具有两个等同的供电子甲基,具有弱碱性,在选择氧化过程中,生成的产物较难控制,副产物较多。当催化剂表面具有较多的酸中心存在时,具有弱碱性的异丁烯分子在催化剂表面的酸中心吸附,易导致深度氧化的发生,产生小分子醛、酸、CO和CO2等副产物。因此在Mo12Bi1.5Fe2.5Co1.5Mg1.0催化剂中,加入Cs组分,能够有效地降低催化剂表面酸中心的量,抑制平行副反应以及深度氧化的发生,提高目标产物的收率。
2.3 N2物理吸附
对该系列催化剂的比表面积、孔容和孔径进行BET表征,结果见表1。
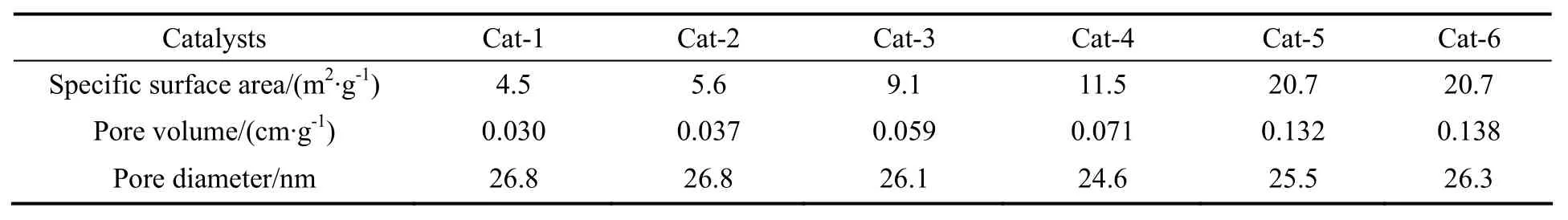
表1 催化剂结构参数Table 1 Structure parameters of different catalyst
由表1中数据可知,催化剂中Cs组分的增加使得催化剂的比表面积以及孔容明显增加。碱金属对催化剂物理结构的影响可能是具有较大离子半径的Cs加入催化剂中后可阻止催化剂在焙烧过程中结构的剧烈塌陷。在催化反应中,一般认为较大的比表面积能够提供更多的活性中心,使得反应物异丁烯与催化剂表面活性位接触的机会增多,有利于反应活性的提高。同时,对于异丁烯选择氧化反应,反应副产物较多,较大的孔容也有利于反应分子与活性位接触后,反应产物的迅速扩散以及热量的迅速传递,抑制进一步深度氧化反应的发生。
2.4 Cs含量对异丁烯氧化制甲基丙烯醛反应的影响
在常压,反应温度为380 ℃,空速为1 000 h-1,C4=:Air:H2O的比值为1:12:2的反应条件下,具有不同Cs含量的Mo-Bi系催化剂在异丁烯氧化制甲基丙烯醛反应中的催化性能见图4。

图4 不同Cs含量对异丁烯氧化制甲基丙烯醛反应的影响Fig.4 Performance of catalysts with different Cs content for isobutylene selective oxidation
由图4(a)可见,当催化剂中Cs与Mo物质的量比小于1.0:12时,Cs含量的变化对异丁烯的转化率影响不大,但当催化剂中Cs与Mo物质的量比大于1.0:12时,异丁烯的转化率明显降低。由于Cs离子半径为167 pm,远大于Mo6+(25.5 pm)以及Bi3+(103 pm),因此Cs含量过高时,可能覆盖于催化剂活性中心,从而使异丁烯的转化率降低。
在催化过程中,异丁烯分子上存在两个等同α―CH3,使副反应与丙烯选择氧化相比,几率增加,选择性更难控制。图4(b)为催化剂应用于异丁烯选择氧化制甲基丙烯醛反应中不同产物的选择性。该反应中存在的其他副产物主要为丙烯醛(ACR)、丙烯酸(AA)、乙醛(ECL)、乙酸(ACA)、丙酮(ACT)、一氧化碳(CO)和二氧化碳(CO2)。主产物甲基丙烯醛和甲基丙烯酸的选择性随着Cs含量的提高而单调上升,而主要副产物COx的选择性则单调降低。当Cs与Mo物质的量比为1.0:12时,催化剂活性最高。由前述表征结果可得出Cs组分修饰的Mo-Bi系催化剂目标产物选择性的提高,主要归因于以下两点:首先由Laman光谱及吡啶红外表征可得,将Cs引入Mo-Bi系催化剂中后,催化剂中Mo═O键的强度减弱,表面L酸性中心强度降低,有利于抑制深度氧化反应的发生。其次BET结果显示,Cs的加入使得催化剂比表面积、孔容等增大,有利于产物分子和反应物分子的脱附扩散以及热量的传递,最终使目标产物的选择性得到有效提高。
2.5 反应条件的影响
为了进一步加深对催化剂性能的了解,以Cat-4为催化剂,考察了反应条件包括:反应温度、烯氧比和反应空速等对异丁烯氧化制甲基丙烯醛和甲基丙烯酸反应的影响。
2.5.1 反应温度的影响
图5为以Cat-4为催化剂时,反应温度对异丁烯氧化反应活性的影响。反应温度的提高可以明显加快反应速率,异丁烯的转化率随着反应温度的提高而单调上升。同时温度的增高也加快了深度氧化以及其它副产物生成的速率,从而使得COx的收率也明显提高。两个相反作用的结果使得目标产物甲基丙烯醛和甲基丙烯酸的收率具有最大值,即随着反应温度的提高,先上升后降低。因此优选出最佳温度在380 ℃时,反应活性最高。
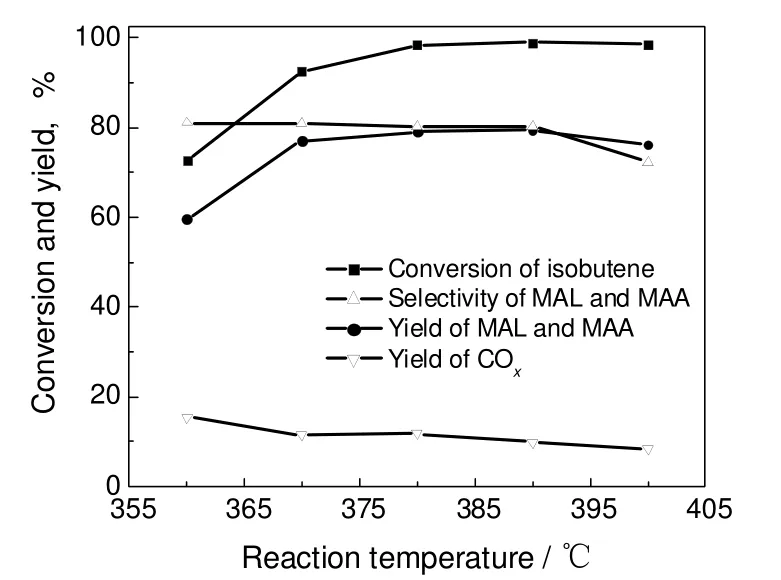
图5 反应温度对催化剂催化性能的影响Fig.5 Effect of reaction temperature on the catalytic performance
2.5.2 烯氧物质的量比的影响
常压下反应温度为380 ℃,空速为1 000 h-1,C4=:H2O为1:2的反应条件下烯氧比对反应活性的影响如表2所示。

表2 烯氧比对催化活性的影响Table 2 Effect of IB/air mole ratio on the catalytic performance
在以晶格氧控制的选择氧化反应中,反应气中氧组分的作用主要是对反应过程中被还原的活性组分进行再氧化,恢复催化剂中主要元素的氧化性能,补充晶格氧。同时另一方面,气相氧含量的提高使得异丁烯深度氧化为COx的反应速率提高。因此在异丁烯和空气的摩尔比为1:12时,甲基丙烯醛和甲基丙烯酸的选择性和收率最高。
2.5.3 反应空速的影响
空速对催化活性的影响可以从催化剂与反应物的接触时间考虑,空速较低时,反应气体与催化剂接触时间延长,反应产物不能及时扩散和转移从而发生再氧化反应,导致COx的增多。空速较高时,反应气体与催化剂接触时间缩短,催化剂中的晶格氧离子来不及迁移,导致反应的活性降低。在常压,反应温度为380 ℃,C4=:Air:H2O的值为1:12:2的反应条件下考察了空速的影响,结果见表3,可知最佳空速为1 000 h-1。

表3 空速对催化活性的影响Table 3 Effect of space rate on the catalytic performance
2.6 反应机理探讨
图6为异丁烯在Mo-Bi系催化剂上的选择氧化反应机理,由于异丁烯的氧化反应是在丙烯氧化反应的基础上发展起来的,因此反应机理相似,主要包括以下五个步骤[14]:1)催化剂中具有空d轨道的Mo元素为催化剂的Lewis酸中心,具有碱性的异丁烯分子在酸中心上吸附;2)与活性组分Mo相连的Bi上的O脱去异丁烯分子甲基上的H,形成类似于烯丙基的中间体;3)该中间体经过Mo═O的脱氢并插入晶格氧,生成甲基丙烯醛分子及水;4)产物从催化剂表面进行脱附;5)催化剂中被还原的活性位通过晶格氧氧化,恢复活性。
从反应机理可看出,异丁烯氧化第一步即是烯烃在催化剂表面的吸附。烯烃的给电子能力(碱性)以及氧化物的亲电子能力(酸性)均可以影响烯烃在催化剂表面的吸附[15-18]。金属氧化物表面的酸性强弱,可影响异丁烯以及产物的吸附强度,从而对催化剂的选择性产生影响。将Cs组分引入Mo-Bi体系催化剂后,催化剂中Mo═O键的强度减弱,表面的L酸性中心明显降低,更有利于产物脱附,抑制深度氧化反应的发生。同时BET结果显示,Cs的加入使得催化剂比表面积、孔容等增大,有利于产物分子和反应物分子脱附扩散以及热量的传递,最终使目标产物的收率得到有效提高。
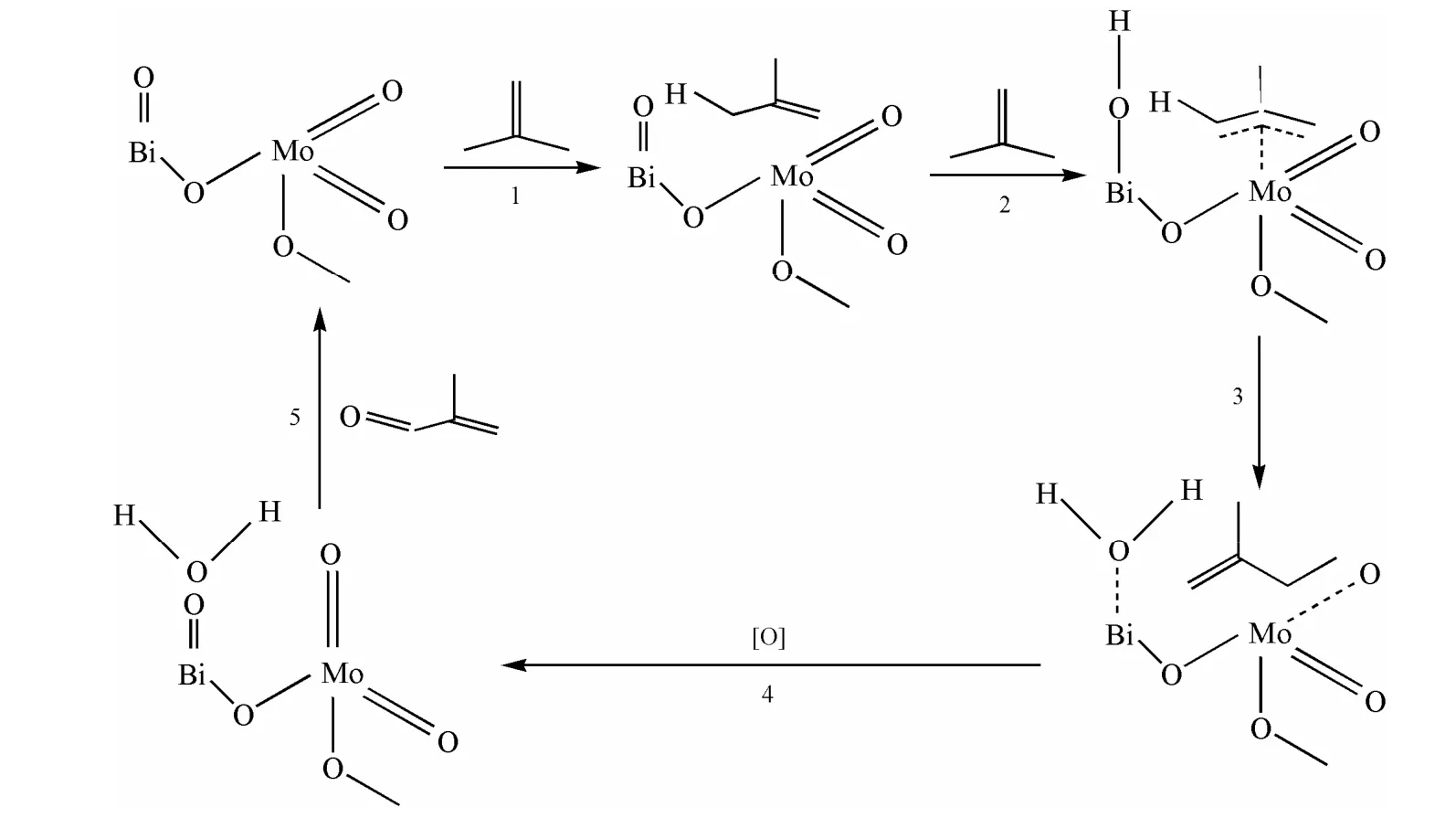
图6 异丁烯在Mo-Bi系催化剂上反应机理Fig.6 Reaction mechanism of isobutene on the Mo-Bi catalyst
3 结 论
研究了碱金属Cs组分对Mo-Bi系复合氧化物催化剂在异丁烯选择氧化制甲基丙烯醛反应中的影响,并对Cs的含量进行优化,通过表征研究发现,加入Cs组分后,催化剂中Mo═O键的强度减弱,削弱了对异丁烯的吸附能力,同时催化剂表面的L酸中心减少,降低了催化剂表面酸中心的量,有利于抑制深度氧化的发生。另外Cs的加入使得催化剂比表面积、孔容等增大,有利于产物分子和反应物分子脱附扩散以及热量的传递。确定了优化催化剂的反应条件:反应温度为380 ℃,异丁烯和空气物质的量之比为1:12,空速为1 000 h-1,异丁烯转化率可达98%左右,甲基丙烯醛和甲基丙烯酸收率约为80.0%。
[1] 马占镖. 甲基丙烯酸酯树脂及其应用 [M]. 北京: 化学工业出版社, 2002:1-30.
[2] 王继东, 程 佳. 甲基丙烯酸甲酯生产技术现状及市场分析 [J]. 精细与专用化学品, 2008, 16(15):11-17.Wang Jidong, Cheng Jia. The present production technology of MMA and its market analysis [J]. Fine and Specialty Chemicals, 2008,16(15):11-17.
[3] 杨学萍. 甲基丙烯酸甲酯生产工艺及技术经济比较 [J]. 化工进展, 2004, 23(5):506-510.Yang Xueping. Processes for the production of MMA and their techno-economic comparison [J]. Chemical Industry and Engineering Progress,2004, 23(5):506-510.
[4] 蔡 杰. 甲基丙烯酸甲酯市场现状及产业发展前景 [J]. 化学工业, 2009, 27(3):21-26.Cai Jie. MMA market situation and future development [J]. Chemical Industry, 2009, 27(3):21-26.
[5] 李 强, 王 蕾, 闫瑞一, 等. 异丁烯制备甲基丙烯醛催化剂的研究进展 [J]. 化学工业与工程, 2007, 24(5):433-438.Li Qiang, Wang Lei, Yan Ruiyi, et al. Process of catalysts for isobutylene to methacrolein [J]. Chemical Industry and Engineering, 2007,24(5):433-438.
[6] 张明森, 冯 静, 柯 丽, 等. 碱金属对Mo-Bi-Fe系复合氧化物催化剂的影响 [J]. 石油化工, 2004, 33(Z1):1191-1192.Zhang Mingsen, Feng Jing, Ke Li, et al. The effect of alkali metal on the Mo-Bi-Fe composite oxide catalyst [J]. Petrochemical Technology,2004, 33(Z1):1191-1192.
[7] 田 伟, 张海朗, 闫瑞一, 等. 异丁烯选择氧化制备甲基丙烯醛催化剂 [J]. 石油化工, 2008, 37(11):1133-1137.Tian Wei, Zhang Hailang, Yan Ruiyi, et al. Catalyst for selective oxidation of isobutylene to methacrolein [J]. Petrochemical Technology, 2008,37(11):1133-1137.
[8] 张 昕, 伊晓东, 毕 盈, 等. 丙烷选择氧化反应中钼基催化剂动态结果的研究 [J]. 催化学报, 2002, 23(2):191-194.Zhang Xin, Yi Xiaodong, Bi Ying, et al. Dynamic structure of molybdate-based catalyst for oxidative dehydrogenation of propane [J]. Chinese Journal of Catalysis, 2002, 23(2):191-194.
[9] 张 昕, 伊晓东, 毕 盈. 钼基催化剂氧化还原性质对丙烷选择氧化制丙烯醛的影响 [J]. 催化学报, 2002, 23(3):281-284.Zhang Xin, Yi Xiaodong, Bi Ying. Effect of redox properties on selective oxidation of propane to acrolein over molybdate-based catalyst [J].Chinese Journal of Catalysis, 2002, 23(3):281-284.
[10] Keulks G. Propylene oxidation:a model reaction for the selective oxidation of olefins [M]. United States: Division of Petroleum Chemistry,1987:191-197.
[11] Adams C R, Jennings T J. Mechanism studies of the catalytic oxidation of propylene [J]. Journal of Catalysis, 1964, 3(6):549-558.
[12] 尾崎萃. 催化剂手册 (按元素分类) [M]. 北京: 化学工业出版社, 1982:20-30.
[13] Uner D O. A sensible mechanism of alkali promotion in Fischer Tropsch synthesis:adsorbate mobilities [J]. Industrial and Engineering Chemistry Research, 1998, 37(6):2239-2245.
[14] Belgacem J, Kress J, Osborn J A. Catalytic oxidation and ammoxidation of propylene modeling studies on well-defined molybdenum complexes [J]. Journal of Molecular Catalysis, 1994, 86(1-3):297-285.
[15] Carrazan S R G, Martin C, Rives V, et al. Selective oxidation of isobutene to methacrolein on multiphasic molybdate-based catalysts [J].Applied Catalysis A-General, 1996, 135(1):95-123.
[16] Moro-oka Y. The role of acidic properties of metal oxide catalysts in the catalytic oxidation [J]. Applied Catalysis A-General, 1999,181(2):323-329.
[17] Akimoto M, Echigoya, E. Mechanism for incorporation of oxygen in vapor-phase selective oxidation of isobutene, butadiene and furan over various bismuth catalysts [J]. Journal of the Chemical Society-Faraday Transactions, 1979, 75:1757-1768.
[18] Keulks G W. Mechanism of oxygen atom incorporation into products of propylene oxidation over bismuth molybdate [J]. Journal of Catalysis,1970, 19(2):232-235.

