微波作用下的乙酸乙酯合成反应动力学
丁志伟,丁 辉,侯 钧
(天津大学化工学院,精馏技术国家工程研究中心,天津 300072)
微波已广泛应用于加速化学反应,但学术界对微波反应过程中的热效应与非热效应一直存在争议[1]。Ma[2]研究了微波辐射脱硫脱碳反应动力学,指出微波加速化学反应是因为产生了“局部热点”,体现了微波热效应。然而,Ergan[3]研究了微波作用下过硫酸钾水溶液分解动力学,指出微波改变了反应动力学,存在微波非热效应。
不同学者对微波动力学研究所得出的结论各不相同。一方面,多数研究者采用的微波发生源多由家用微波炉改装而来,这使得微波功率难以调控,且微波炉输出功率在零到最大功率之间周期变化,难以维持反应器恒温;另一方面,微波辐射下精确测温也一直困扰着微波化学反应动力学的研究者。为此,本研究自制了连续线性可调的微波反应装置,并配有显示精度为0.1 ℃红外测温仪,经精密温度计校正后,能满足微波测温要求。在此基础上,研究了微波作用下以NKC-9干氢催化树脂为催化剂催化合成乙酸乙酯的酯化反应动力学。尽管合成乙酸乙酯的动力学已有报道[4,5],但是他们研究的都是常规动力学,并且得到的动力学方程差别悬殊。本研究对比研究了该酯化反应微波与常规动力学,以期从本征动力学的对比来考察微波辐射效应对反应动力学的影响。
1 实验部分
1.1 实验装置及方法
1.1.1 微波酯化反应
微波酯化反应采用间歇搅拌釜式反应器,实验装置如图1所示。反应器为250 mL自制长颈二口烧瓶,长颈口接搅拌和冷凝装置,另一侧接聚四氟取样软管,并通过视窗将其伸出反应腔体外面。微波专用红外测温仪S20(南京麦哲自动化仪表有限公司)采用精密温度计对反应器液相主体温度进行了校正。MY1000S型微波反应装置(0~1 000 W连续线性可调,频率(2 450±50) MHz)的微波输出功率连续可调,从而维持反应器温度恒定。实验先将1.30 mol乙醇和10.0 g催化剂(NKC-9干氢催化树脂,即大孔强酸性苯乙烯系阳离子交换树脂,天津市光复精细化工研究所)加入反应器中,开启搅拌器混匀,启动微波加热乙醇至指定温度,同时将1.30 mol乙酸预热到指定温度,迅速将乙酸加至反应器中,并启动秒表计时,定时取样,适时分析其组成,直至反应达到平衡。

图1 微波反应装置Fig.1 Reaction equipment under microwave irradiation1-microwave generator source and infrared temperature monitor; 2-circulator and water load; 3-e-plane bending waveguide; 4-mechanical agitator; 5-glass reactor; 6-microwave reaction cavity; 7-infrared temperature sensor; 8-observation hole; 9-teflon sampling pipe
1.1.2 常规酯化反应
常规酯化反应装置即为常见的水浴反应装置,其反应器为250 mL三口烧瓶,中间口接搅拌器,一侧口接冷凝器,另一侧口为取样口。反应器温度由加热制冷循环器控制,控温精度为±0.1 ℃。实验步骤与微波酯化反应相同。
1.2 分析方法
采用气相色谱仪分析反应体系各组分的含量,气相色谱分析条件:以氢气作载气,载气流速30 mL/min,PQN填充柱(2 m × ∅3 mm),担体为Porapak Q 80~100目,柱室温度180 ℃,汽化室温度230 ℃,检测器温度230 ℃,进样量0.4 μL。以乙醇为参照物,采用分段校正的方法测定了水-乙醇、乙酸-乙醇、乙酸乙酯-乙醇的相对校正因子,然后由归一化法得到各组分的摩尔分数。
2 结果与讨论
2.1 内外扩散的消除
实验采用的催化剂为NKC-9大孔强酸性苯乙烯系阳离子交换树脂,95%以上粒子粒度为0.4~1.25 mm,粒径小,孔隙率大,一般认为内扩散的影响可以忽略。
在乙醇1.30 mol,乙酸1.30 mol,催化剂10.0 g,反应温度75 ℃的反应条件下,考察了搅拌速度对反应的影响,结果见图2。由图2可知,当转速大于230 r/min时,可以消除外扩散的影响。
2.2 本征动力学实验
在无内外扩散的条件下,分别进行了微波辐射下和常规水浴加热方式下合成乙酸乙酯的动力学实验。由于受到反应体系泡点温度及乙酸乙酯沸点的限制,反应体系不可能维持很高的温度[9];另一方面,如果反应温度过低使反应速率很慢,没有实际研究价值。因此,在乙醇1.30 mol,乙酸1.30 mol,催化剂10.0 g,搅拌转速230 r/min的反应条件下,考察了不同反应温度下的反应,结果如图3所示。由图3可知,不论微波辐射还是常规加热,乙醇转化率均随温度的升高而增大,并且在相同温度下,微波辐射下的乙醇转化率及平衡转化率都较常规加热下的略高。这与Kabza[6]研究合成乙酸异戊酯,得出在相同反应温度下微波辐射与常规加热反应速率没有显著差别的结论是相符的。微波没能体现出像Gedye等[7]报道的那样比常规反应具有显著的优势,分析其可能原因如下:(1)Gedye等人采用的反应器是密闭的,这意味着反应是在高温高压的条件下进行的,对于一般的化学反应,温度越高反应速率越快;(2)为了维持反应温度恒定,实验中微波功率由初始的100 W,逐渐降低到反应终止的25 W。由于微波功率的降低,微波仅够维持恒温,没有额外的能量去促进化学反应,这与Kim[8]分析微波酯化反应的能量效率是吻合的;(3)采用文献[9, 10]中的复介电常数,按照文献[11]中给出的渗透深度的计算式,得到20 ℃,2 450 MHz下乙醇、乙酸和水的渗透深度分别为8.26,59.2和18.1 mm,即对于乙醇而言,距反应器外表面8.26 mm处,微波功率已降到输出功率的37%。而对于整个反应体系,微波在辐射到催化剂之前绝大部分已被高耗散乙醇和水吸收了。
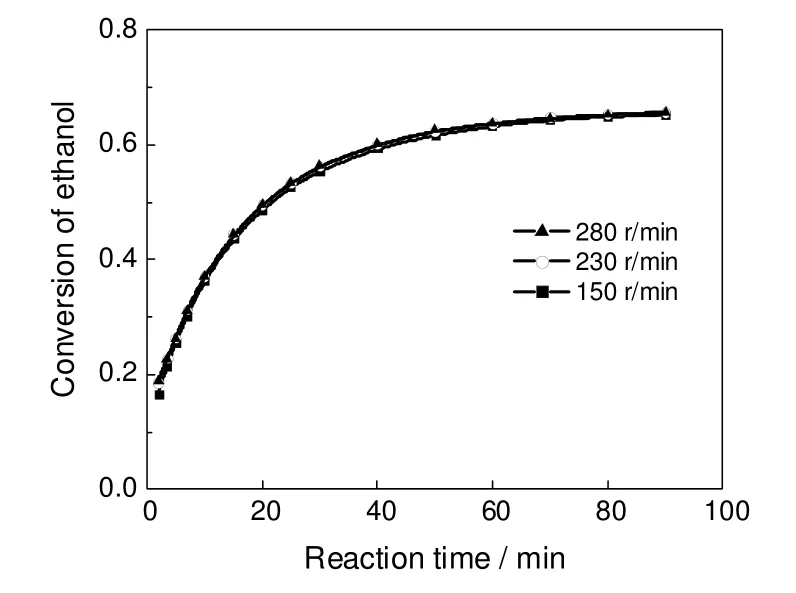
图2 常规水浴下搅拌转速对乙醇转化率的影响Fig.2 Influence of stirring speed on the conversion of ethanol under water bath

图3 微波与常规加热方式下反应温度时乙醇转化率的影响Fig.3 Influence of reaction temperature on the conversion of ethanol under microwave and conventional heating
2.3 动力学模型参数的确定
一般认为非均相催化合成乙酸乙酯的动力学,在消除内外扩散影响后,与均相反应具有相同的反应机理。而以硫酸作催化剂合成乙酸乙酯的均相反应已确立为二级可逆反应,因此,采用拟均相模型对实验数据进行拟合,从而确定动力学模型参数。
乙醇与乙酸催化反应生成乙酸乙酯和水的化学计量方程如下

反应速率可以描述为
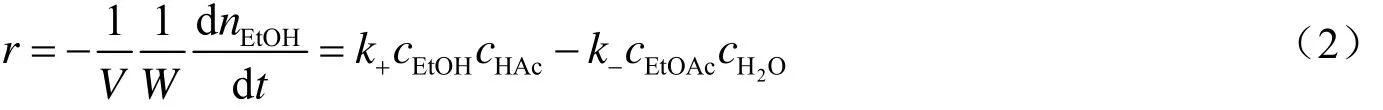
反应速率r的物理意义为:单位反应体积单位催化剂质量单位时间内反应物系中乙醇的反应量。
将(2)进行变形,可得到如下等式:

上式中V为反应体积,150 mL;W为催化剂质量,10.0 g;nEtOH,0,nEtOH分别为乙醇初始和t时刻物质的量,其中nEtOH,0为1.30 mol;ci为组分i的物质的量浓度;Xi为组分i的摩尔分数。xEtOH为乙醇转化率;n0为总物质的量,由于式(1)为恒物质的量可逆反应,n0为2.6 mol;k+,k-分别为正、逆反应速率常数。
采用Origin 8.5 中的B-样条命令对图3的实验数据进行光滑处理,然后利用该软件的Tangent 插件对各时间点下的乙醇转化率求导,即可求得dxEtOH/dt,然后按式(3)对实验值进行拟合,即得到各温度下的速率常数k+和k-,结果如表1所示。

表1 微波与常规加热不同温度下的速率常数和平衡常数Table 1 The reaction rate constant and equilibrium constant under microwave and conventional heating at different temperature
由表1可知,微波辐射和常规加热方式下,正、逆反应速率常数均随温度的升高而增大;在相同反应温度下,微波辐射的正、逆反应速率常数均略高于常规加热;而不同温度下的平衡常数,微波辐射与常规加热的几乎相同。
关于微波加速化学反应,可能原因是微波与催化剂及反应物的相互作用以及空间电磁场的分布不均,在催化剂表面诱导形成了许多新的活性位点,从而提高了反应速率[12]。而化学反应平衡常数是一个宏观、稳态的概念,当反应主体温度恒定时,微观的、瞬时的反应速率变化并不改变宏观的平衡状态,即相同反应温度下,微波与常规加热下的平衡常数几乎相同。
为了回归活化能和指前因子,将表1中的速率常数和反应温度化为国际单位制,根据Arrhenius方程

将-ln k与1/RT绘图,结果如图4和图5所示,即可得到斜率为E,截距为-lnA的直线。。

图4 微波加热下反应速率常数与温度的关系Fig.4 Relationship between reaction rate constant and temperature under microwave heating

图5 常规加热反应速率常数与温度的关系Fig.5 Relationship between reaction rate constant and temperature under conventional heating
由图4可知,微波辐射下合成乙酸乙酯正、逆反应活化能分别为51.719 kJ/mol和43.215 kJ/mol;指前因子A+为582.9和8.415。
由图5可知,常规水浴加热下合成乙酸乙酯正、逆反应活化能分别为48.581 kJ/mol和41.838 kJ/mol;指前因子A+为169.2和4.509。
由回归得到的活化能可以看出,不论是微波辐射还是常规加热,正反应活化能均比逆反应活化能大,这与合成乙酸乙酯为吸热反应是一致的;对比微波辐射和常规加热下的动力学模型参数可以看出,微波辐射下的正、逆反应活化能及正、逆反应指前因子均比常规加热的大,这与文献[13]得出的结论是相同的。并且微波加速化学反应,更多地体现在对指前因子的影响[14],微波对正向活化能和指前因子分别增大了6.46%和244.5%。
2.4 动力学方程可靠性验证
为了验证回归得到的动力学方程的可靠性,将反应速率的计算值与实验值进行比较,结果如图6所示。由图6可知,在实验范围内,微波和常规加热下反应速率实验值与动力学方程计算值吻合较好,动力学方程的相关性系数分别为0.996 1和0.999 9。说明微波和常规加热下回归的动力学方程均是可靠的。

图6 微波与常规加热下反应速率常数的计算值与实验值Fig.6 Comparison between calculated values and experimental values of reaction rate under microwave and conventional heating
3 结 论
本工作对比研究了微波与常规两种加热方式下催化合成乙酸乙酯非均相酯化反应本征动力学,得出如下结论:
a)微波改变了反应动力学,加快了反应速率,存在微波非热效应,但是微波并不改变反应平衡常数。
b)在研究的反应温度范围内,微波辐射下的正、逆反应活化能比常规水浴加热的分别增大了6.46%和3.29%,正、逆指前因子比常规水浴加热下的分别增加了244.5%和86.6%,微波对反应动力学参数的影响主要表现在对指前因子的改变。
c)利用微波加速化学反应可以缩短反应时间,本研究获得的动力学参数为合成乙酸乙酯提供了基础数据。
[1] 马双忱, 姚娟娟, 金 鑫, 等. 微波化学中微波的热与非热效应研究进展 [J]. 化学通报, 2011, 74(1):41-46.Ma Shuangchen, Yao Juanjuan, Jin Xin, et al. Progress for thermal and non-thermal effects of microwave chemistry [J]. Chemistry, 2011,74(1):41-46.
[2] Ma S C, Yao J J, Jin X, et al. Kinetic study on desulfurization and denitrification using microwave irradiation over activated carbon [J]. Science China Technological Sciences, 2011, 54(9):2321-2326.
[3] Ergan B T, Bayramoglu M. Kinetic approach for investigating the “microwave effect”: decomposition of aqueous potassium persulfate [J].Industrial and Engineering Chemistry Research, 2011, 50(11):6629-6637.
[4] 廖安平, 张 雷, 蓝丽红, 等. 强酸性离子交换树脂催化合成乙酸乙酯动力学 [J]. 化学反应工程与工艺, 2008, 24(4):363-367.Liao Anping, Zhang Lei, Lan Lihong, et al. Kinetics of synthesis of ethyl acetate over strong acid ion exchange resin catalyst [J]. Chemical Reaction Engineering and Technology, 2008, 24(4):363-367.
[5] Lai I K, Liu Y C, Yu C C, et al. Production of high-purity ethyl acetate using reactive distillation: experimental and start-up procedure [J].Chemical Engineering and Processing, 2008, 47(9-10):1831-1843.
[6] Kabza K G, Chapados B R, Gestwicki J E, et al. Microwave-induced esterification using heterogeneous acid catalyst in a low dielectric constant medium [J]. Journal of Organic Chemistry, 2000, 65(4):1210-1214.
[7] Gedye R, Smith F, Westaway K, et al. The use of microwave ovens for rapid organic synthesis [J]. Tetrahedron Letters, 1986, 27(3):279-282.
[8] Kim D, Choi J, Kim G J, et al. Microwave-accelerated energy-efficient esterification of free fatty acid with a heterogeneous catalyst [J].Bioresource Technology, 2011, 102(3):3639-3641.
[9] 华 伟, 杨晓庆, 夏祖学, 等. 2.45 GHz下常用有机试剂复介电常数的测量与研究 [J]. 化学研究与应用, 2006, 18(10):1232-1234.Hua Wei, Yang Xiaoqing, Xia Zuxue, et al. Study on the complex permittivity of common organic reagent at 2.45 GHz [J]. Chemical Research and Application, 2006, 18(10):1232-1234.
[10] Gabriel C, Gabriel S, Grant E H, et al. Dielectric parameters relevant to microwave dielectric heating [J]. Chemical Society Reviews, 1998,27(3):213-224.
[11] Altman E, Stefanidis G D, van Gerven T, et al. Microwave-promoted synthesis of n-propyl propionate using homogeneous zinc triflate catalyst[J]. Industrial and Engineering Chemistry Research, 2012, 51(4):1612-1619.
[12] Bhattacharya M, Basak T, Senagala R. A comprehensive theoretical analysis for the effect of microwave heating on the progress of a first order endothermic reaction [J]. Chemical Engineering Science, 2011, 66(23):5832-5851.
[13] 雷向欣, 李 俊, 沈瀛坪. 微波对乙酸甲酯水解的作用及反应动力学研究 [J]. 化学反应工程与工艺, 2002, 18(2):97-102.Lei Xiangxin, Li Jun, Shen Yingping. Study on the hydrolysis of methyl acetate under the influence of microwave and the kinetics [J].Chemical Reaction Engineering and Technology, 2002, 18(2):97-102.
[14] Mazo P, Rios L, Estenoz D, et al. Self-esterification of partially maleated castor oil using conventional and microwave heating [J]. Chemical Engineering Journal, 2012, 185:347-351.

