Te(IV)对螺旋藻胁迫作用的光谱学研究
杨 芳,涂 芳,刘 杰,郑文杰
(1.暨南大学 化学系,广东 广州 510632;2.水体富营养化与赤潮防治广东省教育厅重点实验室,广东 广州 510632)
螺旋藻是光合自养的原始生物[1],属蓝藻。在蓝藻中,藻胆体是由内侧中心的别藻蓝蛋白与外周环绕着的藻蓝蛋白通过无色多肽结合,并通过核连接蛋白使之结合到类囊体膜上,藻蓝蛋白是藻胆体中主要的捕光色素,并将所捕获的光能通过别藻蓝蛋白传给类囊体膜上的叶绿素 a进行光合作用,因此可作为光合作用研究的材料。关于螺旋藻的谱学性质已有一些研究报道[2],对螺旋藻中大量存在的作为光合作用色素的藻胆体的研究更是非常活跃[3-5]。
近年来,关于富硒螺旋藻的研究发现,硒对螺旋藻具有低浓度下促进生长和高浓度下抑制生长的双重生物效应。而硒进入藻体的分布主要集中于藻胆体中的藻蓝蛋白,因而推测硒主要是通过对藻胆体的作用而产生生物效应的。碲与硒同为硫属元素,它们具有极为相似的化学性质。本课题组的研究表明,无机碲(Na2TeO3)和无机硒(Na2SeO3)一样,同样可被酵母菌吸收转化为碲代(硒代)氨基酸并掺入到蛋白质中[6];碲对螺旋藻同样表现出低浓度下的促进以及高浓度的抑制作用[7-9]。微藻是否能对无机碲进行生物有机化作用,以及碲在生物体中是否具有独特的生物功能,这些均是人们感兴趣的问题。考虑到碲和硒一样进入螺旋藻后主要作用于藻胆体,以及藻胆体独特的光谱性质,推测 Te(IV)胁迫可能对螺旋藻产生一定的光谱效应。因此,作者试图通过研究Te(IV)胁迫下螺旋藻的一些光谱学特性变化,探索环境胁迫因子对螺旋藻生物效应的光谱学方法。
1 材料和方法
1.1 藻种
螺旋藻(Spirulina maxima)由暨南大学水生生物研究所藻种室提供。本实验室保种。
1.2 仪器
PYX-800G-A型光照培养箱;752型紫外可见分光光度计;TU-1901型双光束紫外/可见分光光度计;CRT970荧光分光光度计;美国VARIAN荧光分光光度计(1500W氙灯作光源)。
1.3 培养条件和方法
250 mL三角烧瓶中加入100 mL Zarrouk标准培养基,接种螺旋藻并调节光吸收值A560nm= 0.10,温度30℃,初始pH值8.5,光照强度4 000 lx,光周期光:暗为14 h:10 h,每天定时摇动3~5次,并添加蒸馏水补充水分蒸发。
1.4 Te(IV)胁迫实验
按表1添加 Te(IV)储备液(以 Na2TeO3配制,按Te计量。储备液Te(IV)质量浓度:10 g/L)。表1括号中的数据为Te(IV)的累积量(mg/L)。
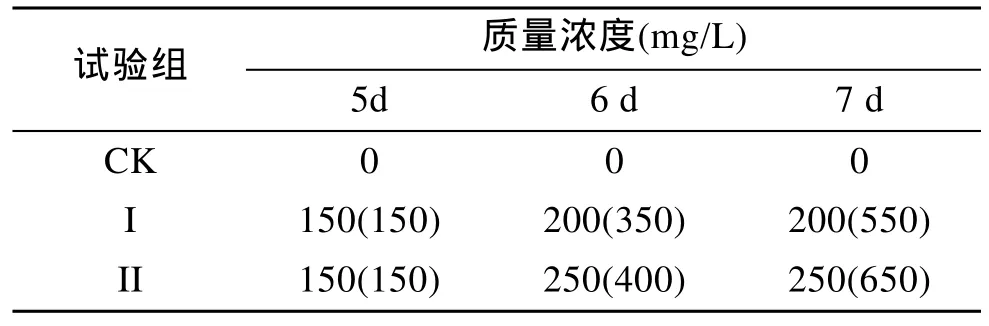
表1 各试验组中Te(IV)的添加时间和质量浓度Tab 1 Adding time and concentration of Te (IV)
1.5 生物量的测定
每天同一时间在 752分光光度计上于波长 560 nm处测定螺旋藻的吸光度(A560),重复3次取平均值,以示螺旋藻的生长情况。将培养到第12天的藻液用300目滤布过滤,等渗 NaCl盐水冲冼后冷冻干燥,称量。以干藻粉的质量与藻液的体积之比(mg/L)代表螺旋藻最终的生物量。
1.6 活藻体吸收光谱、荧光光谱测定及红外光谱测定
离心收集培养至第10天的藻,用等渗NaCl盐水反复洗涤后立即重新悬浮于等渗NaCl盐水中。调节A560为 0.2。以等渗 NaCl盐水为空白,于 TU-1901型紫外/可见分光光度计上测定螺旋藻活体吸收光谱,扫描范围为400~750 nm。于970CRT荧光分光光度计上室温下测定螺旋藻活体的荧光光谱。将生长至12 d的藻液用300目滤布过滤,等渗NaCl盐水冲洗后,冷冻干燥,得螺旋藻干粉,进行固体荧光及红外光谱测定。
2 结果与讨论
2.1 不同质量浓度 Te(IV)胁迫对螺旋藻生长的影响
各实验组螺旋藻生长曲线见图1,由于在第9天后A560值的测定受到仪器测定范围限制,螺旋藻的生长情况用最终生物量表示,结果见图2。从图1可见施加Te(IV)胁迫的第3天(即接种的第7天)即可观察到 Te(IV)产生较为明显的生物效应,至 Te(IV)胁迫的第5天(即接种的第9天)则观察到碲胁迫实验组的A560nm值明显低于对照组,因此有抑制作用。从图2可见藻的最终生物量呈现有规律的递减。对照组的最终生物量为1 213 mg/L,碲胁迫实验组中,藻的生长明显受到抑制并呈剂量效应。同时还观察到高浓度的Te(IV)胁迫下有部分藻丝严重断裂。
在Te (IV)胁迫下的螺旋藻培养液散发出一种强烈刺激性的气体。初步判断为藻细胞对无机碲吸收、代谢转化为有机碲的气态小分子化合物,这和富硒螺旋藻培养时情况相似[10],也说明了螺旋藻对硒、碲的吸收代谢情况相似,本课题组曾观察到酵母菌吸收无机碲后可以将无机碲转化为碲氨基酸(碲代蛋氨酸)并掺入到蛋白质中[6],那么微藻是否也能把无机碲转化?或者碲是否如同硒一样,在生物体具有特定的生物功能?将是很有意义的研究课题。
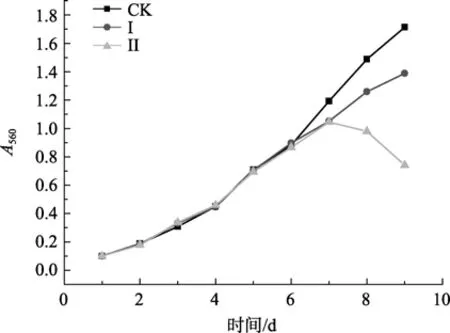
图1 螺旋藻的生长曲线Fig.1 Growth curves of Spirulina maxima

图2 螺旋藻最终生物量Fig.2 Final biomass of Spirulina maxima
2.2 UV-Vis吸收光谱变化
图3为螺旋藻活藻体的吸收光谱。从图3可见,对照组藻液的特征吸收峰清晰,其中440 nm和680 nm处分别为叶绿素 a在蓝光区和红光区的吸收峰,490 nm处的肩峰为类胡萝卜素的吸收峰,630 nm附近为藻蓝蛋白的吸收峰(通常在620 nm)。Te(IV)胁迫组吸收峰的强度相对于对照组发生了明显的变化,其中在680 nm处的吸收峰强度明显减弱,而在440、620 nm处几乎观察不到特征吸收峰。说明Te(IV)胁迫使藻体中叶绿素和藻蓝蛋白遭到损伤从而导致对可见光的吸收减弱。
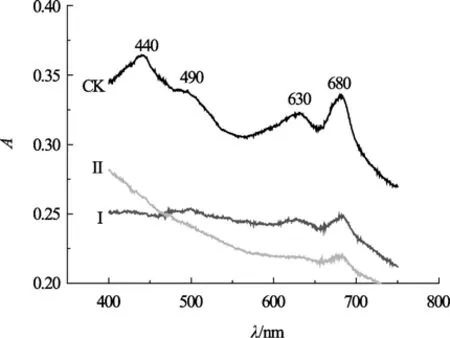
图3 螺旋藻活藻体悬浮水溶液的吸收光谱Fig.3 Absorption spectra of aqueous suspension of Spirulina maxima
2.3 活藻体室温荧光光谱变化
2.3.1 荧光发射光谱
图4为螺旋藻活藻体分别在440、490、580 nm处激发所得的发射光谱图。当用440 nm的光激发时,在680 nm有强的发射峰,在725 nm处有一肩峰,是叶绿素 a的发射峰,各实验组的相对荧光强度比值F680:F725大约都为1.4。用490 nm的光激发时,观察到来自光732 nm的强荧光发射峰,同时还有较弱的660、680nm的荧光发射峰。用580 nm的光激发时,观察到藻胆体的荧光发射峰 (660 nm)。
从图4可见 Te(IV)胁迫试验组的荧光发射峰较对照组没有发生位移,但强度发生了变化,在 440、580 nm处激发时,其发射峰强度随Te(IV)浓度增大而减弱。说明在Te(IV)胁迫下,活藻体的叶绿素损伤加剧,并导致叶绿素及藻胆体的能量传递均有所降低。然而以490 nm处的光激发时,几组Te(IV)胁迫组在732 nm处的发射峰强度接近,但均比对照组要高,表明在Te(IV)胁迫下,类胡萝卜素吸收的能量较多地传递到732 nm处。
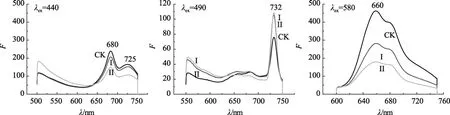
图4 螺旋藻活藻体悬浮水溶液分别在激发波长440、490、580 nm处的荧光发射光谱Fig.4 Fluorescence emission spectra of Spirulina maxima aqueous suspension excited at 440,490 and 580 nm
2.3.2 荧光激发光谱
图5为螺旋藻活藻体分别在660、680、732 nm处记录到的激发光谱图。由图可知,各实验组的激发峰均在600 nm和625 nm时出现强峰,强度比F600:F625随Te(IV)胁迫增大而下降。由于藻蓝蛋白单体由α和β亚基构成,其中α亚基只含 1个发色团(藻蓝胆素,PCB),β亚基含2个PCB发色团,分别具有不同的吸收峰。图中相对荧光强度比值F600:F625逐渐下降,可能是由于藻蓝蛋白的α亚基的 PCB发色团对Te(IV)胁迫更为敏感。从而使其在600 nm的激发减弱。这说明 Te(IV)胁迫导致藻细胞中作为主要捕光体的藻蓝蛋白受损伤,从而致使其捕光能力随Te(IV)胁迫强度增大而下降。但以732 nm为记录观察激发峰时,在494 nm处有强的激发,强度均比对照组的峰强。这与荧光发射光谱观察结果是相对应的,即在490~494 nm激发时,其能量高效率地传递到732 nm处。以上观察结果表明Te(IV)胁迫下,在一定程度上改变了活藻体中藻胆体的结构,从而改变藻胆体中的能量传递作用。
2.4 干藻粉的固体荧光光谱
螺旋藻经冻干处理后,藻体失水,同时经受一系列损伤而死亡,干藻粉中的光系统已停止工作。干燥胁迫下的环境因子可能导致藻类的生理发生变化。因此,试图通过比较各试验组干藻粉的固体荧光来探讨干燥胁迫对藻类光合作用的影响,观察藻细胞中水分在维持生物分子构象、能量的捕获和传递中的作用,能够为螺旋藻在干燥环境的耐受力与细胞修复能力提供一些参考。由于干燥失水状况的不同,导致干藻粉的固体荧光谱图变化较为复杂。但对谱图变化情况的分析讨论仍是有意义的。
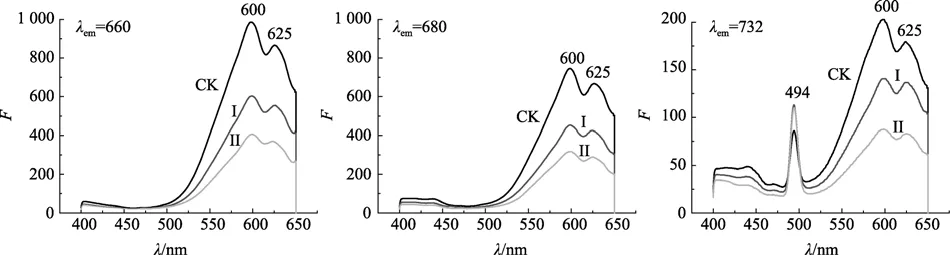
图5 螺旋藻活藻体悬浮水溶液分别在发射波长660、680、732 nm处的荧光发射光谱Fig.5 Fluorescence excitation spectra of Spirulina maxima aqueous suspension emited at 660,680 and 732 nm
2.4.1 荧光发射光谱
图6为螺旋藻干粉分别在440、490、580 nm处激发所得的发射光谱图。与活藻体悬浮水溶液的发射光谱图相比,发射峰形有所变宽。440 nm激发时,对照组相对荧光强度比值F680:F725大约为 0.7。但Te(IV)胁迫组其F680:F725却高于或约等于 1。在490 nm的激发所得发射光谱与其活藻体悬浮水溶液相比有很大差异,732 nm的锐峰钝化成不易指认的谱峰,对照组的发射峰在720 nm左右,Te(IV)胁迫下观察不到有发射峰。在以580 nm处为激发时,发射峰由725移至700 nm左右,对照组在656 nm处有一小峰。高强度Te(IV)胁迫组在656 nm处无法指认出谱峰。
图6中490 nm的荧光发射光谱表明,螺旋藻干粉中类胡萝卜素向活性中心的能量传递几乎完全停止,580 nm的荧光发射光谱上,对照组与各Te(IV)胁迫组间有显著的差别,Te(IV)胁迫组的螺旋藻干粉725 nm处的荧光发射峰蓝移且发光强度下降(725移到700 nm),这表明细胞中藻蓝蛋白由于失水,聚集状态可能发生了改变。
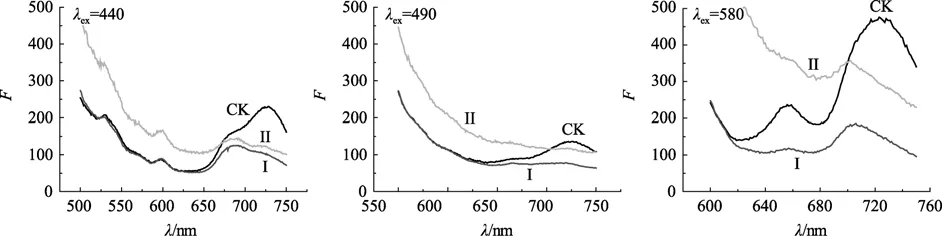
图6 螺旋藻干粉分别在激发波长440、490、580 nm处的荧光发射光谱Fig.6 Fluorescence emission spectra of Spirulina maxima powder excited at 440,490 and 580 nm
2.4.2 荧光激发光谱
图7为螺旋藻干粉在不同发射波长处所记录到的激发光谱图。Te(IV)胁迫组几乎观察不到激发峰,故图中未显示。图7观察到645 nm处激发峰,与活藻体的激发光谱图相比,干藻粉中没有观察到藻蓝蛋白的发射峰,受激发的主要是别藻蓝蛋白,且吸收光子的能力随 Te(IV)胁迫强度增大而降低。在蓝藻中,藻蓝蛋白和别藻蓝蛋白通过无色多肽连接而成藻胆体,这说明在干粉状态下,藻胆体已经发生解离,藻蓝蛋白吸收光子的能力减弱,主要是别藻蓝蛋白吸收光子。Te(IV)胁迫组的别藻蓝蛋白吸收光子的能力下降,提示 Te(IV)胁迫可能也导致别藻蓝蛋白分子损伤或导致其聚集状况发生变化。
螺旋藻的 Te(IV)胁迫组与对照组的红外光谱图均在3 400、2 930、1 650cm–1左右出现吸收峰,两者在红外光谱上没有明显的差异,在此不展开讨论。比较图4~图7,可知活藻体悬浮水溶液和干藻粉的荧光光谱有很大的差异。活藻体中 Te(IV)胁迫实验组的叶绿素a及藻胆体的能量传递降低。在干藻粉中,类胡萝卜素的能量传递系统几乎停滞,藻胆体的能量传递受阻。说明干藻粉仍可反映 Te(IV)胁迫所产生的影响,且颇为敏感,这提示干藻粉的荧光光谱将可为藻粉质量的鉴定提供有用的依据。
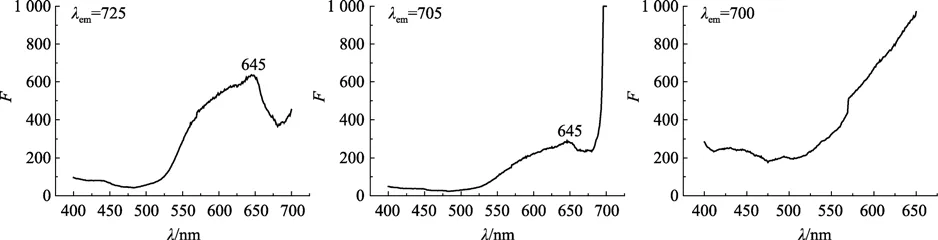
图7 螺旋藻干粉分别在发射波长725、705、700 nm处记录的荧光激发光谱Fig.7 Fluorescence excitation spectra of Spirulina maxima powder emited at 725,705 and 700 nm
[1]胡鸿钧.螺旋藻生物学及生物技术原理[M].北京:科学出版社,2003.
[2]杨芳,涂芳,白燕,等.脱水螺旋藻细胞复水后在不同光强下的谱学性质[J].光谱学与光谱分析,2007,27(4):660-663.
[3]路荣昭,刘斌,李凤平.螺旋藻藻胆体在解离过程中荧光发射光谱和光能传递的研究[J].生物物理学报,1994,10(3):479-484.
[4]Gómez L C,Pérez-gómez B,Krogmann D W,et al.The tricylindrical core of the phycobilisome of the cyanobacteriumArthrospira(Spirulina)maxima[J].Int J Biochem Cell Boil,1997,29(7):959-970.
[5]LI Dong-hui,XIE Jie,ZHAO Yue-wei,et al.Probing connection of PBS with the photosystems in intact cells ofSpirulina platensisby temperature-induced fluorescence fluctuation[J].Biochimica et Biophysica Acta,2003,1557:35-40.
[6]Yu liang-yao,He kang-ming,Cai duan-ren,et al.Evidence for telluroamino acid in biological materials and some rules of assimilation of inorganic tellurium by yeast[J].Analytical Biochemistry,1993,209(2):318-322.
[7]陈小敏,杨芳,白燕,等.Te(IV)胁迫对两种螺旋藻生长及抗氧化酶系统的影响[J].水生生物学报,2008,32(2):148-153.
[8]唐全民,郑文杰,杨芳,等.Se(IV)和Te(IV)对钝顶螺旋藻的急性毒性和联合毒性[J].海洋科学,2007,27(1):134-140.
[9]郑文杰,贺鸿志,黄峙,等.硒碲胁迫对两种螺旋藻生长的影响[J].海洋科学,2003,27(10):73-78.
[10]陈思嘉,杨芳,郑文杰.硒剂量对钝顶螺旋藻的生理生化影响[J].海洋学报,2007,29(6):87-92.

