海洋放线菌YH91分类鉴定及其抑菌活性的研究
王 皓,刘 秋,孙建龙,闫建芳,赵柏霞,刘志恒
(1.沈阳农业大学 植物保护学院,辽宁 沈阳 110161;2.大连民族学院 生命科学学院,辽宁 大连 116600)
很多放线菌能够产生具有广谱杀菌效果的次生代谢产物。据不完全统计,放线菌产生的活性次生代谢产物约占目前已发现微生物活性次生代谢产物的50%[1]。海洋微生物具有不同于陆地微生物的代谢途径,可产生完全不同于陆地微生物的新颖生物活性物质[2],因此海洋放线菌在新型抗生素以及生物农药的开发等方面具有巨大潜力。金黄色葡萄球菌(Staphylococcus aureus)和大肠杆菌(Escherichia coli)是导致食品污染和人类感染的主要细菌,而它们又分别是 G+和 G—的代表菌。镰刀菌属真菌(Fusarium moniliforme)是植物产后病害的重要病原菌之一,危害水稻、小麦、玉米等作物,造成严重减产,其中一些菌种也可引起人类疾病,且有致癌作用[3]。选用上述 3种菌为供试菌株,通过对海洋沉积物中分离得到的海洋放线菌抑菌活性测定,筛选到一株海洋放线菌 YH91,其发酵液能够抑制所选供试病原菌,并且抑菌活性稳定。通过对该菌株的鉴定及其抑菌活性的研究,为下一步代谢产物的研究和应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株来源
采集辽宁省大连市龙王塘西口距离海岸 300 m的海洋沉积物,从中分离得到海洋放线菌 YH91,于-80℃冰箱中冻干保存。
1.1.2 培养基
菌种鉴定培养基:高氏一号培养基、蔗糖硝酸盐琼脂培养基、燕麦粉琼脂培养基、无机盐淀粉琼脂培养基、甘油天冬素琼脂培养基、马铃薯块培养基、营养琼脂培养基、淀粉琼脂培养基;发酵培养基:高氏一号液体培养基;抗菌活性测定培养基:PDA 培养基、牛肉膏蛋白胨培养基。以上培养基的配方参照文献[4-5]。
1.2 方法
1.2.1 形态特征以及培养特征研究
用高氏一号培养基划线埋片,于28℃下培养5 d后,用光学显微镜和电子显微镜观察菌株 YH91形态特征。于 7种菌种鉴定培养基分别划线,在 28℃下培养7 d,进行培养特征观察。
1.2.2 生理生化特性
参照文献[6-8]进行生理生化特性鉴定。
1.2.3 细胞壁化学组分分析
全细胞壁氨基酸和全细胞水解产物糖组份分析采用Stanek等[9]和王平[10]的的快速薄板层析法(TLC)进行。
1.2.4 16S rDNA的扩增及其同源性比较
用微波法[11]进行放线菌总DNA的提取。以培养至对数期的新鲜菌丝体基因组DNA为模板,采用原核生物通用引物F27及R1492(由上海生工公司合成)进行16S rDNA序列扩增,引物序列为F27:5’-AGAGTTTGATCCTGGCTCAG-3’;R1492:5’-TACCTTGTTACGACTT-3’,PCR 反应体系和反应条件见参考文献[12],用1%琼脂糖凝胶电泳进行PCR产物检测。采用DNA纯化试剂盒(宝生物(大连)工程技术有限公司)进行 PCR扩增产物的回收pMD19-T克隆试剂盒(宝生物(大连)工程技术有限公司)进行 PCR扩增产物的连接以及连接产物的转化,由北京三博远志生物公司进行16S rDNA 序列分析。将所测得的YH91的16S rDNA序列同NCBI数 据 库 (http://www.ncbi.nlm.nih.gov/BLAST/)中 已有序列进行比对分析,利用MEGA5.0软件构建N-J(Neighbor-joining)系统进化树,确定菌株的分类地位。
1.2.5 抑菌物质活性测定
用接种针取YH91孢子接种于装有100 mL发酵培养基的250 mL三角瓶中,于28℃ 150 r/min培养7 d制备菌株YH91发酵液,发酵液在8 000 r/min条件下离心5 min。上清液过0.45 μm滤膜,采用管碟法[13]测定上清液对3种指示菌的抑菌活性。
1.2.6 抑菌物质稳定性研究
取5 mL(原始PH 7)YH91发酵上清液9份,进行9种处理,Ⅰ:未处理作为对照;Ⅱ:100℃,0.5 h;Ⅲ:pH 2,24h;Ⅳ:pH 12,24 h;Ⅴ:pH 2,24 h,再 100℃,0.5 h;Ⅵ:pH 12,24 h,再 100℃,0.5 h;Ⅶ:紫外照射0.5 h;Ⅷ:紫外照射 1 h;Ⅸ:紫外照射 3 h。检测上清液的抑菌活性,以金黄色葡萄球菌、大肠杆菌以及镰刀菌属作为指示菌,细菌于 37℃培养 24 h,真菌于28℃培养60 h,记录抑菌结果并进行显著性检验。热处理部分在恒温水浴锅中进行,pH调节采用3 mol/L HCL和3 mol/L NaOH;所有试验设3个重复。
2 结果
2.1 形态特征
取 YH91玻片在光学显微镜下观察,其基内菌丝细长多分支,色泽浅而透明,相互交织成网状。电子显微镜观察孢子丝呈不规则分枝状,孢子卵圆或圆形, 孢子之间无缢缩, 大小为 (0.8~1.1)μm×(1.1~1.4)μm,孢子表面有纹饰(图1)。
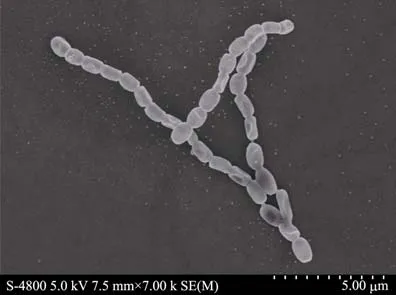
图1 菌株YH91的扫描电镜图(×7 000)Fig.1 Scanning electron micrograph of strain YH91(×7 000)
2.2 培养特征
利用不同培养基培养,YH91产生的气生菌丝与基内菌丝的颜色各不相同,均不产生可溶性色素,除在马铃薯块培养基上长势一般外,在其余培养基长势良好。具体结果见表1。

表1 菌株YH91的培养特征Tab.1 Cultural characteristics of strain YH91
2.3 生理生化特性
YH91菌株能液化明胶、还原硝酸盐、不胨化牛奶、不水解淀粉、不水解纤维素、不产生黑色素,不产硫化氢。能利用葡萄糖、阿拉伯糖、木糖、鼠李糖、甘露醇,不利用果糖、蔗糖、木糖、棉子糖、肌醇。YH91与淀粉酶链霉菌(S.diastaticus)具体形态特征及生理生化特征的比较见表2。
2.4 细胞壁化学类型
经TLC全细胞水解液分析发现,菌株YH91细胞壁组成中含 L,L-DAP;有葡萄糖,无阿拉伯糖、甘露糖、木糖和马杜拉糖等特征性糖。其细胞壁氨基酸型为I型,糖型为C型。符合链霉菌属(Streptomyces)的化学分类特性。

表2 菌株YH91形态特征及生理生化特征Tab.2 Morphological characteristics and physiological and biochemical properties of strain YH91
2.5 16S rDNA的扩增及序列分析
菌株YH91的16S rDNA序列长度为1 450 bp,NCBI的序列登记号为:JN205799.将所测序列与GenBank数据库中的相关菌种进行比较,其与Streptomyces diastaticus subsp.ardesiacus的序列相似性为99.4%。构建以16S rDNA全序列为基础的系统发育树,结果如图2所示。

图2 菌株YH91系统进化发育树Fig.2 Rooted phylogenetic tree of strain YH91
2.6 抑菌物质活性分析
由图3可见,YH91的发酵液对金黄色葡萄球菌、大肠杆菌以及镰刀菌都具有明显的抑制作用,抑菌圈直径分别达到32、34和29 mm,说明该活性物质为一类广谱抗生素。

图3 YH91对不同病原菌的抑制结果Fig.3 Bacteriostatic activities of strain YH91 to different bacteria
2.7 抑菌物质稳定性分析
由表3可见,发酵液在经过酸、碱、高温及紫外照射处理后,抑菌圈直径大小没有明显改变。在0.05水平进行显著性检验,结果显示其对金黄色葡萄球菌和大肠杆菌的抑制作用经碱处理后略有下降,对镰刀菌的抑制作用经酸处理后略有下降,其余各组与未经处理的上清液无显著差异。说明链霉菌YH91所产生的活性物质对酸、碱、热以及紫外照射的稳定性较好。

表3 YH91抗菌活性物质稳定性试验结果Tab.3 The stabilities of the antimicrobial substances produced by strain YH91
3 讨论
据 Pridham 等[14]的报道,S.diastaticus subsp.ardesiacus的孢子丝螺旋形,孢子表面光滑,气生菌丝为石板灰色,基丝无色,能水解淀粉,能使牛奶凝固并胨化,不能液化明胶:而菌株YH91的孢子丝为不规则分枝,孢子表面有纹饰,气生菌丝为浅粉色、乳白色或灰白色,基内菌丝为淡紫色或粉色,不能水解淀粉,能凝固牛奶但不能使牛奶胨化,能液化明胶。综上所述,菌株YH91与S.diastaticus subsp.ardesiacus的形态特征、培养特征及生理生化特性存在较大的差异。因而认为菌株YH91为S.diastaticus subsp.ardesiacus的一株亚种。
目前,从天然资源中寻找活性物质代替化学农药以及开发天然抗菌化合物已成为研究的重点[15]。海洋放线菌 YH91的发酵液能够有效抑制金黄色葡萄球菌(S.aureus)、大肠杆菌(E.coli)以及镰刀菌(F.moniliforme)的生长,经酸、碱、热及紫外线的处理之后,抑菌物质的活性受到的影响较小,表现出良好的稳定性,在生物防治以及医药研究等方面的研究具有潜在价值,其活性物质的分离、纯化和结构解析等研究正在进行中。
[1]Berdy J.Bioactive microbial metabolites[J].The Journal of antibiotics(Tokyo),2005,58:1-26.
[2]Carté B K.Biomedical potential of marine natural products[J].Bioscience,1996,46(4):271-286.
[3]杨青,朱建国.镰刀菌和镰刀菌感染[J].浙江检验医学,2010,8(2):16-18.
[4]沈萍,范秀容,李广武.微生物学实验[M].3版.北京:高等教育出版社,1999:214-215.
[5]Shirling E B,Gottlieb D.Methods for characterization ofStreptomycesspecies[J].International Journal of Systematic and Evolutionary Microbiology,1966,16:313-340.
[6]中国科学院微生物研究所放线菌分类组.链霉菌鉴定手册[M].北京:科学出版社,1975.
[7]闫逊初.放线菌的分类和鉴定[M].北京:科学出版社,1992.
[8]徐立华,李文均,刘志恒,等.放线菌系统学[M].北京:科学出版社,2007.
[9]Staneck J L,Roberts G D.Simplified approach to identification of aerobic actinomycetes by thin-layer chromatography[J].Appl Microbiol,1974,28:226-231.
[10]王平.测定放线菌菌体中氨基酸和单糖的快速方法—薄层层析法[J].微生物学通报,1986,8(5):228-230.
[11]徐平,李文均,徐丽华,等.微波法快速提取放线菌基因组DNA[J].微生物学通报,2003,30(4):82-84.
[12]姜淑梅.一种简单有效的适于 PCR操作的放线菌DNA提取方法生物技术,2007,17(1):39-41.
[13]周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986:339.
[14]闫逊初.放线菌的分类和鉴定[M].北京:科学出版社,1992:473.
[15]Lam K S.Discovery of novel metabolites from marine actinomycetes[J].Curr Opin Microbiol,2006,9:245-251.

