黄瓜L-半乳糖-1,4-内酯脱氢酶cDNA全长的克隆和遗传转化
苑志明,劳杉杉,秦智伟,周秀艳
(东北农业大学园艺学院,哈尔滨 150030)
维生素C别名抗坏血酸(Ascorbic acid,AsA),是藻类、高等植物和大多数动物体内合成的一种己糖内酯化合物。抗坏血酸可以清除生物体内代谢产生的活性氧(Reactive oxidative species,ROS),一定浓度的ROS是生物体内必须的,但ROS浓度过高会造成细胞损伤,引起生物衰老和死亡,逆境会造成植物体内ROS升高[1]。高等植物抗坏血酸合成的L-半乳糖途径中,L-半乳糖-1,4内酯由GalLDH直接氧化成抗坏血酸,GalLDH是抗坏血酸合成过程中的关键酶之一[2]。
由于人体内缺乏抗坏血酸合成过程中的关键酶,只能从食物中摄取[3]。因此,园艺产品中的AsA含量已成为衡量品质的重要指标。黄瓜中抗坏血酸含量较低,到目前为止没有研究能解释这种现象。本试验通过克隆黄瓜中抗坏血酸合成的关键酶GalLDH,为今后研究黄瓜中抗坏血酸含量较低的原因,改良黄瓜的营养品质奠定一定基础。
1 材料与方法
1.1 材料
供试材料为黄瓜D08108果肉,由东北农业大学园艺学院黄瓜课题组提供。雌花自然开花后10 d采样,将果肉切成薄片用锡纸包好,并用液氮速冻后存于-80℃冰箱,用于提取RNA。将幼嫩的番茄(HN11)叶片称取0.2 g用锡纸包好,并用液氮速冻后存于-80℃冰箱,用于提取DNA。番茄品种由东北农业大学园艺学院提供。
载体pBI121和农杆菌由东北农业大学园艺学院实验室提供。黄瓜组织培养外植体选用栽培品种649,由东北农业大学园艺学院黄瓜课题组提供。
1.2 应用RT-PCR克隆黄瓜GalLDH
1.2.1 总RNA的提取和逆转录
称取0.5 g果肉用Trizol法提取RNA,用SMA3000分光光度计检测,用于逆转录合成cDNA。选用Fermentas逆转录试剂盒,取2 μL RNA用于逆转录,取3 μL逆转录产物用1%琼脂糖凝胶电泳检测cDNA质量。
1.2.2 RT-PCR
根据GenBank中登录的甜瓜GalLDH(AF252339.2)的基因序列设计引物,SGalLDH:5'GTTGGGG AATCATAAACC 3'和AGalLDH:5'AAACACTTATC CAACTGGACAAC 3'。以逆转录的cDNA为模板,用SGalLDH和AGalLDH进行PCR,反应条件为:94℃5 min预变性后,94℃30 s,56℃30 s,72℃1 min,循环35次,最后72℃延伸10 min。
1.2.3 PCR产物回收与测序
将PCR产物用1%琼脂糖凝胶电泳30 min,百泰克多功能小量DNA回收试剂盒进行胶回收,连接到pEASY-T3载体(全式金)上,然后转化到大肠杆菌DH5α菌株中,并涂在含有50 mg·mL-1Amp+、IPTG和X-gal的LB平板上,挑选白色菌落,放入含有Amp+的5 mL液体LB培养基中,37℃条件下,200 r·min-1,过夜。百泰克质粒小量回收试剂盒提取质粒,Fermentas快速内切酶Eco RⅠ37℃酶切5 min,用1%琼脂糖凝胶电泳检测目的片段。由上海英骏生物技术有限公司完成测序。
1.3 2A12果实特异性启动子的克隆
CTAB法提取番茄幼嫩叶片DNA,扩增2A12基因的引物序列为S2A12:5'AGCACTTGTTAGA CTCATCTG 3'和 A2A12:5'AATGGTTTTGGATTA ATTGC 3',以番茄DNA为模板进行PCR扩增。
1.4 酶切位点的添加
在S2A12添加HindⅢ位点即M-S2A12:5'GT CAAGCTTAGCACTTGTTAGACTCATCT 3',在A2A12上添加XbaⅠ位点即M-A2A12:5'GTATCTAGAAA TGGTTTTGGATTAATTGC 3'。在SGalLDH上添加XbaⅠ位点即M-SGalLDH:5'GTCTCTAGAGTTGGG GAATCATAAACC 3',在AGalLDH上添加SmaⅠ位点即M-AGalLDH:5'GATCCCGGG AAACACTTATC CAACTGGACAAC 3'。
1.5 表达载体的构建和检测
对含有GalLDH目的片段(已添加酶切位点)的pEASY-T3载体和pBI121分别用Fermentas快速内切酶XbaⅠ和SmaⅠ进行双酶切,进行胶回收,然后用Fermentas T4连接酶进行连接;将连接好的中间载体和含有2A12基因(已添加酶切位点)的pEASY-T3载体分别用Fermentas快速内切酶HindⅢ和XbaⅠ进行双酶切,进行胶回收,然后用Fermentas T4连接酶进行连接,将连接好的载体转入农杆菌中。用CTAB法提取黄瓜总DNA。
1.6 黄瓜GalLDH的cDNA生物学分析
采用Primer premier 5.0软件进行引物设计,由ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析开放阅读框;采用ExPASy的ProtParam Tool(http://www.expasy.org/tools/protparam.html)分析编码氨基酸理化性质;应用TreeView和CLUSTALX进行序列比对和进化树构建分析。
2 结果与分析
2.1RNA的质量、黄瓜GalLDH的RT-PCR扩增
提取黄瓜D08108果肉的总RNA,用SMA3000分光光度计检测,OD260/280≈1.8,3015 ng·μL-1,取3 μL用1%琼脂糖凝胶电泳检测RNA质量见图1(A),以逆转录的cDNA为模板进行RT-PCR扩增,获得一条1880 bp的特异性条带见图1(B)。

图1 黄瓜果实总RNA(A)及GalLDH基因的RT-PCR扩增(B)Fig.1 Total RNA(A)and RT-PCR product of GalLDH(B)from fruit of cucumber cultivar D08108
2.2 黄瓜GalLDH的生物学分析
黄瓜GalLDH经测序是一个全长为1880 bp cDNA序列,包含一个长为1773 bp的完整开放阅读框,在5'端有47 bp的非编码序列,在3'端有60 bp的非编码序列。其GenBank登录号:HQ446099,碱基序列及推导的氨基酸序列如图2所示,通过与GenBank中登录的同源基因进行核苷酸相似度比较,黄瓜GalLDH与甜瓜相似度最高,为96%,与猕猴桃相似度为76%,与其他物种相似度均在70%以上。
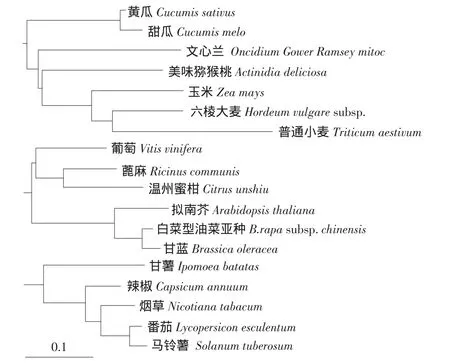
图2 植物GalLDH基因氨基酸序列系统树分析Fig.2 Phylogenetic tree of the deduced amino acid sequences of plant GalLDH gene
黄瓜GalLDH氨基酸序列的分子质量为67297.2,理论等电点9.04,氨基酸数590,亲水性平均值-0.475,不稳定指数48.30,为不稳定蛋白质。
2.3 表达载体构建的检测
对构建好的载体进行用SGalLDH:5'GTTGGG GAATCATAAACC 3'和 AGalLDH:5'AAACACTTAT CCAACTGGACAAC 3'、S2A12:5'AGCACTTGTTA GACTCATCTG 3'和A2A12:5'AATGGTTTTGGATT AATTGC 3'进行PCR检测,得到一条1880 bp的目的条带和一条850 bp的目的条带(见图3)。
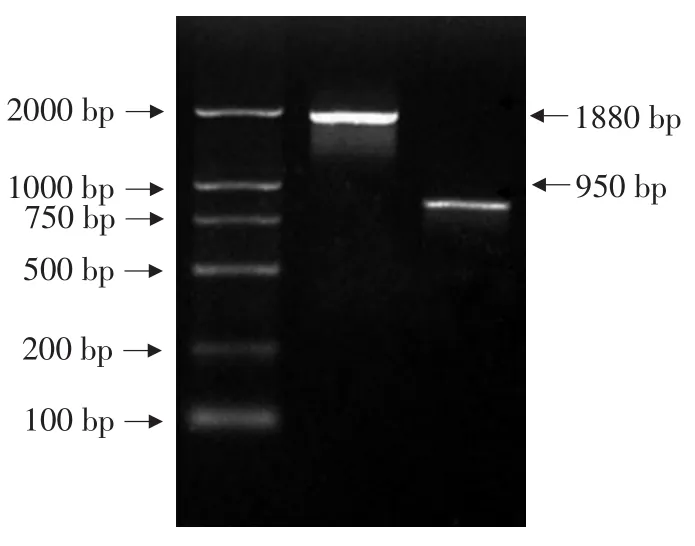
图3 重组质粒的PCR鉴定Fig.3 Detection of recombinant plasmid by PCR
2.4 转基因黄瓜的检测
选用2A12启动子的特异引物对转基因黄瓜进行检测,共得到13株再生植株,其中转基因植株5株。转基因阳性植株扩增条带与预期一致,阴性植株没有扩增出条带,第1道是构建载体,第2道是阴性对照,3~7道是扩增出的阳性条带(见图4)。组培图片中A是子叶节,B是组培苗,C是组培苗的生根过程,D是驯化中的组培苗(见图5)。

图4 转基因黄瓜植株的PCR检测Fig.4 Detection of transgenic Cucumis sativus by PCR

图5 黄瓜组培Fig.5 Cucumber tissue culture
3 讨论与结论
抗坏血酸含量的高低是衡量园艺产品品质的重要指标之一[4],抗坏血酸在光合作用和光合保护中起重要作用[5-6]。抗坏血酸还可以作为一系列重要酶反应的辅因子[3],抗坏血酸和脱氢抗坏血酸的相对比率影响植物的细胞分裂[7]。高等植物抗坏血酸的合成主要是通过L-半乳糖途径,但是也不排除其他途径的可能[8]。本试验中克隆的GalLDH在高等植物中普遍存在。目前造成黄瓜抗坏血酸含量低的原因并不明确,因为抗坏血酸参与植物体内大量的代谢活动,一直处在一个动态平衡的条件下。因此通过黄瓜GalLDH的克隆,为黄瓜中抗坏血酸含量的研究奠定基础,为今后黄瓜抗坏血酸的研究起到辅助作用。不足之处,由于试验使用的是果实特异启动子,组培苗并未结瓜,所以无法检测其抗坏血酸的含量变化。
[1] Agius F,Lamothe R G,Caballero J L V.Engineering increased vitamin C levels in plants by over expression of a D-galacturonic acid reductase[J].Nature Biotechlonogy,2003,21:177-181.
[2] Dvaey M D,Van Montaug M,Inze D,et al.Plnat L-ascorbic aeid:chemistry,function,metabolism,bioavailability,and effects of processing[J].J Sci Food Agr,2000,80:825-860.
[3] 赵丽华,裘娟萍,黄敏,等.抗坏血酸糖类衍生物的研究进展[J].饲料工业,2002,25(2):28-30.
[4] Eskling M,Avridsson P O,Akerlund H E.The xanthophylls cycle,its regulation and components[J].Physiol Palnt,1997,100:806-816.
[5] Potters G,Nele H,Roland J C.Asorbate and dehydroaseorbate influence cell cycle progression in a tobacco cell suspension[J].Plant Physiol,2000,11(24):17-20.
[6] 曲丽,秦智伟.黄瓜白粉病病原菌及抗病性研究进展[J].东北农业大学学报,2007,38(6):835-841.
[7] 石延霞,李宝聚,刘学敏.黄瓜霜霉病研究进展[J].东北农业大学学报,2002,33(4):391-395.
[8] Wheeler G L,Jones M A,Smimoff N.The biosynthetic pathway of vitamin C in higher plants[J].Nature,1998,393:365-369.
[9] Wnag W,Vinocur B,Altmna A.Plant responses to doruhgt,salniity and extreme temperatures:Towards genetic cngineering for stress tolerance[J].Planta,2003,218:1-14.
[10] Yabuta Y,Motoki T,Yoshimura K.Thylakoid membrane-bound ascorbate peroxidase is a limiting factor of antioxidative systems under photo-oxidative stress[J].Plant J,2002,32:915-925.
[11] 张鹏,秦智伟.黄瓜耐热性遗传分析[J].东北农业大学学报,2007,38(4):486-490.

