高效净化污水光合细菌的分离鉴定
马姝萍 赵述淼 郭俊平 葛向阳
(华中农业大学生命科学技术学院 农业微生物学国家重点实验室,湖北 武汉 430070)
光合细菌(Photosynthetic bacteria)简称 PSB,广泛存在于自然界的江河、湖泊、海洋、土壤及活性污泥内。它们具有原始的光能合成体系,以光为能源,能在好氧黑暗或厌氧光照条件下进行光合作用,而作为供氢体和碳源的是自然界的有机物、硫化物、氨等,这就使得光合细菌在自然界的氮、碳、硫循环中发挥着重要作用,具有重要的科学研究价值。也正是由于PSB的这一生理特性,使得其作为水质净化剂在水产养殖和污水净化中显示出强有力的优势。
本研究主要是通过比较不同来源的光合细菌对实际污染水样的处理情况,选择一株具有高效净水效果的菌株,并探讨将其用于生产实践的可能性。
1 材料与方法
1.1 菌种来源
由华中农业大学生命科学技术学院发酵工程室提供沼泽红假单胞菌(Rhodopseudomonas palustris)等3株光合细菌;其它来源于华中农业大学青年湖及食堂污水池。
1.2 培养基及其他试剂
富集培养基:NaCl 2 g、MgSO4·7H2O 0.2 g、NH4Cl 1 g、NaHCO32 g、KH2PO41.75 g、CH3COONa 3 g、酵母粉 1 g,蒸馏水 1000 ml,pH 值 7.0。
分离培养基:添加1%琼脂粉的富集培养基。
T载体试剂盒与引物:均由上海英俊基因技术服务有限公司提供。
波长扫描使用美国Beckman紫外可见分光光度计DU800。
1.3 菌株的分离与筛选
1.3.1 富集
取1 ml污水样本装入已有500 ml富集培养基的盐水瓶中,30℃,60 W白炽灯光照培养7~8 d。待培养液变成红色,吸出红色液体5 ml,连续富集3次。
1.3.2 分离纯化
采用稀释琼脂管与双层平板相结合的方法。取富集液稀释至105倍,吸取0.1 ml加入冷却至45~55℃分离培养基的螺口试管中,30℃,光照培养4~5 d后,挑取红色单菌落,平板划线后铺上一层已冷却至40℃的0.8%琼脂液,30℃光照培养3~4 d,再挑取红色单菌落如此反复2~3次,直至在显微镜下观察菌株形态一致,纯化结束。
1.4 分离菌株对污水处理
取华中农业大学青年湖中水样分装于500 ml盐水瓶中,立即灭菌(121℃,30 min),待冷却至室温后分别接入0.04%的光合细菌培养液(菌数为1.7×109个/ml),无菌操作取200 ml待测水质指标,30℃,光照培养4 d后取200 ml待测水质指标。
1.5 菌种鉴定
1.5.1 16S rDNA序列分析
引物:上游引物 27F:5-agagtttgatcctggctcag-3;下游引物 1492R:5-ggttaccttgttacgactt-3;扩增体系(50 μl):27F 1 μl,1492R 1 μl,ddH2O 23 μl,MasterMix 25 μl,单菌落。扩增条件:94 ℃,5 min;94 ℃,45 s;50 ℃,45 s;72 ℃,2 min;72 ℃,10 min;32个循环;4 ℃,10 min。
1.5.2 T-载体克隆
纯化的PCR产物与PCR 2.1载体连接并转化到E.coliDH5α受体菌,在氨苄青霉素(Amp)筛选平板上挑选克隆子,接于含有Amp的LB培养基过夜培养。取1 ml培养物用于质粒抽提,使用EcoR I酶酶切,点样于琼脂糖凝胶,电泳,选择5500 bp条带相对应的菌进行测序。
1.5.3 生理生化鉴定
该菌株的生理生化特性鉴定参照《常见细菌系统鉴定手册》进行,主要有运动性试验、H2S生成试验、硝酸盐还原试验、过氧化氢酶试验、淀粉水解试验和唯一碳源试验。
1.6 药敏试验
取打孔滤纸片,浸泡在不同抗生素中,稀释菌液1000倍,涂布,待菌液干后,将滤纸片贴在其表面,30℃光照培养5 d,测量抑菌圈直径。以浸泡灭菌蒸馏水的滤纸为空白对照。
2 结果与分析
2.1 菌株的形态特征
通过对不同样品反复分离纯化,得到7株菌,命名为 P1、P2、P3(实验室提供沼泽红假单胞菌)、P4、P5、P6、P7,这几株菌菌落形态较一致,在琼脂管里菌落呈深红色,圆饼状,直径为0.4~1.0 mm。边缘光滑,稍突起,不透明。显微镜观察,P1菌和P3菌呈短杆状,P2、P4、P5、P6、P7 菌呈球状。
2.2 分离菌株对污水处理效果
2.2.1 分离菌株对水体CODMn的去除效果
水体CODMn值是指利用化学氧化剂高锰酸钾将水中可氧化物质(如有机物、亚硝酸盐、亚铁盐、硫化物等)氧化分解,然后根据残留的氧化剂的量计算出氧的消耗量,是表示水质污染度的重要指标。当水体的CODMn值过高,水体变成还原性,导致水生生物死亡,它们的尸体被厌氧菌不完全氧化,产生有机毒物,如尸体中的硫元素会转变成硫化氢,氮元素会变成甲胺等,这些物质不但奇臭无比而且有很强生物毒性,影响水体质量。
取灭菌污水样品,分别投入分离得到的7株菌并检测它们对水体CODMn的去除效果。实验结果见图1。
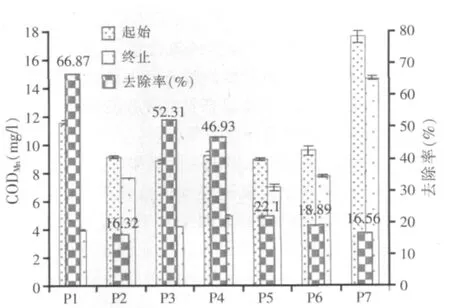
图1 7株光合细菌对青年湖水CODMn的去除效果
从图1可知,这7株菌对水体有机质均有一定的吸收能力,其中P1、P3、P4能力较强,CODMn的去除率分别达到了66.87%、52.31%、46.93%,而其它菌对CODMn的去除效果不明显,均未超过30%。由于不同菌株的生理活性有所差异,它们的培养液中有机质含量可能会不同,导致各个样品的CODMn起始值也有差异。总的来说,P1菌对水体有机质的转化能力很强,能有效降低水体有机质含量,达到净化水体的作用。
2.2.2 分离菌株对水体氨态氮的去除效果
水体氨态氮含量过高会引起藻类及其他浮游生物迅速繁殖,水体溶解氧下降,水质恶化,鱼类及其他生物大量死亡,导致水体的富营养化。人畜长期饮用这样的水,会中毒致病。
取灭菌污水样品,分别投入分离得到的7株菌并检测它们对水体氨态氮的去除效果。实验结果见图2。
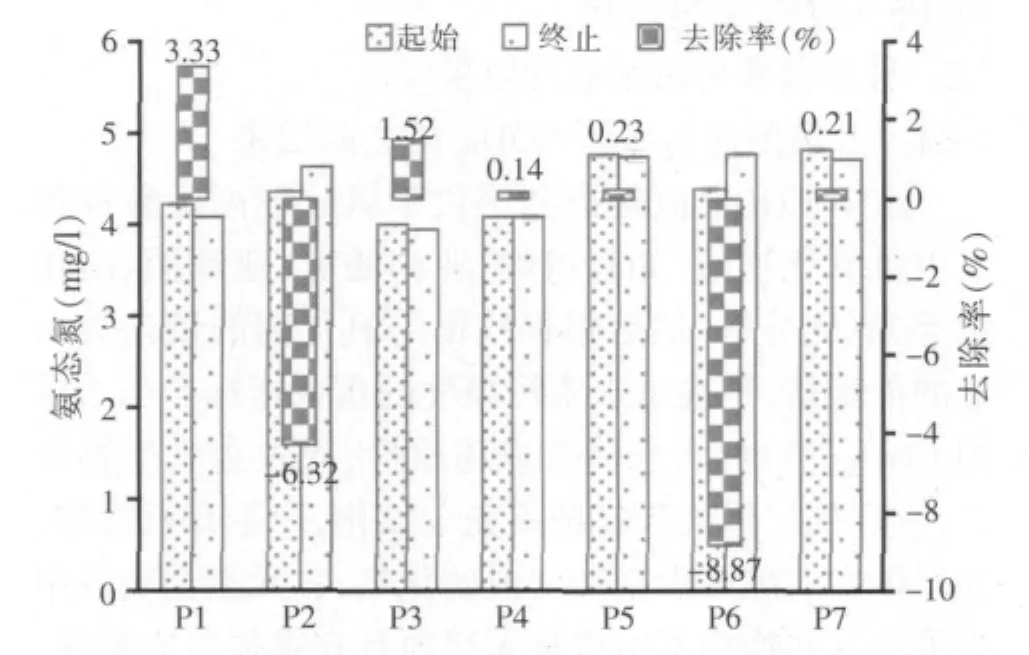
图2 7株光合细菌对青年湖水氨态氮的去除效果
由图 2 分析可知,P1、P3、P4、P5、P7 对水体氨态氮有一定的降低作用,其中P1菌的效果相对于其他菌的效果最好,达到3.33%;P3菌对氨态氮的去除率仅为1.52%,低于P1菌。P2、P6菌不但对氨态氮没有降低作用,反而提高了水体的氨含量,可能是这两株菌对氨态氮的吸收转化活性没有其他菌强。总之,P1菌相对于其他菌对水体氨态氮的吸收转化能力较好,对降低水体氨态氮有一定效果。
2.2.3 分离菌株对污水磷的去除效果
水体的磷含量过高也是水体富营养化的原因之一。水体中过量的磷一方面来自工业废水和生活污水,另一方面,水体中的底泥在还原状态下也会释放磷酸盐。如果不对水体过量的磷进行处理,会造成水体的恶性循环。
取灭菌污水样品,分别投入分离得到的7株菌并检测它们对水体磷的去除效果。实验结果见图3。
这7株菌对水体磷均有一定的去除效果,其中P1菌和P4菌的除磷效果好于其他5株菌,去除率分别为8.03%和9.37%,P3菌的去除效果最差,去除率仅为0.48%。由此可知,P1菌和P4菌对水体磷的降低有一定作用。

图3 7株光合细菌对青年湖水磷的去除效果
通过对以上7株菌处理污水能力的比较,发现P1菌对污水体的CODMn、氨态氮含量、磷含量都有明显的降低作用,能够分别达到66.87%、3.33%和8.03%。表明P1菌净化水质的综合能力较强,确定其为本研究的目的菌株。
2.3 P1菌菌种鉴定
2.3.1 测序结果及序列分析
将相对应的阳性转化子送至上海英俊基因技术服务有限公司测序,序列结果显示目的基因为1568 bp,接近16S rDNA基因片段的长度。用NCBI-Blast软件将测序结果在GenBank等数据库中进行同源性检索。在GeneBank上登录结果显示P1菌的16S rDNA序列与Rhodopseudomonas faecalis(粪红假单胞菌)16S rDNA序列的同源性较高,相似性达到99%。
2.3.2 P1菌生理生化特征
2.3.2.1 形态特征
本菌株为革兰氏染色阴性,短杆状,二分分裂繁殖,运动活跃,菌落呈深红色,圆饼状,直径1.0 mm左右,表面微凸,边缘整齐,光滑湿润。
2.3.2.2 生理生化实验
P1菌的生理生化特征实验结果见表1。

表1 P1菌生理生化特征实验结果
根据上述结果,参照《常见细菌系统鉴定手册》以及16S rDNA的测序结果,P1菌即为粪红假单胞菌(R.faecalis)。
2.4 P1菌活细胞吸收光谱
P1菌株活细胞经过波长300~800 nm范围内连续扫描结果见图4。在300~650 nm波长范围内有3个特征吸收峰,分别位于370、480、590 nm处。在370 nm和590 nm处有吸收峰,说明活细胞中存在细菌叶绿素a;在480 nm处有吸收峰说明活细胞中含有类胡罗卜素。光合细菌的吸收光谱主要受叶绿素a和类胡萝卜素成分的影响。
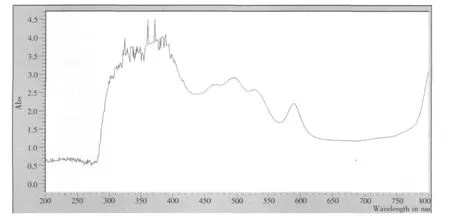
图4 光合细菌P1吸收光谱
2.5 抗生素对P1菌的影响
光合细菌菌剂多用于养殖水体,而养殖水体中多含有添加抗生素的饵料,故需要考虑光合细菌对抗生素的敏感性。药敏实验结果见表2。

表2 P1菌对各种常用抗生素的敏感性(x±s,n=3)
从表2分析可以看出,P1菌对以上7种常用抗生素均有一定的敏感性,其中对庆大霉素最敏感,抑菌圈直径超过1.5 cm,其次是氨苄青霉素和链霉素,抑菌圈接近1.0 cm,最不敏感的是卡那霉素,不足0.7 cm。该结果表明在使用P1菌净化养殖水体时,需要注意饵料中抗生素对其的影响,及时补充P1菌的投放量,确保其在水体微生物中的优势地位以保证净化水质效果。
3 讨论
近20年来,对光合细菌的应用研究获得了很大的进展,但是也出现过不少问题,如菌种纯化问题。在本研究中采用稀释琼脂管法和双层平板法结合分离纯化光合细菌可以弥补因为长期厌氧光照培养导致固体培养基渗水干枯的缺点,强化分离纯化效果。而采用T载体克隆的方法进行光合细菌16S rDNA测序,可以避免杂菌DNA对目的菌的影响,大大提高DNA测序效率。
参照水质监测国家标准对菌株进行净水能力的检测,结果显示分离菌株对水体的有机质、氨态氮和磷有一定的去除作用,但各个菌去除效果不同,可能是因为不同菌株在不同污水中生理活性不同,导致其对水质净化效果有一定差异,尚待进一步研究。
本研究从筛选分离出的7株光合细菌为出发,挑选出一株光合细菌P1,经鉴定,该菌为粪红假单胞菌(R.faecalis),其对污水有机质的去除率达到了66.87%,说明该菌能高效吸收污水中的有机质,对氨态氮和磷的去除也有一定的效果,但去除率均不高,分别为3.33%和8.03%。此外,本研究中的沼泽红假单胞菌(R.palustris)对上述指标的去除率分别为52.31%、1.52%和0.48%。由此可见,粪红假单胞菌各项指标均高于沼泽红假单胞菌。同时对该菌进行了药敏试验,发现该菌对常用抗生素均有一定的敏感性,使用该菌净化养殖水体时需要及时投放光合细菌以保证净化效果。
4 结语
随着工业和养殖业的迅猛发展,水体的污染越来越严重。采用微生物法治理污水,使用方便,投资少、收效快。在水中自然生长、繁殖、再建微生物生态平衡的同时提高水体的自净能力。虽然粪红假单胞菌尚未列入饲用微生物制剂行列,关于其净化水质能力也鲜有报道,但该菌对水体有机质较强的吸收能力必将引起极大的关注,今后在微生物治理污水中有着广泛的应用前景。
[1]东秀英,蔡妙英,等.常见细菌系统鉴定手册[M].北京:科学出版社,2001:29-43.
[2]雷爱莹,彭敏,等.高效净水沼泽红假单胞菌的分离和鉴定[J].广西农业科学,2005,35(1):57-58.
[3]程新,涂晓嵘,等.一株光合细菌的鉴定及其处理污水能力的研究[J].安徽农业科学,2009,37(2):4391-4393.
[4]施安辉,李桂杰,等.光合细菌菌种的分离、富集培养、纯化和菌种鉴定及净化水质的研究[J].内陆水产,2002,10:40-42.
[5]顾祖宜,崎蓓静,等.应用光合细菌处理有机废水的研究[J].中国环境科学,1985,5(2):29-33.
[6]王兰,廖丽华.光合细菌的分离鉴定以及对养殖水的净化研究[J].微生物学杂志,2004,24(2):7-9.
[7]王洪臣,王敏,等.优良醋酸菌种AC2005的鉴定[J].现代食品科技,2008,24(2):513-516.
[8]张德明,黄志勇,等.紫色非硫细菌Rhodocista属一新分离株的鉴定及其系统学研究[J].微生物学报,2000,40(1):14-20.
[9]李小梅,王蔚淼,等.一种评价光合细菌调水作用的实验方法探讨[J].饲料工业,2009,30(8):54-56.
[10]李瑞杰.光合细菌在水处理中的研究[D].南京:南京理工大学,2004.
[11]Toshio S,Yasuo H,Kitamura H.Isolation of Denitrifying Photosynthetic Bacteria[J].Agr.Biol.Chem.,1974,38(9):1749-1751.
[12]Joong K K,Bum-Kyu L,S.H.Kim.Characterization of denitrifying photosynthetic bacteria isolated from photosynthetic sludge[J].Aquacultural Engineering,1999(19):173-193.

