亚超细汉麻粉体生物相容性研究
张 森,张宏杰,张 琦,尚 曼,钟智丽,刘艳霞
(1.天津医科大学药理学教研室,天津300070;2.天津工业大学纺织学院,天津300387)
汉麻纤维被人类广泛应用达数千年。汉麻具有独特的性能,其在纺织、食品、医药、造纸、建材等领域的应用前景非常广阔[1]。汉麻纺织品还具有抗菌、除臭、抗紫外线、抗静电、坚牢耐用等其他纺织品不可比拟的优点[2]。随着人们环保意识的提高,天然纤维材料成为人们的研究热点[3-4],汉麻纤维由于是一种可再生、低成本原料,被广泛采用为合成材料的替代品[5]。同时,汉麻纤维在复合材料应用研究中也越来越广[6-7]。近年来,超细粉体和亚超细粉体由于其优良的物理性能和化学性能越来越受到青睐。超细粉体和亚超细粉体技术已逐渐被应用到很多领域中来。本研究将汉麻纤维制成10~12μm亚超细汉麻粉体,研究其生物相容性,为其在医疗领域的应用提供依据。
1 材料和方法
1.1 实验材料和仪器
1.1.1 亚超细汉麻粉体 由天津工业大学纺织学院提供。
1.1.2 细胞株 NCTC L-929细胞株购自中国科学院细胞库。
1.1.3 动物 健康、初成年新西兰白兔,雌雄不限,体质量2.5~3.0kg;健康、初成年白化豚鼠,雌雄不限,体质量300~350g,均购自于北京市京阜康生物科技股份有限公司,健康证号:SCXK(京)2009-0004。1.1.4主要试剂与仪器 RPMI1640(Gibco公司);胎牛血清(Hyclone公司);胰蛋白酶(美国Sigma公司);四甲基偶氮唑盐(MTT)(美国Sigma公司);二甲基亚砜(天津致远化学试剂有限公司);96孔细胞培养板(加拿大BIOFIL公司);甲醛(天津市化学试剂六厂);2,4-二硝基氯苯(天津光复精细化工研究所);精制芝麻油(美国Sigma公司);超净工作台(苏州净化设备有限公司);倒置显微镜(日本OLYMPUS公司);CO2孵箱(Thermo公司);酶标仪(BIORAD公司)。
1.2 实验方法
1.2.1 细胞毒性实验 本实验按照GB/T16886.5-2003设计和实施[8]。
1.2.1.1 实验分组:(1)正常对照组:用含10%胎牛血清的RPMI1640培养液培养细胞。(2)亚超细汉麻粉体组:用100%、50%、25%、12.5%、6.25%亚超细汉麻粉体浸提液培养细胞。(3)阴性对照组:用高密度聚乙烯浸提液培养细胞。(4)阳性对照组:用含10%胎牛血清的RPMI1640培养液配制的5%DMSO培养细胞。
1.2.1.2 浸提液制备:浸提介质为含10%胎牛血清的RPMI1640细胞培养液。将0.2g亚超细汉麻粉体加入1mL浸提介质中,将6cm2高密度聚乙烯膜加入1mL浸提介质中,在37℃下浸提24h,0.22μm滤膜过滤除菌。将制得的亚超细汉麻粉体浸提原液等比稀释,制备50%、25%、12.5%和6.25%亚超细汉麻粉体浸提液。现制现用。
1.2.1.3 四甲基偶氮唑盐微量酶反应比色法(MTT法)测细胞吸光度值:实验用L-929细胞按1∶3传代,培养足够量的细胞,用细胞培养液配制成4×104个/mL的细胞悬液,取96孔培养板,每孔加200μL细胞悬浮液。将96孔板置于5%CO2、37℃培养箱培养24h。弃去原培养液,按分组每孔加入200μL的浸提液或培养液,每组10孔。培养3d后取出96孔板,于倒置显微镜下观察细胞形态。每孔加入5mg/mL MTT溶液20μL,继续培养4h。弃去孔内液体,每孔分别加入150μL DMSO,将培养板放置10min,水平振摇使孔内溶液颜色均匀。在酶标仪490nm波长下测定吸光度值(optical density,OD)。
1.2.1.4 测定细胞相对增殖率(the relative growth rate,RGR):RGR=(待测孔OD值-空白孔OD值)/(正常对照孔OD值-空白孔OD值)×100%,根据ISO和GB/T中细胞毒性实验的反应分级标准评定材料的毒性,其中毒性反应0~1级为合格医用材料。
1.2.2 一次完整皮肤刺激实验 本实验按照GB/ T16886.10-2003设计和实施[9]。
1.2.2.1 背部备毛:新西兰白兔6只,雌雄各半,体质量2.0~2.5kg。实验前24h,电动推剃掉兔背部脊柱两侧10cm×15cm被毛,作为实验和观察部位。这些部位应没有瑕疵,以免干扰结果的解释。
1.2.2.2 实验给药:(1)亚超细汉麻粉体组:将0.5g亚超细汉麻粉体用0.5mL生理盐水湿化,置于2.5cm× 2.5cm医用纱布上,置于背部左前皮肤部位。用保鲜膜覆盖接触部位,用封闭绷带固定6h。(2)阴性对照组:0.5mL生理盐水滴于医用纱布上,置于右后对照部位,其余处理方法如上。(3)阳性对照组:5%甲醛0.5mL,滴于医用纱布上,置于左后对照部位,其余处理方法如上。
1.2.2.3 结果观察:接触期结束后取下纱布和绷带,用温水洗去受试物。在除去敷贴片后1、24、48、72h自然光线下观察受试部位皮肤的红斑和水肿等反应,按GB/T16886.10-2003皮肤刺激性强度评价标准进行评分。
1.2.3 致敏实验 本实验按照GB/T16886.10-2003设计和实施[9]。
1.2.3.1 亚超细汉麻粉体浸提液制备:用生理盐水按0.2g/mL比例加入亚超细汉麻粉体,在37℃下浸提72h,制备水溶性成分浸提液;用精制芝麻油按0.2g/mL比例加入亚超细汉麻粉体,在37℃浸提72h,制备脂溶性成分浸提液。
1.2.3.2 实验分组:豚鼠随机分为亚超细汉麻粉体生理盐水浸提液组、亚超细汉麻粉体精制芝麻油浸提液组、生理盐水阴性对照组、精制芝麻油阴性对照组和0.1%2,4-二硝基氯代苯阳性对照组,共5组,每组10只。
1.2.3.3 动物备毛:诱导接触实验前24h,用电动推将豚鼠背部5.0cm×6.0cm剃毛,作为实验部位。激发接触前24h,用电动推将豚鼠腹部3.0cm×4.0cm剃毛,作为实验部位。
1.2.3.4 诱导接触:(1)亚超细汉麻粉体浸提液组:将4.0cm×5.0cm滤纸分别浸透亚超细汉麻粉体生理盐水浸提液和亚超细汉麻粉体精制芝麻油浸提液,置于豚鼠实验部位,两层纱布覆盖,然后用胶带固定6h。(2)阴性对照组:用同样大小的滤纸分别浸透生理盐水和精制芝麻油,置于相应实验部位,其余处理方法如上。(3)阳性对照组:用同样大小的滤纸浸透由无水乙醇和生理盐水(1∶3)配成的0.1% 2,4-二硝基氯代苯作同样处理。6h后除去覆盖物。1周中连续3d重复该步骤,共3周。每次实验前应重新剃毛,保证受试物与皮肤充分接触。
1.2.3.5 激发接触:在末次诱导后第14天,按诱导接触的同样方法,用2.0cm×3.0cm滤纸浸透相应各组浸提液,置于腹部3.0cm×4.0cm去毛区,持续6h后除去滤纸。
1.2.3.6 结果观察:24h和48h后按GB/T16886. 10-2003给出的分级标准分别对实验部位皮肤红斑和水肿评分。
2 结果
2.1 MTT实验结果
2.1.1 加样后72h镜下观察孔内细胞,可见正常对照组和阴性对照组细胞形态呈长条梭形或不规则多边形,细胞贴壁良好,无空泡,细胞数量增加正常。6.25%亚超细汉麻粉体浸提液组大部分细胞呈长条梭形或不规则多边形,细胞贴壁良好,细胞间空隙较小。12.5%、25%亚超细汉麻粉体浸提液组大部分细胞呈长条梭形或不规则多边形,细胞贴壁良好,但明显可见细胞溶解和细胞间空间。50%亚超细汉麻粉体浸提液组多数细胞呈圆形或溶解。100%亚超细汉麻粉体组和阳性对照组细胞呈圆形,胞核固缩或崩解,细胞层几乎完全破坏,见图1。

图1 亚超细汉麻粉体对L-929细胞形态的影响(×10)Fig 1 Effect of hemp powder with submicron-scale on the L-929cell morphology(×10)
2.1.2 各组细胞RGR MTT实验中用DMSO充分溶解MTT还原产物,并检测各组OD值,测定细胞RGR,阳性对照组和100%亚超细汉麻粉体浸提液组毒性为4级,50%亚超细汉麻粉体浸提液组毒性为3级,25%和12.5%亚超细汉麻粉体浸提液组毒性为2级,据ISO和GB/T标准为不合格医用材料。阴性对照材料毒性为0级,6.25%亚超细汉麻粉体浸提液组毒性为1级,为合格医用材料。阴性对照组间与正常对照组差异无统计学意义(P>0.05),各浓度亚超细汉麻粉体浸提液组与正常对照组间差异有统计学意义(P<0.05),各组与阳性对照组比较均有统计学差异(P<0.05),见表1。
2.2 一次完整皮肤刺激实验结果 阳性对照组可以明显观察到红斑、水肿等刺激性反应。亚超细汉麻粉体组和阴性对照组皮肤肉眼观察均未见红斑、水肿等刺激性反应,见表2。
表1 亚超细汉麻粉体对L-929细胞RGR的影响及细胞毒性等级(±s,n=10)Tab 1 Effect of hemp powder with submicron-scale on the L-929cell RGR and cytotoxic levels(±s,n=10)
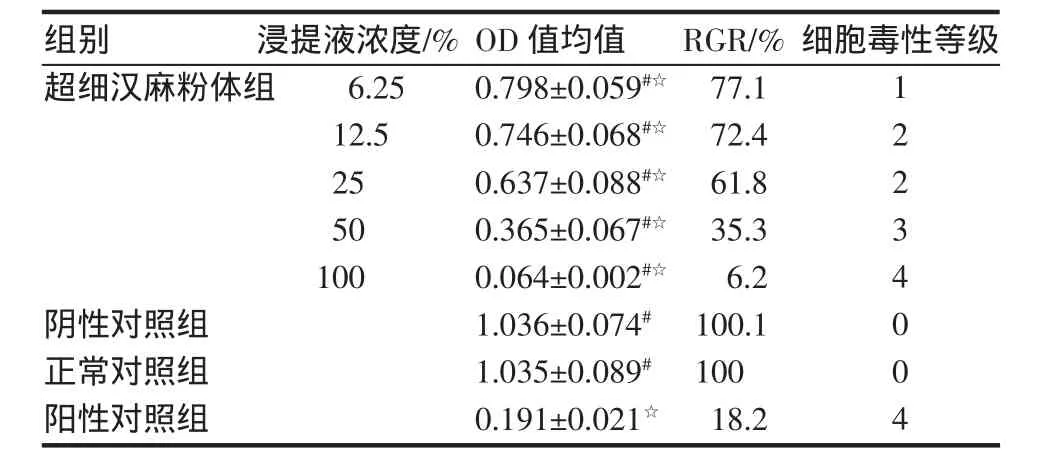
表1 亚超细汉麻粉体对L-929细胞RGR的影响及细胞毒性等级(±s,n=10)Tab 1 Effect of hemp powder with submicron-scale on the L-929cell RGR and cytotoxic levels(±s,n=10)
与阳性对照组比较#P<0.05;与正常对照组比较☆P<0.05
组别超细汉麻粉体组浸提液浓度/% 6.2512.52550100细胞毒性等级阴性对照组正常对照组阳性对照组OD值均值0.798±0.059#☆0.746±0.068#☆0.637±0.088#☆0.365±0.067#☆0.064±0.002#☆1.036±0.074# 1.035±0.089# 0.191±0.021☆RGR/% 77.172.461.835.36.2100.110018.212234004

表2 亚超细汉麻粉体对新西兰兔皮肤刺激的结果Tab 2 The results of dermal irritation hemp powder with submicron-scale in New Zealand rabbits
2.3 皮肤致敏实验结果 表3结果显示,阳性对照组在激发接触后24h和48h,豚鼠腹部出现明显红斑和水肿,致敏率100%,其余各组动物腹部均未出现异常现象。
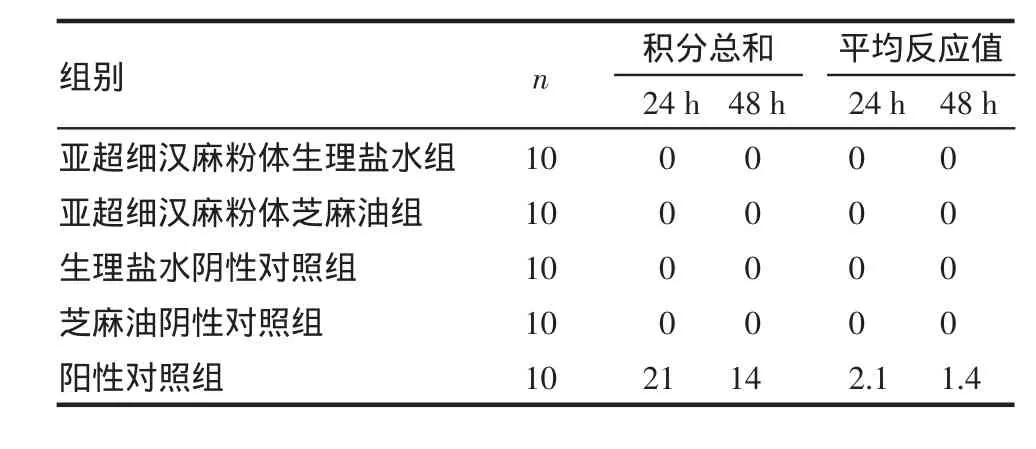
表3 亚超细汉麻粉体对豚鼠致敏的结果Tab 3 Theresults of sensitizationtes the mppowderwithsubmicronscale in guinea pigs
3 讨论
生物相容性是指材料在宿主的特定环境和部位,与宿主直接或间接接触时所产生相互反应的能力,是材料在生物体内处于静态和动态变化过程中,能耐受宿主各系统作用而保持相对稳定,不被排斥和破坏的生物学性质。任何材料在用于人体之前都必须通过全面的生物相容性检测,以期可安全适用于人体,检测方法一般包括体内实验、体外实验(动物实验和临床应用前实验)等。医学生物材料应用于人体后,有的医学生物材料甚至终生存留在体内,因此,对其进行生物相容性和安全性评价就显得尤为重要。参照我国医疗器械生物学评价标准(GB/T16886)的要求,笔者对亚超细汉麻粉体进行了部分生物相容性评价。细胞毒性实验是评价生物材料与细胞间相互作用的重要指标。MTT法是一种快速评定细胞毒性和细胞增殖的比色分析法,最初应用于免疫学领域,随后才在生物材料的检测中应用。该方法可以快速、准确、灵敏地反映出细胞增殖程度和材料对细胞造成的细胞毒性损害程度[10]。本研究选择MTT法来测算细胞RGR,并将细胞相对增殖率换算成毒性分级,来评估实验材料的细胞毒性。研究结果显示,随着亚超细汉麻粉体浸提液浓度的提高,OD值会有所下降,说明浸提液浓度和L929细胞的增殖有明显的依赖关系,细胞毒性分级为1~4级,6.25%亚超细汉麻粉体浸提液有极轻细胞毒性,12.5%和25%亚超细汉麻粉体有轻微细胞毒性,50%和100%亚超细汉麻粉体浸提液有中度细胞毒性。6.25%亚超细汉麻粉体浸提液符合生物材料要求。皮肤刺激实验和致敏实验是评价生物材料与组织间相互作用的重要指标。笔者参照我国医疗器械生物学评价标准开展了上述实验。结果表明,6.25%亚超细汉麻粉体是一种无刺激性和致敏性的生物材料,符合生物安全性要求,将在医学领域有一定的应用前景。
[1] 张建春,张华.汉麻纤维的结构性能与加工技术[J].高分子通报, 2008,12(2):44
[2] 龚飞.汉麻纤维及其应用[J].山东纺织科技,2010,6(3):48
[3] CheungH Y,HoMP,LAUKT,et al.Natural fiber reinforced composites for bioengineering and environmental engineering applications[J].Composites,Part B:Engineering,2009,40(7):655
[4] Liu L F,Yu J Y,Cheng L D.Mechanical properties of poly(butylene succinate)(PBS)biocomposites reinforced with surface modified jute fiber[J].Composites,Part A:Applied Science and Manufacturing,2009,40(5):669
[5] Le Troёdec M,Rachini A,Pevratout C,et al.Influence of chemical treatments on adhesion properties of hemp fibres[J].J Colloid Interface Sci,2011,356(1):303
[6] 牛鹏飞,陈建野,卫晓明,等.PP-MAH对PP/汉麻纤维复合材料结构及性能的影响[J].中国塑料,2010,12(12):46
[7] Sawpan M A,Pickering K L,Fernyhough A,et al.Effect of fibre treatments on interfacial shear strength of hemp fibre reinforced polylactideandunsaturatedpolyestercomposites[J].CompositesPart A,2011,42(9):1189
[8] GB/T 16886.5-2003/ISO 10993-5:细胞毒性试验[S].医疗器械生物学评价-第5部分,1999.
[9] GB/T 16886.10-2005/ISO 10993-10:刺激与迟发性超敏反应试验[S].医疗器械生物学评价-第10部分,2002.
[10]Thonemann B,Schmalz G,Hiller K A,et al.Responses of L929mouse fibroblasts,primary and immortalized bovine dental papilla-derived cell lines to dental resin components[J].Dent Mater, 2002,18(4):318

