薯蓣皂苷对氧化低密度脂蛋白诱导血管内皮细胞凋亡的保护作用
苏 健,郭卫莉,李 欣,康 毅,高卫真
(天津医科大学药理学教研室,天津 300070)
动脉粥样硬化(atherosclerosis,AS)是世界上最常见的心血管疾病。在AS的起始和发展过程中内皮细胞(EC)的功能障碍起着关键作用,被视为独立的危险因素。氧化低密度脂蛋白(Ox-LDL)在AS的发病因素中格外重要,因为其可以损伤EC[1-2],降低EC的增殖和一氧化氮(NO)水平加速AS[3]。本研究采用牛胸主动脉内皮细胞的体外培养,以150μg/mL浓度Ox-LDL作用6h的条件下,建立血管EC损伤模型,应用薯蓣皂苷(Dioscin)进行预先给药24h做预防性治疗,研究薯蓣皂苷对Ox-LDL诱导血管内皮细胞凋亡的保护作用,探讨薯蓣皂苷对Ox-LDL诱导血管内皮细胞凋亡的保护作用机制。
1 材料与方法
1.1 材料 薯蓣皂苷粉:国家天然药物研究中心提供,纯度为98%;Ox-LDL:广州奕源生物科技有限公司;低糖DMEM培养基:北京天润善达生物科技有限责任公司;南美胎牛血清(FBS):Hyclone公司;胰蛋白酶-EDTA:Gibco公司;MTT:中奥天元公司;NO测定试剂盒:南京建成生物工程研究所;牛内皮素酶联免疫分析试剂盒:RD公司;Annexin V--FITC细胞凋亡测定试剂盒、BCA蛋白浓度测定试剂盒、Western及IP细胞裂解液、SDS-PAGE凝胶配制试剂盒、辣根过氧化物酶标记二抗、Tublin抗体:碧云天生物技术研究所;Tween-20:天津市化学试剂一厂;预染蛋白质Marker:Fermantas公司;发光底物试剂盒:博士德生物有限公司;牛血清白蛋白:美国Sigma公司;eNOS一抗:英国Abcam公司。
1.2 实验方法
1.2.1 牛主动脉内皮细胞(Bovine aortic endothelial cells,BAECs)的培养和鉴定 完整分离牛胸主动脉,用PBS冲洗移至托盘后进超净台,纵向剪开,用PBS冲洗后剪成2~3cm×2~3cm块状。在培养皿中滴加0.25%胰酶,内膜面朝下平铺。37℃消化10~ 15min。加入含10%FBS的培养液终止。轻轻刮取,将EC种植于含20%FBS的完全培养液中,置于37℃,5%CO2培养箱中,24h后换液,细胞长至融合状态后即可传代。倒置相差显微镜下细胞呈扁平多角形,铺路石状。VIII因子相关抗原免疫组化染色为阳性,3~10代可用于实验。
1.2.2 实验分组 设5个实验组:(1)对照组(control):先用含10%FBS的完全培养液培养24h,再换用含5%FBS的完全培养液培养6h;(2)模型组:先用含10%FBS的完全培养液培养24h,再加入终浓度为150μg/mL的Ox-LDL培养6h;(3)薯蓣皂苷低、中、高浓度干预组(Dio L、M、H):先分别用终浓度为4.8、12、30μg/mL的薯蓣皂苷培养24h,再换用终浓度为150μg/mL的Ox-LDL培养6h。
1.2.3 MTT法检测细胞存活率 取各组培养的细胞,调整密度,种于96孔板,每孔加入0.5%MTT溶液10μL,4h后弃上清,每孔加入150μL DMSO,震荡10min,490nm波长处检测吸光度,细胞存活率(%)=OD检测组/OD对照组×100%。
1.2.4 流式细胞术分析测定细胞凋亡率 收集每组刮取的细胞,重悬,离心1000×g,5min。弃上清,收集细胞,用PBS重悬并计数。取密度为5×104~1× 105个/mL重悬的细胞,离心1000×g,5min,弃上清,先加入195μL Annexin V-FITC结合液重悬,再加入5μL Annexin V-FITC,混匀。室温避光孵育10min。离心1000×g,5min,弃上清,加入190μL Annexin V-FITC结合液重悬。加入10μL碘化丙啶染色液,混匀,冰浴避光放置。1h内上机进行检测以Expo32软件处理分析、计算凋亡率。
1.2.5 硝酸还原酶法测定NO浓度 取各组上清,按照NO测定试剂盒说明书操作,利用酶标仪比色法进行定量检测。
1.2.6 双抗体夹心法测定内皮素(ET)浓度 用无菌管收集各组细胞上清,按照牛内皮素酶联免疫分析试剂盒说明书操作,利用酶标仪进行检测。
1.2.7 Western Blot测定内皮细胞eNOS的蛋白表达 取培养的各组细胞,弃液后用PBS洗涤2~3遍。加入裂解液(6孔板每孔100μL)后置于冰上10~20min。刮下细胞,收集在EP管中。12000×g离心,4℃,2min。吸取上清液(目的蛋白)并将其转移至新EP管中,BCA法进行定量。取蛋白质样品并与1/4体积的5×上样缓冲液充分混匀,100℃煮沸5~10min,离心,静置。用电泳缓冲液清洗加样孔,按顺序加样,将与上样缓冲液混匀的样本蛋白按每孔30μg加入。通过SDS-聚丙烯酰胺凝胶电泳分离,分离的蛋白用电转移法转到PVDF膜,5%脱脂牛奶中室温摇动1.5h封闭,加入以1∶1000稀释的一抗,4℃过夜。再加入TBST稀释的辣根过氧化物酶标记二抗,室温摇动孵育1.5h,显色,曝光。观察结果并扫描,采用Image J软件对条带进行灰度值分析,以eNOS蛋白与内参照Tublin灰度比值代表eNOS蛋白表达水平。
2 结果
2.1 MTT法检测细胞存活率 与对照组比较,模型组存活率降至68.49%,比对照组有显著性降低(P< 0.01);薯蓣皂苷低中高浓度组存活率比模型组明显升高(P<0.01;P<0.01;P<0.05),损伤明显减轻,且3个药物组之间两两比较均有统计学差异(P<0.05)。见表1。
表1 薯蓣皂苷对Ox-LDL诱导的BAECs存活率的影响(±s,n=6)Tab 1 Effect of dioscin on BAECs proliferation induced by Ox-LDL (±s,n=6)
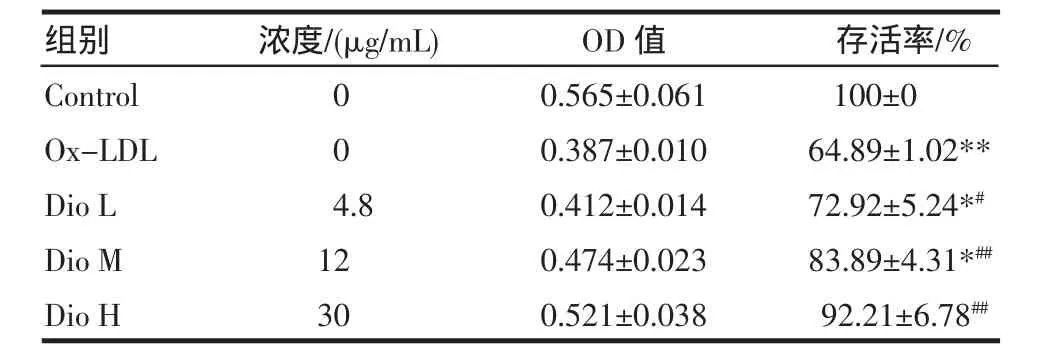
表1 薯蓣皂苷对Ox-LDL诱导的BAECs存活率的影响(±s,n=6)Tab 1 Effect of dioscin on BAECs proliferation induced by Ox-LDL (±s,n=6)
与对照组比较*P<0.05,**P<0.01;与模型组比较#P<0.05,##P<0.01
4.81230组别Control Ox-LDL Dio L Dio M Dio H浓度/(μg/mL) 00OD值0.565±0.0610.387±0.0100.412±0.0140.474±0.0230.521±0.038存活率/% 100±064.89±1.02** 72.92±5.24*# 83.89±4.31*## 92.21±6.78##
2.2 流式细胞术分析测定细胞凋亡率 结果显示,在正常培养时EC发生少量凋亡,模型组细胞凋亡率增加(P<0.01);3个不同浓度薯蓣皂苷干预组凋亡率较模型组降低(P<0.01;P<0.01;P<0.05),且呈浓度依赖性。表明不同浓度薯蓣皂苷均能抑制Ox-LDL诱导的EC凋亡。见表2。
2.3 硝酸还原酶法测定NO浓度 与对照组相比,模型组的NO浓度显著降低(P<0.01)。薯蓣皂苷低、中、高3个浓度进行干预后,与模型组相比,NO浓度升高(P<0.01;P<0.01;P<0.05),且3个浓度之间具有统计学差异。见表2。
2.4 双抗体夹心法测定ET浓度 与对照组相比,模型组的ET浓度升高(P<0.05)。薯蓣皂苷低、中、高3个浓度进行干预后,与模型组相比,ET浓度降低(P<0.05;P<0.05;P<0.05),且3个浓度之间具有统计学差异。见表2。
表2 薯蓣皂苷对Ox-LDL诱导的BAECs凋亡率,NO浓度和ET浓度的影响(±s,n=6)Tab 2 Effect of dioscin on apoptosis rate,NO concentration and ET concentration in BAECs induced by Ox-LDL(±s,n=6)
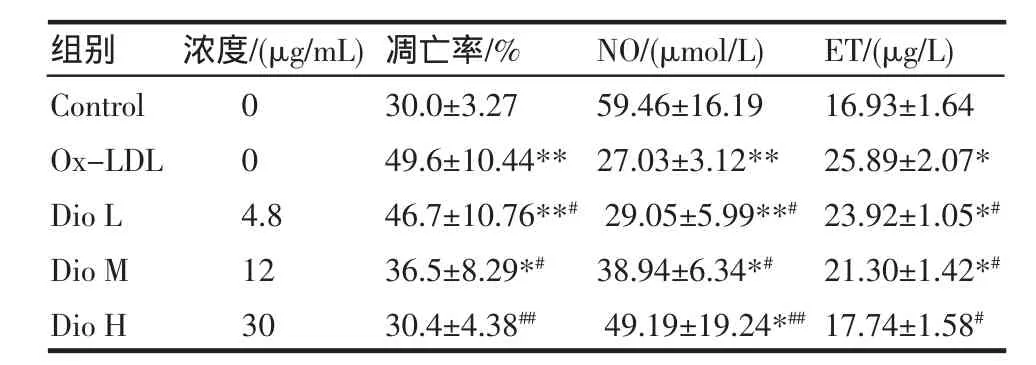
表2 薯蓣皂苷对Ox-LDL诱导的BAECs凋亡率,NO浓度和ET浓度的影响(±s,n=6)Tab 2 Effect of dioscin on apoptosis rate,NO concentration and ET concentration in BAECs induced by Ox-LDL(±s,n=6)
与对照组比较*P<0.05,**P<0.01;与模型组比较#P<0.05,##P<0.01
ET/(μg/L) 16.93±1.6425.89±2.07* 23.92±1.05*# 21.30±1.42*# 17.74±1.58#组别Control Ox-LDL Dio L Dio M Dio H浓度/(μg/mL) 004.81230凋亡率/% 30.0±3.2749.6±10.44** 46.7±10.76**# 36.5±8.29*# 30.4±4.38## NO/(μmol/L) 59.46±16.1927.03±3.12** 29.05±5.99**# 38.94±6.34*# 49.19±19.24*##
2.5 Western Blot测定eNOS蛋白表达 Western Blot检测结果显示,对照组有一定量的eNOS蛋白表达,Ox-LDL诱导使EC的eNOS蛋白表达明显降低,条带强度明显减弱(P<0.01);加入不同浓度薯蓣皂苷预干预后,eNOS蛋白表达明显增强,条带强度恢复,并呈一定的剂量依赖性(P<0.05)。见图1。

3 讨论
AS是一种由血脂代谢障碍、内皮功能障碍和持续炎症等触发的慢性致病过程[4],是危害人类健康的主要疾病之一。对于AS发病机制的研究一直是心血管疾病研究的热点。内皮细胞的凋亡可能对动脉粥样硬化脂质斑块的侵蚀与破裂起着重要作用,而Ox-LDL是引起内皮细胞凋亡和坏死的关键因素。
Ox-LDL无论是通过结合并激活其血凝素样氧化低密度脂蛋白受体-1(LOX-1),还是通过直接的细胞毒作用,皆可抑制内皮源性血管舒张因子NO的生成,并促进血管收缩因子ET的合成和释放。Ox-LDL能损伤血管内合成和释放NO的功能,其机制可能涉及一氧化氮合酶(NOS)的基因调控和活性调节,也可能仅仅是LDL氧化过程中生成的超氧阴离子对细胞外NO的灭活增加所致,从而抑制NO合成。Ox-LDL还能促进血栓形成[5],同时Ox-LDL作用于内皮,可导致局部血液凝固机制紊乱,引发纤维蛋白在血管壁沉积,这是AS发生发展中的重要环节。此外,Ox-LDL可以通过诱导内皮表面形成血管细胞黏附分子(VCAM-1)和细胞间黏附分子-1(ICAM-1)[6]及影响AS斑块稳定性等因素导致内皮细胞损伤。本研究采用Ox-LDL作为诱导剂,制备血管内皮细胞的损伤模型,这和机体AS的病理损伤十分接近。研究显示,牛胸主动脉内皮细胞对Ox-LDL诱导的细胞存活率降低具有浓度和时间依赖性,与文献报道一致[7]。
现代药理研究表明,薯蓣皂苷具有明显的心血管作用,作用机制包括稳定心肌细胞搏动频率、降低线粒体膜电位、减轻钙超载[8]、改善能量代谢[9]。本研究发现不同浓度的薯蓣皂苷均能显著提高Ox-LDL诱导损伤的EC存活率,使ET合成与分泌减少,NO合成与分泌增加,从而提高eNOS的表达。冠心病死者的冠状动脉组织以及活体冠状动脉组织的研究均表明,在粥样斑块表面覆盖的内皮细胞内,eNOS表达均降低[10]。还有研究表明,对AS家兔进行eNOS转基因处理,7d后AS病变消退[1]。同样在AS动物模型中,注入eNOS抑制剂或是通过eNOS基因敲除,均能抑制NO的形成,促进AS发生[12]。但其深入的作用机制还有待于进一步地研究探讨,如薯蓣皂苷如何激活eNOS。
综上所述,本研究证实了Ox-LDL对EC增殖有较强的抑制作用,呈现浓度和时间依赖性,薯蓣皂苷对Ox-LDL诱导的EC凋亡具有重要保护作用,且呈浓度依赖性。这一研究结果为进一步研究薯蓣皂苷在AS治疗方面提供了一定的理论基础,对心血管疾病的预防、治疗及预后有着积极的意义。
[1] Blanco F J,Grande M T,Langa C,et al.S-endoglin expression is induced in senescent endothelial cells and contributes to vascular pathology[J].Cir Res,2008,103(12):1383
[2] Chahine MN,Blackwood DP,DibrovE,et al.Oxidized LDL affects smooth muscle cell growth through MAPK-mediated actions on nuclear protein import[J].J Mol Cell Cardiol,2009,46(3):431
[3] Fernández-HernandoC,YuJ,Dávalos A,et al.Endothelial-specific over expression ofcaveolin-1accelerates atherosclerosis in apolipoproteinE-deficientmice[J].AmJPathol,2010,177(2):998
[4] Dong K,Ge J H,Gu S L.Ox-LDL can enhance the interaction of mice natural killer cells and dendritic cells via the CD48-2B4pathway[J].Heart Vessels,2011,26(6):637
[5] 魏婧婧.氧化低密度脂蛋白与动脉粥样硬化[J].心血管病进展,2008,3(29):38
[6] Poston R N,Haskard D O,Coucher J R,et al.Expression of intercellular adhesion molecule-1in atherosclerotic plaques[J].Am J Pathol,1992,140(3):665
[7] 何翠瑶,李晓辉.三七皂苷对氧化低密度脂蛋白损伤血管内皮细胞保护作用的研究[J].中国药房,2008,19(6):401
[8] 高卫真,王玮,范晓静,等.薯蓣皂苷对培养乳鼠心肌细缺氧/复氧损伤的保护作用[J].中国分子心脏病学杂志,2008,8(2):72
[9] 范晓静,焦建杰,赵云茜,等.薯蓣皂苷对大鼠缺血再灌注心肌能量代谢的影响[J].天津医科大学学报,2008,14(4):409
[10]Lerman A,Zeiher A M.Endothelial function:cardiac events[J]. Circulation,2005,111(3):363
[11]Hayashi T,Sumi D,Juliet P A,et al.Gene transfer ofendothelial NO synthase,but not eNOSplus inducibe NOS,regressed atherosclerosis in rabbits[J].Cardiovascl Res,2004,61(2):339
[12]Rossi ML,Marziliano N,Merlini P A,et al.Phenotype commitment in vascular smooth muscle cells derived from coronary ather osclerotic plaques:differential gene expression of endothelial nitric oxidesynthase[J].Eur J Histochem,2005,49(1):39

