家蚕促咽侧体素受体基因克隆及发育表达
邱娜莎, 刘 畅, 严雅静, 魏兆军
(合肥工业大学 生 物与食品工程学院,安徽 合 肥 230009)
0 引 言
促咽侧体素(Allatotropin,简称AT)是一种多功能的神经肽,其功能包括促进保幼激素(JH)和促肌蛋白的生物合成、加速心脏搏动,抑制活性离子运输等[1]。家蚕促咽侧体素是一组结构相关的神经肽家族的成员之一,这组神经肽在昆虫和其他无脊椎动物中广泛分布。神经肽受体的鉴定可以通过它们的生化分离、基因克隆及生物活性检测等方法实现,它们通常是根据第1次被发现的活性来命名的,AT受体首先是在烟草天蛾中得以鉴定的[2]。
G蛋白偶联受体(GPCRs)家族的绝大多数成员在结构上都有一个7次疏水跨膜区域,神经肽作为配体通过结合其高亲和性受体对细胞靶点起作用[3]。神经肽结合产生的信号可以介导一个GTP结合蛋白(G蛋白)的激活,导致第2信使的水平的改变,反之,使靶细胞和生物物体的功能产生变化[4]。本文克隆了家蚕促咽侧体素受体基因(Bommo-ATR),对其蛋白三维结构和跨膜结构进行预测,构建系统遗传树,并进行了mRNA的发育变化分析。
1 材料与方法
1.1 材料
家蚕品种P50由中国农业科学院蚕业研究所提供,饲养条件(23±1)℃、每日光照14h,黑暗10h、70%~80%的相对湿度。从幼虫5龄第1天起一直到成虫第1天(其中包括幼虫5龄阶段7d、吐丝期3d、蛹期8d、成虫期1d,共19d)解剖家蚕的脑-咽下神经节复合体(Br-SG),每天解剖90头,30个组织为一个样品,每天取3个样品。整个操作在冰上进行,解剖后将装有脑-咽下神经节复合体的EP管迅速放入-80℃冰箱中保存备用。
1.2 RT-PCR
利用RNAiso Plus试剂盒(TaKaRa,大连)提取家蚕Br-SG的RNA,利用cDNA第1链合成试剂盒(TaKaRa,大连)合成cDNA,然后BRO16F和BRO16R扩增家蚕ATR的ORF,见表1所列。PCR产物经电泳后,在紫外条件下,用手术刀切出目的片段,再用胶回收试剂盒(TaKaRa,大 连)连 接 到 PMD-18T 载 体 中(TaKaRa,大连),筛选阳性克隆后进行序列测定(上海生工公司,上海)。
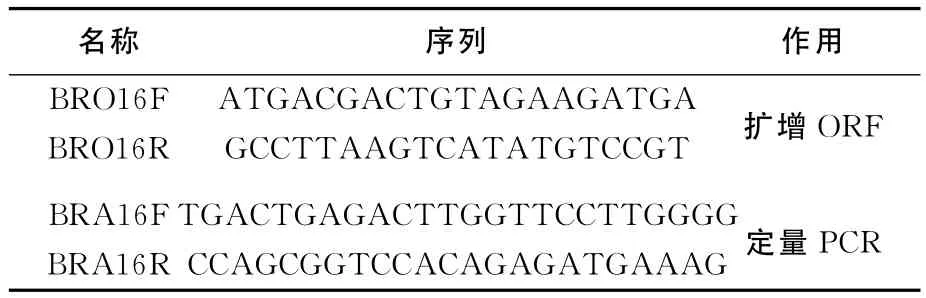
表1 扩增家蚕ATR所用的引物序列
1.3 蛋白结构模拟
通 过 SWISS-MODEL 的 First Approach mode(简捷模式)行蛋白质三维结构的模拟。SWISS-MODEL服务器是以用户输入信息的最小化为目的设计的,直接提供家蚕ATR蛋白的氨基酸序列,选择简捷模式,在CPHmodels 2.0 server服务器上做结构预测,得到蛋白质三维结构后,运用RASWIN软件来看蛋白质分子的三维模型[5]。
1.4 荧光定量PCR
对于解剖所得的19d的样品提取总RNA,使用DNase I处理除去基因组DNA后,取1μg总RNA反转录为cDNA(总体积25μL),取约10ng cDNA进行荧光定量PCR反应。利用纯化后的PCR产物定量后来制作标准曲线 (含108~103个基因拷贝数)。实时荧光定量PCR反应采用荧光染料SYBR Green I(TaKaRa,大连)在Bio-rad iCycler iQ (美国伯乐公司)用0.2mL薄壁PCR管(AXYGEN,美国)进行。荧光定量PCR反应体系为20μL(2个引物各1μL,模板cDNA 1μL,SYBR Green I Real-time PCR Master Mix 10μL,双蒸水2μL)。用iQ 5Multicocolor Real-Time PCR Detection System (Bio-Rad)程序执行,PCR反应程序为95℃预变性3min,95℃变性15s,58℃退火30s,72℃延伸30s;循环35次;熔解曲线从55~95℃,每5℃读取一个荧光值。
本文采用以上步骤中稀释成不同的浓度梯度的PCR回收产物作为已知起始拷贝数的标准品,利用Real-Time PCR测定不同稀释梯度的CT值,进而制作成标准曲线。以拷贝数的lg值为横坐标,以CT值为纵坐标做标准曲线,公式为:

其中,a值根据不同基因和不同PCR片段而不同。得出标准曲线后可以根据机器测定的未知样品的CT值代入公式,得到样品的起始拷贝数。
2 结果与分析
2.1 家蚕ATR的扩增和序列分析
以家蚕脑和咽下神经节的cDNA作为模板,利用BRO16F和BRO16R扩增获得的PCR产物电泳后条带清晰,大小约1.3kb,与预期的结果一致,如图1所示。

图1 扩增家蚕ATR的ORF的PCR结果
克隆到T载体后,序列测定获得1 254bp的序列,分析表明包含家蚕ATR的ORF的全长序列,编码416个氨基酸,如图2所示。本文从测定的Bommo-ATR与基因组预测的比较来看,存在5个碱基差别,但氨基酸仅有1个发生变化(即23位的H替换为Y)。
Bommo-ATR推导氨基酸序列的二级结构预测[6]表明,家蚕的ATR为7次穿膜蛋白,N-端位于胞外,C-端位于胞内。家蚕ATR蛋白跨膜结构域预测,如图3所示。从图3可以看出,7个穿膜结构域(transmembrane region,简称TM)分别为(按照416个氨基酸的的相对位置,方向为N-端 → C-端):75~97、110~132、147~169、190~209、237~259、299~321和331~353。Bommo-ATR的结构符合GPCR家族成员的典型特征[7]。

图2 家蚕ATR ORF核苷酸和氨基酸序列
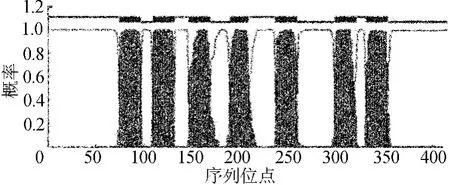
图3 家蚕ATR蛋白跨膜结构域预测
进一步利用SWISS-MODEL的First Approach mode预测家蚕ATR的3D结构,如图4所示,结果表明,家蚕ATR蛋白的3D结构包含18个螺旋,其中主要的α-螺旋有7个,与7次跨膜结构一致。
利用NJ方法,依据不同物种ATR的氨基酸序列构建的系统树,如图5所示,其中人的Orexin受体被选为外群。结果表明,家蚕的ATR与烟草天蛾的ATR关系最接近,其次与家蚕的另一个 促 咽 侧 体 素 受 体 BNGR-A5[8](GenBank NM-001134268)关系较接近,家蚕的ATR与埃及伊蚊[9]、小金蜂[10]、赤拟谷 盗[11]的 ATR 距 离较远,这与传统的系统关系一致[12]。

图4 预测的家蚕ATR蛋白3D结果

图5 基于不同昆虫ATR氨基酸序列的系统树
2.2 家蚕ATR发育变化
从家蚕5龄第1天到发蛾第2天,每天解剖脑和咽下神经节复合体,用于分析家蚕ATR的mRNA发育变化[13-14]。本试验通过设定不同浓度梯度的ATR基因PCR产物作为荧光定量PCR的标准品,制备定量的标准曲线。本试验利用荧光定量PCR的方法最低可以检测到103拷贝数的模板,家蚕ATR基因的标准曲线的线性拟合方程为:

其中,Y为CT;X为模板拷贝数的lg值。标准曲线在103~108之间显示了很强的线性相关性,定量标准曲线的相关性系数为0.997 5,表明所制作的标准曲线非常理想,适合用来检测ATR基因的拷贝数。ATR基因扩增标准曲线如图6a所示。ATR基因荧光定量PCR反应的熔解曲线如图6b所示。
由图6b可看出,随着温度的升高,荧光信号随之下降。这是因为温度的升高会导致越来越多的DNA双链被打开,与之结合的SYBR GreenⅡ染料也被释放出来。荧光强度发生变化的拐点(熔点,Tm)处可以清楚地看到一个单一的峰,PTTH基因大约是在85℃,这个峰所对应的是扩增产物的熔解温度。同时除了单一的峰之外,没有杂峰,表明实验中没有污染、引物二聚体和假阳性现象。
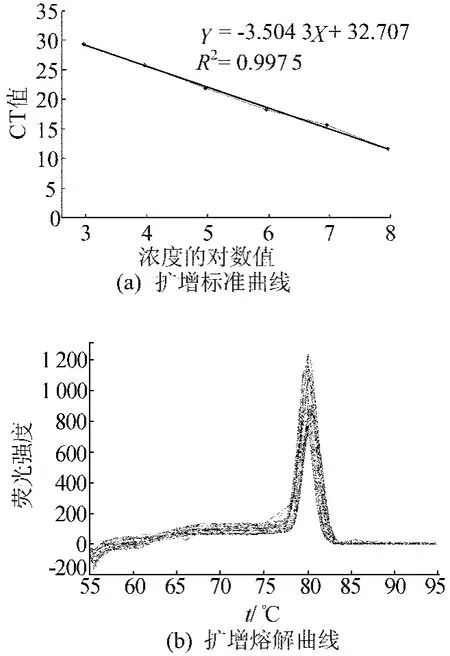
图6 家蚕ATR基因扩增标准曲线和熔解曲线
家蚕ATR基因发育变化如图7所示。
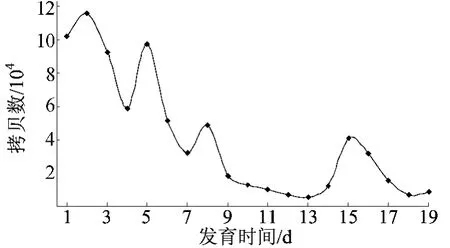
图7 家蚕Br-SG中ATR基因mRNA发育变化
从图7可以看出,5龄幼虫、预蛹期、蛹期和成虫4个阶段中,5龄幼虫表达量最高,其次为蛹后期,蛹前期和成虫阶段表达量最低。5龄幼虫第2天表达量最高,5龄1~5d持续维持较高的表达水平,化蛹后持续下降,蛹后期表达量重新升高,化蛾时急剧降低。幼虫期ATR表达量水平较高,可能是该阶段家蚕ATR与AT结合,促进分泌保幼激素(JH),从而维持幼虫的正常发育[1]。
化蛹后表达量下降,此时变态发育占主导角色,幼虫体态的维持被打破,与ATR表达量较低是相适应的。蛹后期表达量重新升高,可能与AT在这个时期促进成虫肌蛋白的合成有关。化蛾后表达量下降,与这个时期家蚕各神经肽表达量均较低的情况相吻合[15]。
3 结 论
本研究利用RT-PCR方法克隆了家蚕促咽侧体素受体(Bommo-ATR)全长基因序列,并运用实时荧光定量PCR技术对家蚕5龄期至化蛾共19d的ATR表达量进行分析,主要结果有:
(1)家蚕ATR基因全长ORF序列为1 254bp,编码416个氨基酸。预测的氨基酸序列的二级结构为7次跨膜蛋白,符合GPCR家族成员的典型特征。
(2)家蚕脑-咽下神经节复合体(Br-SG)中ATR五龄1~5d持续维持较高的表达水平,化蛹后持续下降,蛹后期表达量重新升高,化蛾时急剧降低。
[1] Li S,Ouyang Y C,Ostrowski E,et al.Allatotropin regulation of juvenile hormone synthesis by the corpora allata from the lubber grasshopper,Romaleamicroptera[J].Peptides,2005,26(1):63-72.
[2] Horodyski F M,Verlinden H,Filkin N,et al.Isolation and functional characterization of an allatotropin receptor fromManducasexta[J].Insect Biochemistry and Molecular Biology,2011,41(5):804-814
[3] Fan Y,Sun P,Wang Y,et al.The G protein-coupled receptors in the silkworm,Bombyxmori[J].Insect Biochemistry and Molecular Biology,2010,40(8):581-591.
[4] Hull J J,Ohnishi A,Moto K,et al.Cloning and characterization of the pheromone biosynthesis activating neuropeptide receptor from the silkmoth,Bombyxmori:significance of the carboxyl terminus in receptor internalization[J].J Biol Chem,2004,279(49):51500-51507.
[5] Kiefer F,Arnold K,Bordoli L,et al.The SWISS-MODEL Repository and associated resources[J].Nucleic Acids Research,2009,37:387-392.
[6] Abrol R,Kim S K,Bray J K,et al.Characterizing and predicting the functional and conformational diversity of seven-transmembrane proteins [J].Methods,2011,55(4):405-414.
[7] Pierce K L,Premont R T,Lefkowitz R J,et al.Seven-transmembrane receptors[J].Molecular Cell Biology,2002,3(9):639-650.
[8] Yamanaka N,Yamamoto S,Zitnan D,et al.Neuropeptide receptor transcriptome reveals unidentified neuroendocrine pathways[J].PLoS ONE,2008,3(8):e3048
[9] Nouzova M,Brockhoff A,Mayoral J G,et al.Functional characterization of an allatotropin receptor expressed in the corpora allata of mosquitoes [J].Peptides,2011,34:201-208.
[10] Hauser F,Neupert S,Williamson M,et al.Genomics and peptidomics of neuropeptides and protein hormones present in the parasitic waspNasoniavitripennis[J].J Proteome Res,2010,9(10):5296-5310.
[11] Vuerinckx K,Verlinden H,Lindemans M,et al.Characterization of an allatotropin-like peptide receptor in the red flour beetle,Triboliumcastaneum[J].Insect Biochem Mol Biol,2011,41(10):815-822.
[12] 袁 锋.昆虫分类学[M].北京:中国农业出版社,2006:43-372.
[13] Collin C,Hauser F,Hansen K K,et al.Identification of the drosophila and tribolium receptors for the recently discovered insect RYamide neuropeptides[J].Biochem Biophys Res Commun,2011,412(4):578-583.
[14] Cheng Y,Luo L,Jiang X,et al.Expression of pheromone biosynthesis activating neuropeptide and its receptor(PBANR)mRNA in adult femaleSpodopteraexigua(Lepidoptera:Noctuidae)[J].Arch Insect Biochem Physiol,2010,75(1):13-27.
[15] 于 淼.家蚕PTTH基因转录调控及相关神经肽的发育表达[D].合肥:合肥工业大学,2010.

