高光效水稻品种对氧化胁迫的响应
朱宏芳, 韩 宇, 孟卫卫, 王荣富, 靳光远, 曹树青
(1.合肥工业大学 生 物与食品工程学院,安徽 合 肥230009;2.安徽农业大学 生 物技术中心,安徽 合 肥 230036)
0 引 言
水稻是全球重要的粮食作物,环境中的氧化胁迫所造成的活性氧代谢紊乱对细胞的毒害使得全球水稻在产量、品质上的下降及其经济损失是惊人的。如何有效地清除过多的活性氧,调节活性氧的产生与清除平衡,最大限度地降低活性氧的毒害作用,已成为当今植物抗性机理研究的一个热点[1-3]。
本文以镇江农科所选育优质品种镇稻11号为对照,研究本实验室特有高光效水稻品种杨育粳1号在甲基紫精胁迫下的响应,试图阐明水稻对氧化胁迫的响应调节机理。本研究不仅有助于揭示植物对活性氧的解毒机理,而且可以获得抗氧化胁迫高产水稻品种[4-5],为水稻高光效生理育种提供理论依据和技术途径。
1 材料与方法
1.1 实验材料及培养
实验材料为杨育粳1号(高光效水稻)和镇稻11号(由江苏镇江农科所提供)。
采用土培法,营养土配方为:V(蛭石)∶V(黑土)∶V(珍珠岩)=9∶3∶0.5。播种于装有营养土的花盆中,置于光周期为光照16h、黑暗8h,温度为26~30℃、光照强度为800μmol/(m2·s)的条件下培养。
1.2 主要仪器
GN1152型电子天平由上海民桥精密科学仪器有限公司生产;752型紫外可见分光光度计由上海光谱仪器有限公司生产;台式高速冷冻离心机由美国贝克曼库尔特有限公司生产;BCD-186SY海尔可变温冰箱由青岛海尔集团有限公司生产。
1.3 试剂
Revert AidTM First Strand cDNA Synthesis Kit K1621购于Fermentas公司;TakaRa Taq Polymerase(5U/μL),10×PCR buffer,dNTPs,PCR引物;其余均为国产试剂,分析纯。
1.4 实验方法
本实验设0、1、5、20μmol/L 4个浓度的甲基紫精溶液,分别处理实验组和对照组,然后统计表型指标株高和鲜重;测定生化指标叶绿素质量比、丙二醛含量;分析氧化胁迫相关基因的表达。
1.4.1 甲基紫精处理下植株表型统计
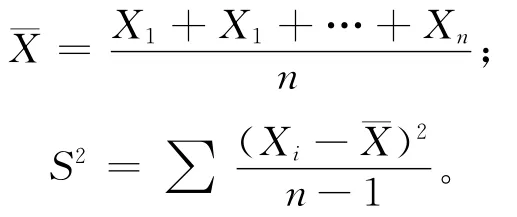
其中,Xi为植株主干高度;S2为根长方差。鲜重统计方法类似株高。
1.4.2 叶绿素质量比的测定
w(叶绿素a)=13.95A665-6.88A649;
w(叶绿素b)=24.96A649-7.32A665,
w(叶绿素a、b)=6.63A665-18.08A649。
1.4.3 丙二醛含量的测定
测定每g样品鲜重中的丙二醛(MDA)的量(μmol),公式为:
MDA含量 = [6.452(A532-A600)-0.559A450]VtVs/Fw。
其中,Vt为提取液总体积;Vs为测定用提取液体积;Fw为样品鲜重。
1.5 相关基因表达分析
Trizol法抽提水稻总RNA,合成全基因组cDNA,设计引物,RT-PCR扩增目标基因,琼脂糖凝胶电泳检测相关基因,分析电泳图谱。
2 结果与分析
2.1 氧化胁迫对水稻幼苗的表型影响
甲基紫精是触灭杀生性除草剂百草枯的主要成分[6],具有强氧化性。不同处理下水稻的表型比较如图1所示,由图1可知,2种水稻材料的生长均受到氧化剂甲基紫精抑制,抑制作用随甲基紫精浓度升高呈梯度增强。不同处理下幼苗株高和鲜重的比较如图2所示。

图1 不同处理下水稻的表型比较
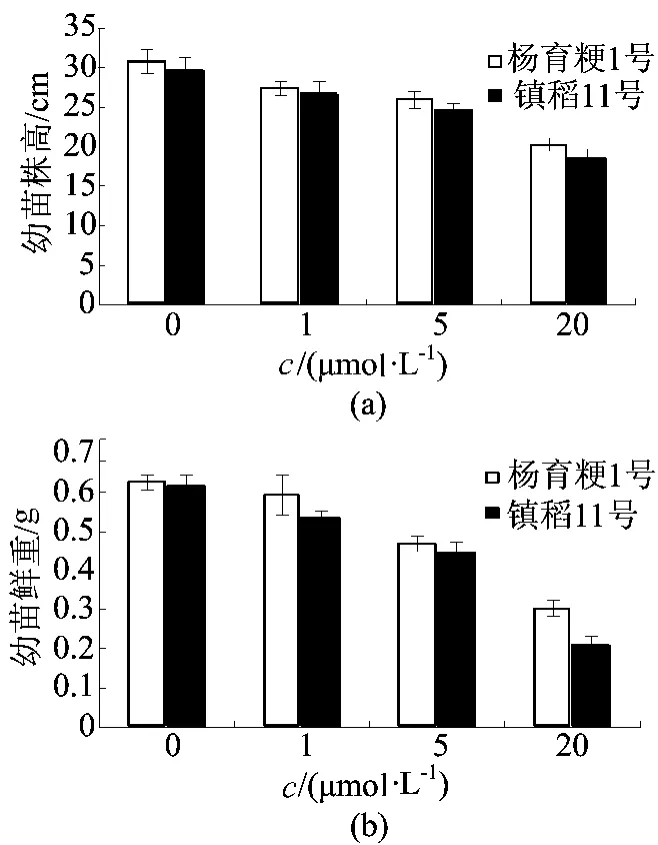
图2 不同处理下幼苗株高和鲜重比较
由图2可以得出,镇稻11号所受抑制作用要比杨育粳1号更为明显。结果表明,经甲基紫精处理的水稻幼苗,由于氧化剂所造成的氧化胁迫,使得植株体内正常的活性氧代谢系统失衡,水稻幼苗积累了过多的活性氧(ROS),结果造成细胞损伤[7],并且杨育粳1号对氧化胁迫的耐受性强于镇稻11号。
不同处理下丙二醛含量比较如图3所示,由图3可知,植株中MDA含量随甲基紫精浓度升高而递增,并且相对光合速率较低的镇稻11号植株体内的丙二醛含量显著升高。在甲基紫精溶液浓度为0、1、5、20μmol/L的条件下,与镇稻11号相比,杨育粳1号的丙二醛含量分别减少了0.13%、8.13%、13.57%、22.94%。表明高光效水稻杨育粳1号对氧化胁迫具有较强的耐受性。
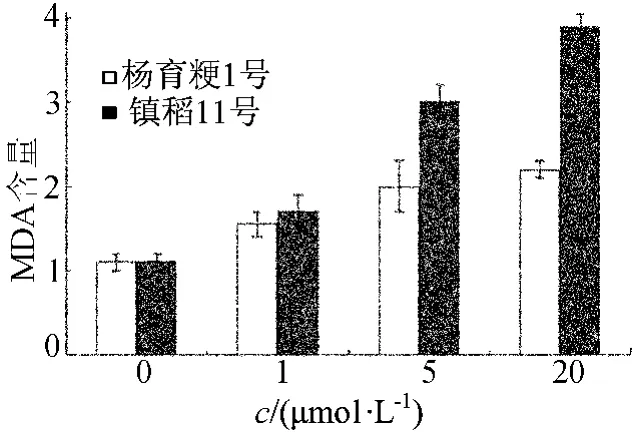
图3 不同处理下丙二醛含量比较
2.2 甲基紫精对水稻叶绿素质量比的影响
不同处理下叶绿素的质量比如图4所示。
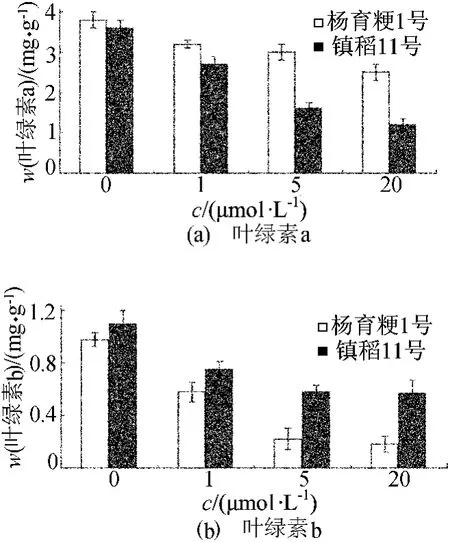
图4 不同处理下叶绿素质量比的比较
从图4可以看出,甲基紫精会使得叶绿素a和叶绿素b的质量比减少,使得其光合速率降低,生产力降低,进而会影响水稻的产量。而且,甲基紫精对镇稻11号的抑制作用比杨育粳1号要强得多。在甲基紫精溶液为0、1、5、20μmol/L的条件下,叶绿素a的质量比在杨育粳1号中分别是镇稻11号的1.05、1.20、1.78、2.01倍;叶绿素b的质量比是镇稻11号的1.11、1.34、2.33、2.89倍。由此可见,高光效水稻杨育粳1号对氧化胁迫的耐受性较高。
2.3 植株幼苗中氧化胁迫相关基因的表达
活性氧解毒酶是活性氧解毒系统中具有高效专一性解毒作用的一类蛋白质。主要包括超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)等[8]。SOD的活性升高或降低,表现为植株对环境抗性的强弱。可以通过植物体内SOD活性水平判断其抗逆性及受胁迫的程度。同样,若能够使APX、CAT酶活性显著升高,则可使超氧阴离子自由基(O2-)产生的速率显著下降,脂质过氧化作用极大地减弱。分别选择SOD、APX及CAT家族的SODA1、APX2及CATB做相关基因分析,如图5所示,图5中,1为杨育粳1号,2为镇稻11号。
由图5可看出,三者mRNA表达量均随甲基紫精浓度递增呈梯度增加。且同一诱导浓度下SODA1的mRNA在杨育粳1号中的增加量明显高于对照中的;5μmol/L甲基紫精诱导下杨育粳1号中APX2的mRNA表达量也高于镇稻11号,CATB则差异不大。由此可见在甲基紫精梯度诱导下,2个品种中的SOD、APX、CAT活性不断增强,并且高光效水稻中SOD的活性较对照呈现明显的特异性增强,APX次之。据此推断杨育粳1号的高光效与其体内活性氧解毒酶的活性增强,清除体内氧自由基及过氧化氢能力增加,对氧化胁迫耐受性提高有关。
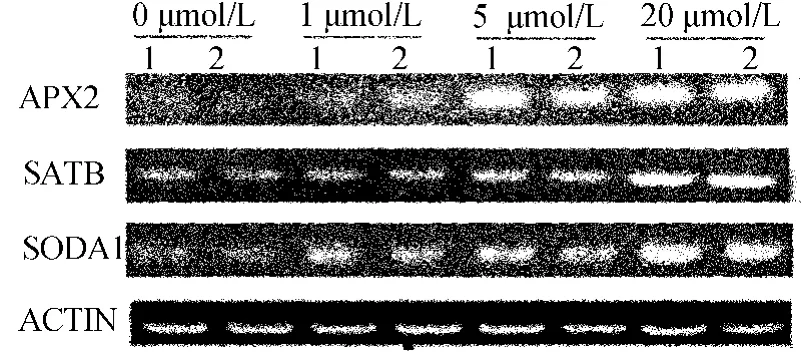
图5 相关基因表达分析
3 结 论
在浓度为20μmol/L甲基紫精下,杨育粳1号的表型特征与生化指标明显优于镇稻11号,并且凝胶成像分析表明,前者氧化胁迫相关基因SODA1、APX2的表达量明显高于后者,说明其高光合效率与编码自身活性氧平衡系统中抗氧化酶的基因活性增加有关。
[1] Inze D,Montagu M V.Oxidative stress in plants curr opin[J].Plant Biotech,1995,6:153-158.
[2] Blokina O,Virolainen E,Fagerstedt K V.Antioxidants,oxidative damage and oxygen deprivation stress:a review[J].Anna Bot,2003,91:179-194.
[3] Dat J,Vandenabeele S,Vranova E,et al.Dual action of the active oxygen species during plant stress responses[J].Cell Mol Life Sci,2000,57:779-795.
[4] Winicov I.New molecular approaches to improving salt tolerance in crop plants[J].Anna Bot,1988,82:703-710.
[5] 梁丽君,刘福田,朱思成,等.紫精自由基缔合行为的ESR研究[J].山东师范大学学报:自然科学版,1997,12(4):460-462.
[6] Mittler R.Oxidative stress antioxidants and stress tolerance trends[J].Plant Sci,2002(7):405-410.
[7] Catolluceio C,Paganga G,Melikian N.Antioxidant potential of intermediates in phenylpropanoid metabolism in higher plants[J].FEBS Lefft,1995,368:188-192.
[8] Hsieh T H,Lee J T,Yang P T,et al.Heterology expression of the arabidopsis C-repeat/dehydration response element binding factor 1gene confers elevated tolerance to chilling and oxidative stresses in transgenic tomato[J].Plant Physiol,2002,129:1086-1094.

