经皮胃镜下胃造瘘术在颅脑损伤后昏迷伴吞咽困难患者中的早期应用研究
桑 林,郑 重,周 峰,解 飞,葛留锁,马延山
神经外科收治的颅脑损伤昏迷患者中大多伴有吞咽困难,造成了患者住院期间营养状态逐渐恶化,因此,需要一种安全、有效且可以长期应用的肠内营养方式来解决这一问题。目前,有报道认为经皮胃镜下胃造瘘术 (percutaneous endoscopic gastrostomy,PEG)以其安全、有效、操作简便及价格低廉的优势已经取代胃造瘘术,逐渐成为肠内营养的常用方法[1-3],与传统的经鼻胃管 (nasogastric tube,NGT)肠内喂养方式相比,究其优越性,目前还缺乏大量病例资料的系统性研究[4]。
1 资料与方法
1.1 病例纳入标准 入选标准:(1)颅脑损伤后的昏迷患者,伴有吞咽困难;(2)患者一般状态尚可,生命体征较平稳,可以耐受麻醉以及手术; (3)有胃肠道功能存在,可以耐受肠内营养。排除标准: (1)咽、食管、贲门狭窄无法胃镜检查者;(2)食管胃底静脉曲张可能引起出血者; (3)有凝血功能障碍、胃出血、肝硬化、腹腔积液、腹膜炎、胃大部切除术史者; (4)腹壁肥胖者,影响穿刺及有幽门或肠梗阻、器官变异者;(5)一般状态差,无法耐受麻醉以及手术者。
1.2 一般资料 根据病例纳入标准选取2008年10月—2011年11月我院收治的进行PEG或NGT治疗的重型颅脑损伤后昏迷伴吞咽困难患者60例,患者昏迷情况根据格拉斯哥评分 (GCS)并结合临床。其中PEG组30例,男20例,女10例,年龄 19~78岁,平均 (51.3±13.5) 岁,GCS为 4~8分,平均 (6.8±1.3) 分;NGT组30例,男19例,女11例,年龄21~80岁,平均 (49.0±14.3) 岁,GCS为 4~8分,平均 (7.0±1.2)分。两组患者的年龄、性别、昏迷程度间具有均衡性。
1.3 方法
1.3.1 PEG肠内营养 使用纽迪西亚公司生产的CH18经皮胃镜下胃造瘘管。静脉辅助麻醉成功后,选择腹壁穿刺点并消毒铺巾。患者仰卧位进镜,在胃体前壁近胃底侧无血管区经皮穿刺成功后导入双股导线,用圈套器将导线接出体外,造瘘管与导线连接后放置胃造瘘管并固定,必要时经胃造瘘管置入空肠喂养管至空肠上端。术后12~24 h即可经造瘘管进食,先给予温开水100~200 ml,观察有无反流及渗漏,2~3 d逐渐增加肠内营养的质和量,进食中和进食后30 min均采取半卧位,防止反流误吸。进食前后均用0.9%氯化钠溶液30~50 ml冲管,防止堵塞。
表1 两组患者营养指标比较 ()Table 1 Comparison of nutritive indexes between PEG group and NGT group
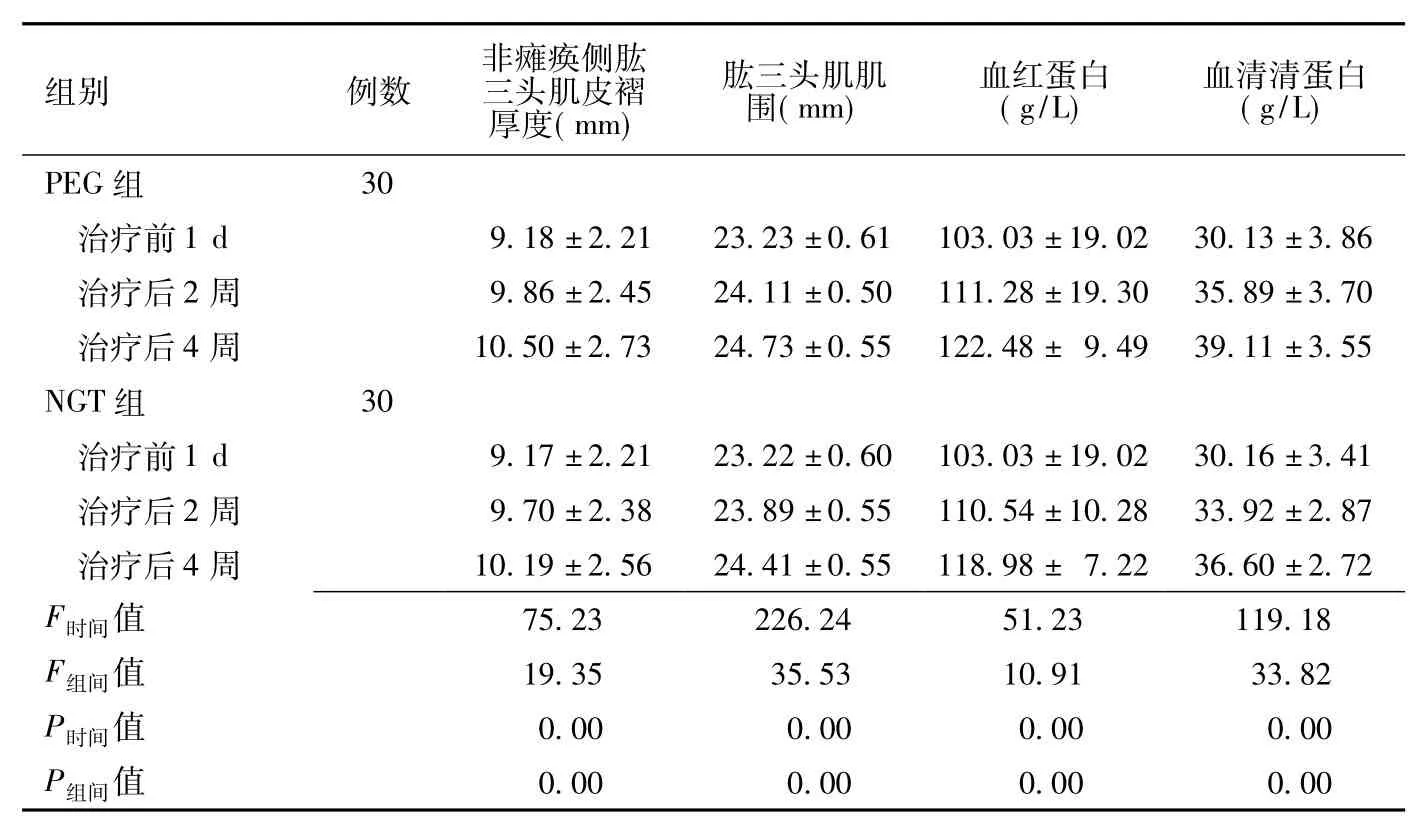
表1 两组患者营养指标比较 ()Table 1 Comparison of nutritive indexes between PEG group and NGT group
组别 例数非瘫痪侧肱三头肌皮褶厚度(mm)肱三头肌肌围(mm)血红蛋白(g/L)血清清蛋白(g/L)30治疗前 1 d 9.18 ±2.21 23.23 ±0.61 103.03 ±19.02 30.13 ±3.86治疗后 2 周 9.86 ±2.45 24.11 ±0.50 111.28 ±19.30 35.89 ±3.70治疗后 4 周 10.50 ±2.73 24.73 ±0.55 122.48 ± 9.49 39.11 ±3.55 NGT组 30治疗前 1 d 9.17 ±2.21 23.22 ±0.60 103.03 ±19.02 30.16 ±3.41治疗后 2 周 9.70 ±2.38 23.89 ±0.55 110.54 ±10.28 33.92 ±2.87治疗后 4 周 10.19 ±2.56 24.41 ±0.55 118.98 ± 7.22 36.60 ±2.72 PEG组F时间75.23 226.24 51.23 119.18 F组间值 19.35 35.53 10.91 33.82 P时间值 0.00 0.00 0.00 0.00值P组间值0.00 0.00 0.00 0.00
1.3.2 NGT肠内营养 使用纽迪西亚公司生产的CH/FR 15鼻胃管。患者去枕后仰,用石蜡油润滑胃管前段,左手持纱布托住胃管,右手持镊子夹住胃管前段,沿一侧鼻孔缓慢插入到咽喉部 (14~16 cm),将患者头部托起,使下颌靠近胸骨柄,缓慢将胃管向前推进,直至预定长度,初步固定胃管,确定胃管在胃内。下鼻胃管后12~24 h即可经鼻胃管进食,先给予温开水100~200 ml,观察有无反流,2~3 d逐渐增加肠内营养的质和量,进食中和进食后30 min均采取半卧位,防止反流误吸。进食前后均用0.9%氯化钠溶液30~50 ml冲管,防止堵塞。
1.4 观察指标 两组给予相同的管饲营养液,于治疗前1 d、治疗后2周、治疗后4周分别测量非瘫痪侧肱三头肌皮褶厚度 (游标卡尺测定)、肱三头肌肌围 (塑料卷尺测量),血红蛋白和血清清蛋白结果根据实验室检查标准记录。统计两组治疗前后消化道出血、肺部感染、反流性食管炎和低蛋白血症的发生情况。
1.5 统计学方法 采用 SPSS 13.0软件进行统计分析,计量资料以 ()表示,采用重复测量方差分析,两两比较采用q检验,计数资料比较采用 χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组营养指标改善情况 两组患者营养指标比较,差异均有统计学意义 (P<0.01),不同时间间比较,差异亦有统计学意义 (P<0.01,见表1)。
2.2 两组并发症发生情况 两组治疗前消化道出血、肺部感染、反流性食管炎及低蛋白血症的发生率比较,差异均无统计学意义 (P>0.05);治疗4周后,PEG组患者消化道出血、肺部感染、反流性食管炎的发生率与NGT组比较,差异均有统计学意义 (P<0.01),两组低蛋白血症的发生率比较,差异无统计学意义 (P>0.05,见表2)。
3 讨论
颅脑损伤后昏迷患者不能正常经口进食,继之出现进行性体质量下降,营养缺乏会严重阻碍患者疾病预后及使死亡率增加,因此肠内营养支持显得尤为重要。NGT作为传统的肠内营养途径一直被沿用至今。PEG是由Gauderer等在1980年首先开展起来的,这是一项简单、安全、患者耐受性良好的操作,且适用的食谱和营养制剂范围广。经过30多年的不断改进,此项技术越来越成熟,很快在全球领域开展起来,成为当今中长期肠内营养方法[5-7]。但PEG与 NGT肠内喂养方式的优越性长期以来一直存在争议。
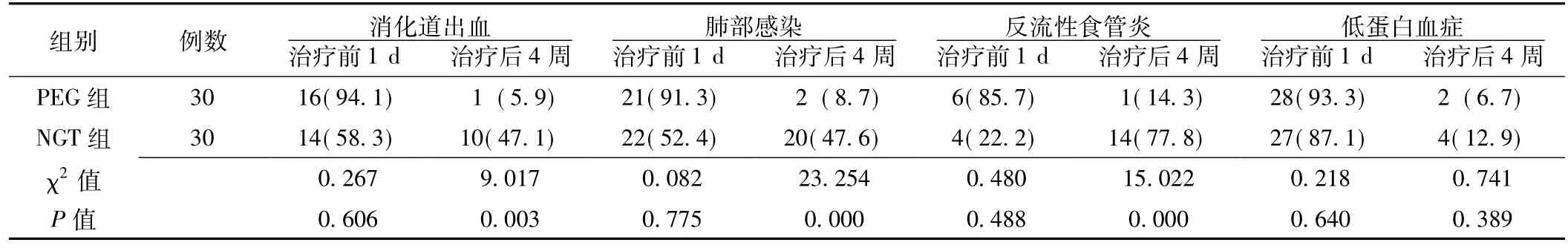
表2 PEG组与NGT组患者并发症发生情况比较〔n(%)〕Table 2 Comparison of complications between PEG group and NGT group
NGT应用中存在鼻胃管容易移出或阻塞,影响患者营养的吸收以及长期使用可出现诸如鼻翼损伤、慢性鼻窦炎、胃食管反流和吸入性肺炎等一系列并发症。目前很多研究显示PEG无论是在儿童还是成 人 患 者 使 用 中 均 具 有 优 越 性[4,8-9],PEG可以有效改善患者的营养状况。本研究结果显示PEG组在治疗后2周和4周的4项营养指标均优于NGT组,因此也支持这点。而且相对于 NGT,早期PEG肠内喂养不但可以及时纠正患者营养不良状态,还可以有效降低患者诸多并发症的发生率,尤其是吸入性肺炎的发生率。本研究结果显示PEG组患者在治疗4周后消化道出血、肺部感染、反流性食管炎的发生率均低于NGT组。但是有报道显示行PEG治疗时容易引起插管口感染、上消化道出血、急性腹膜炎、支气管哮喘及坏死性筋膜炎等并发症[10]。因此,PEG的安全性还有待进一步大量临床资料系统性地研究分析。
本研究结果发现,与传统的NGT相比,有如下优点: (1)有利于患者营养状态的改善,促进病情恢复; (2)减少胃食管反流、食管炎的发生,减少吸入性肺炎的发生; (3)避免胃管对鼻咽部的刺激,避免鼻胃管长期压迫磨擦引起的糜烂和不适;(4)长期管饲者更易管理和耐受; (5)可以卷曲于腹壁,保持患者的外表尊严和正常参加某些活动; (6)便于护理,方便给药; (7)一般鼻饲管极易老化阻塞,要求每周更换,而胃造瘘管可以长期留置应用; (8)术中可以明确胃部情况,指导治疗。颅脑损伤的患者经常出现应激性胃溃疡,甚至发生出血、穿孔,术中可以根据胃镜所见胃壁情况决定术后是否采取鼻饲或减压以及进一步治疗。
虽然PEG不断被认可,应用越来越广泛,每年有将近20万患者需PEG,然而PEG作为一种侵袭性治疗,有其局限性,如果适应证掌握不好,会为治疗带来隐患[10-11]。一般情况下,PEG适用于有胃肠道功能障碍伴吞咽困难或其他原因导致经口营养障碍者,而且没有经内窥镜入胃的禁忌。PEG的绝对禁忌证包括大量腹腔积液、严重腹腔感染、幽门梗阻及有限预期寿命;相对禁忌证有存在腹腔积液、病态肥胖症、胃次全切除术等[3]。针对PEG的适应证及禁忌证在采取PEG治疗前应严格选择,保证其治疗的安全性。
综上所述,PEG操作安全、快捷、简便易行,避免了许多鼻胃管或手术造口的并发症,且易于长期护理。同时对于颅脑损伤后昏迷伴吞咽困难的患者早期行PEG可以很好地、及时地解决营养支持的问题,对于改善病程的进展、提高患者的生活质量、减轻家庭和社会的负担都有广阔的前景,从而为颅脑损伤后昏迷伴吞咽困难患者早期营养支持寻找到一种安全、有效的治疗途径。
1 Dennis MS,Lewis SC,Warlow C,et al.Effect of timing and method of enteral tube feeding for dysphagic stroke patients(FOOD):a multicentre randomised controlled trial[J].Lancet,2005,365(9461):764-772.
2 Vagenas K,Karamanakos N,Katsakoulis E,et al.Percutaneous endoscopic gastrostomy.The clinical experience in the University Hospital of Patras[J].Arch Hellen Med,2008,25(3):356-362.
3 Rosés LL,Ortiz EC.Percutaneous endoscopic gastrostomy[J].Interventional and Therapeutic Gastrointestinal Endoscopy,2010,27:198-208.
4 Hamidon BB,Abdullah SA,Zawawi MF,et al.A prospective comparison of percutaneous endoscopic gastrostomy and nasogastric tube feeding in patients with acute dysphagic stroke [J].Med J Malaysia,2006,61(1):59-66.
5 Ponsky JL,Gaudere MW.Percutaneous endoscopic gastrostomy:a nonoperative technique for feeding gastrostomy[J].Gastrointest Endosc,1981,27(1):9-11.
6 Loeser C,von Herz U,Küchler T,et al.Quality of life and nutritional state in patients on home enteral tube feeding [J].Nutrition,2003,19(7/8):605-611.
7 Löser C,Aschl G,Hébuterne X,et al.ESPEN guidelines on artificial enteral nutrition—percutaneous endoscopic gastrostomy(PEG)[J].Clin Nutr,2005,24(5):848-861.
8 Thomson M,Rao P,Rawat D,et al.Percutaneous endoscopic gastrostomy and gastro-oesophageal reflux in neurologically impaired children[J].World J Gastroenterol,2011,17(2):191-196.
9 Nugent B,Lewis S,O'Sullivan JM.Enteral feeding methods for nutritional management in patients with head and neck cancers being treated with radiotherapy and/or chemotherapy[J].Cochrane Database Syst Rev,2010,17(3):CD007904.
10 Roche V.Percutaneous endoscopic gastrostomy.Clinical care of PEG tubes in older adults[J].Geriatrics,2003,58(11):28-29.
11 Potack JZ,Chokhavatia S.Complications of and controversies associated with percutaneous endoscopic gastrostomy:report of a case and literature review [J].Medscape J Med,2008,10(6):142.

