脑超慢涨落图技术检测急性脑梗死患者脑内神经递质变化特点研究
陶永苍,贾磊华,臧贺川,胡艳雪,刘香玲,杨 丽,丁和正
近年来许多研究表明,脑梗死时脑内多种神经递质包括代谢紊乱。其中研究较多的是氨基酸类神经递质包括兴奋性氨基酸谷氨酸 (Glu)、抑制性神经递质γ-氨基丁酸 (GABA),单胺类神经递质包括多巴胺 (DA)、去甲肾上腺素 (NE)、5-羟色胺 (5-HT)及乙酰胆碱 (ACh)等。脑梗死时上述神经递质的代谢紊乱在缺血性脑损伤中发挥重要作用[1-3]。目前由于研究方法的限制,研究多停留在动物实验、脑梗死患者的血液及脑脊液中,因此,对于脑梗死患者脑内神经递质的活动情况知之甚少。脑超慢涨落图技术 (encephalofluctuography technology)可以分析出隐藏在传统脑波涨落过程中的频率极低的优势超慢波,称之为S系统 (supra-slow system),几种神经递质的振荡过程与优势超慢波中的某些谱线相对应[4]。本研究采用此技术检测急性脑梗死患者不同发病时期、不同病情、不同梗死范围及不同梗死部位的脑内神经递质活动情况,现报道如下。
1 资料与方法
1.1 病例入选与排除标准 入选标准: (1)符合1995年中华医学会第四届全国脑血管病学术会议制定的诊断标准;(2)发病在24 h内;(3)经24 h后复查颅脑CT或MRI证实梗死灶为此次临床症状和体征的责任病灶。排除标准:(1)既往有脑血管病事件或影像学发现颅内陈旧脑血管病病灶; (2)患其他神经系统疾病,如遗传变性病、脑肿瘤、脑炎、脱髓鞘、帕金森病、头外伤、脑萎缩、癫痫等; (3)既往有认知功能障碍、精神疾病病史;(4)患严重的心、肝、肾及血液系统等重要脏器疾病。
1.2 一般资料 选择2010年7月—2011年11月河北省唐山市乐亭县医院神经内科收治的初发急性脑梗死患者53例为病例组,其中男31例,女22例,年龄41~86岁,平均 (62.0±11.3)岁;分组情况:根据病程将发病24 h内定为急性脑梗死患者的发病早期,经治疗2周后为恢复期;根据美国国立卫生研究院脑卒中量表 (NIHSS)评分分组:NIHSS评分≥7分组18例,NIHSS评分<7分组35例;按颅脑CT或MRI结果分组:梗死范围≥2 cm×2 cm×2 cm组15例,梗死范围<2 cm×2 cm×2 cm组38例;幕上梗死40例 (包括基底核梗死20例,非基底核梗死20例),幕下梗死13例。选择同期健康体检者30例为对照组,其中男15例,女15例,年龄43~78岁,平均 (57.5±9.9)岁;且近期颅脑CT或MRI检查证实无缺血、梗死病灶者。两组年龄、性别比较具有均衡性。
1.3 方法
1.3.1 仪器设备 采用北京同仁光电公司研发的ML—2001型脑涨落图分析仪。
1.3.2 脑电信号采集及处理 受检者均在坐位、清醒、闭目、安静状态下,按10/20系统安置电极 (FP1、FP2、F3、F4、C3、C4、P3、P4、O1、O2、F7、F8、T3、T4、T5、T6),采集脑电信号18 min。采集结束后,脑超慢涨落图程序自动分析处理和打印结果。病例组受检者分别于发病24 h内及治疗2周后各进行1次检测。对照组受检者只检测1次。
1.3.3 观察指标 受检者脑功能检测报告中S谱线 (系)结果,包括S1(GABA)、S2(Glu)、S3系〔乙酰胆碱受体(AChR)〕、S4系 (5-HT)、S5系 (ACh)、S6系〔强兴奋物质 (EXC)〕、S7系 (NE)、S11系 (DA)、S13系〔强抑制物质 (INH)〕。
1.4 统计学方法 所有数据采用Excel建库,使用SPSS 16.0软件进行统计分析;计量资料以 ()表示,两组间比较采用t检验,多组比较采用方差分析,两两比较采用q检验;以P<0.05为差异有统计学意义。
2 结果
2.1 病例组患者发病早期、恢复期及对照组的S谱值比较病例组患者发病早期GABA、Glu、EXC活动与恢复期及对照组比较,差异均有统计学意义 (P<0.05);病例组发病早期其他神经递质活动与恢复期及对照组比较,差异均无统计学意义 (P>0.05);恢复期各神经递质活动与对照组比较,差异均无统计学意义 (P>0.05,见表1)。
表1 急性脑梗死患者发病早期、恢复期及对照组S谱值比较 ()Table 1 Comparison of the results of supra-slow system of cerebral infarction patients in early stage,recovery stage and control group
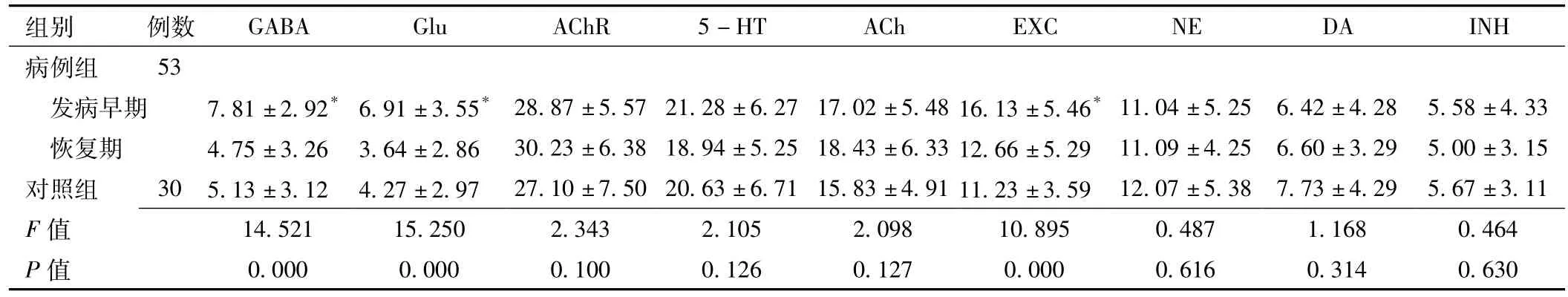
表1 急性脑梗死患者发病早期、恢复期及对照组S谱值比较 ()Table 1 Comparison of the results of supra-slow system of cerebral infarction patients in early stage,recovery stage and control group
注:GABA=γ-氨基丁酸,Glu=谷氨酸,AChR=乙酰胆碱受体,5-HT=5-羟色胺,ACh=乙酰胆碱,EXC=强兴奋物质,NE=去甲肾上腺素,DA=多巴胺,INH=强抑制物质;与恢复期及对照组比较,*P<0.05
组别 例数GABA Glu AChR 5-HT ACh EXC NE DA INH病例组53发病早期 7.81±2.92*6.91±3.55* 28.87±5.57 21.28±6.27 17.02±5.48 16.13±5.46*11.04±5.25 6.42±4.28 5.58±4.33恢复期 4.75±3.26 3.64±2.86 30.23±6.38 18.94±5.25 18.43±6.33 12.66±5.29 11.09±4.25 6.60±3.29 5.00±3.15对照组 30 5.13±3.12 4.27±2.97 27.10±7.50 20.63±6.71 15.83±4.91 11.23±3.59 12.07±5.38 7.73±4.29 5.67±3.11 F 值14.521 15.250 2.343 2.105 2.098 10.895 0.487 1 4 0.630.168 0.464 P值 0.000 0.000 0.100 0.126 0.127 0.000 0.616 0.31
2.2 急性脑梗死患者发病早期不同NIHSS评分组的S谱值比较 急性脑梗死患者发病早期,NIHSS评分≥7分组 Glu、EXC、INH活动与<7分组比较,差异均有统计学意义 (P<0.05);两组其他神经递质活动比较,差异均无统计学意义(P>0.05,见表2)。
2.3 急性脑梗死患者发病早期不同梗死范围组的S谱值比较梗死范围≥2 cm×2 cm×2 cm组中 Glu、ACh、EXC、NE、DA、INH活动与<2 cm×2 cm×2 cm组比较,差异均有统计学意义 (P<0.05);两组其他神经递质活动比较,差异均无统计学意义 (P>0.05,见表3)。
2.4 急性脑梗死患者发病早期不同梗死部位组与对照组的S谱值比较 急性脑梗死患者发病早期幕上组中 GABA、Glu、EXC活动与对照组比较,差异均有统计学意义 (P<0.05),幕上基底核组DA与对照组比较,差异有统计学意义 (P<0.05);幕下组GABA、Glu、5-HT、EXC、NE活动与对照组比较,差异均有统计学意义 (P<0.05);幕上、幕下组其他神经递质活动与对照组比较,差异均无统计学意义 (P>0.05,见表4)。
表2 急性脑梗死患者发病早期不同NIHSS评分组S谱值比较 ()Table 2 Comparison of the results of supra-slow system between groups with different NIHSS scores

表2 急性脑梗死患者发病早期不同NIHSS评分组S谱值比较 ()Table 2 Comparison of the results of supra-slow system between groups with different NIHSS scores
NIHSS评分 例数GABA Glu AChR 5-HT ACh EXC NE DA INH≥7分组 18 8.78 ±2.39 8.33 ±2.93 29.50±4.55 22.28±5.87 18.61±5.32 19.44±4.67 10.56±4.54 7.67 ±5.09 3.61±3.29<7分组 35 7.31 ±3.07 6.29 ±3.32 28.54±6.07 20.77±6.49 16.20±5.45 14.43±5.09 11.29±5.62 6.51 ±4.18 6.40 ±4.61 t 83 -2.280 P值 0.083 0.032 0.559 0.413 0.130 0.001 0.636 0.3值1.765 2.208 0.589 0.825 1.538 3.492 -0.476 0.8 81 0.027
表3 急性脑梗死患者发病早期不同梗死 (梗死)范围组S谱值比较 ()Table 3 Comparison of the results of supra-slow system between groups with different infarction sizes
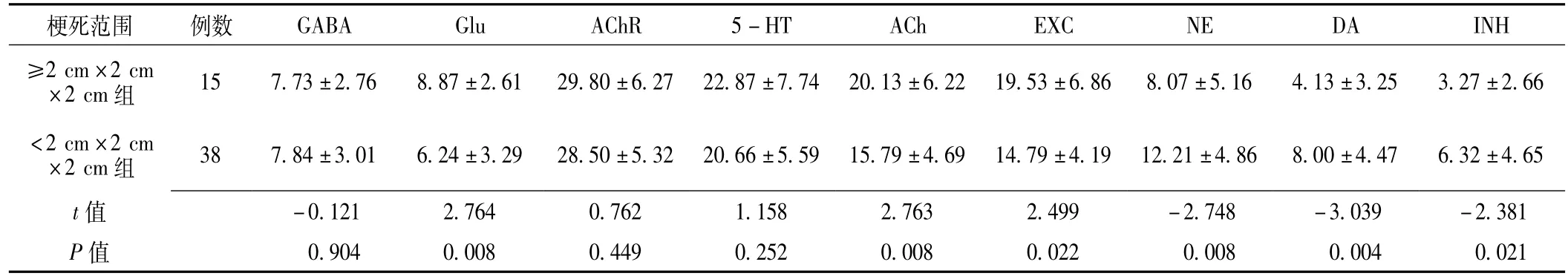
表3 急性脑梗死患者发病早期不同梗死 (梗死)范围组S谱值比较 ()Table 3 Comparison of the results of supra-slow system between groups with different infarction sizes
梗死范围 例数GABA Glu AChR 5-HT ACh EXC NE DA INH≥2 cm×2 cm×2 cm组 15 7.73±2.76 8.87±2.61 29.80±6.27 22.87±7.74 20.13±6.22 19.53±6.86 8.07±5.16 4.13±3.253.27±2.66<2 cm×2 cm×2 cm组 38 7.84±3.01 6.24±3.29 28.50±5.32 20.66±5.59 15.79±4.69 14.79±4.19 12.21±4.86 8.00±4.47 6.32±4.65 t .039 -2.381 P值 0.904 0.008 0.449 0.252 0.008 0.022 0.008 0值-0.121 2.764 0.762 1.158 2.763 2.499 -2.748 -3.004 0.021
表4 急性脑梗死患者发病早期不同梗死 (梗死)部位组与对照组S谱值 ()Table 4 Comparison of the results of supra-slow system between groups with different infarction locations
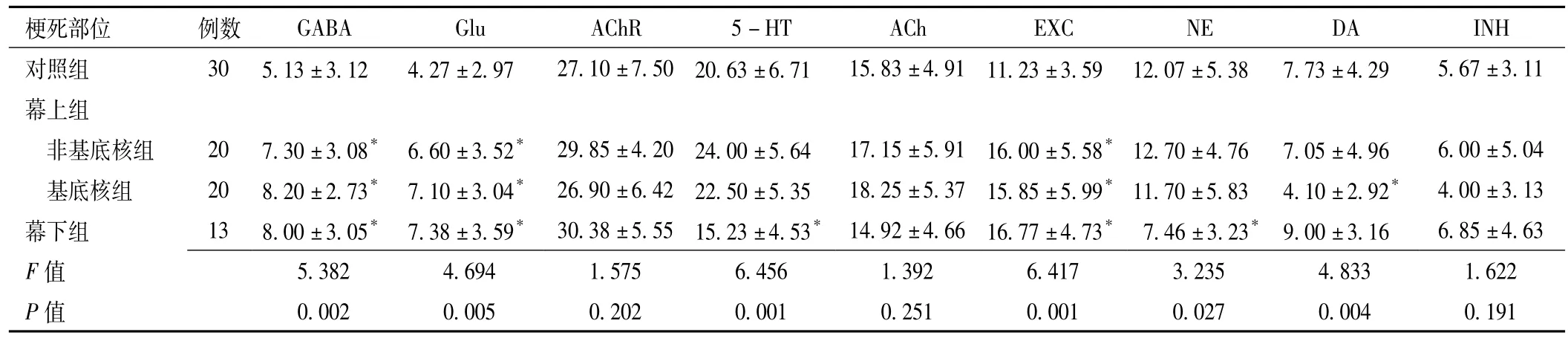
表4 急性脑梗死患者发病早期不同梗死 (梗死)部位组与对照组S谱值 ()Table 4 Comparison of the results of supra-slow system between groups with different infarction locations
注:与对照组比较,*P<0.05
梗死部位 例数GABA Glu AChR 5-HT ACh EXC NE DA INH对照组 30 5.13±3.12 4.27±2.97 27.10±7.50 20.63±6.71 15.83±4.91 11.23±3.59 12.07±5.38 7.73±4.295.67±3.11幕上组非基底核组 20 7.30±3.08* 6.60±3.52* 29.85±4.20 24.00±5.64 17.15±5.91 16.00±5.58*12.70±4.76 7.05±4.96 6.00±5.04基底核组 20 8.20±2.73* 7.10±3.04* 26.90±6.42 22.50±5.35 18.25±5.37 15.85±5.99*11.70±5.83 4.10±2.92* 4.00±3.13幕下组 13 8.00±3.05* 7.38±3.59* 30.38±5.55 15.23±4.53* 14.92±4.66 16.77±4.73* 7.46±3.23* 9.00±3.16 6.85±4.63 F 3 1.622 P值 0.002 0.005 0.202 0.001 0.251 0.001 0.027 0.00值5.382 4.694 1.575 6.456 1.392 6.417 3.235 4.83 4 0.191
3 讨论
脑超慢涨落图技术可以分离出隐藏在原始脑波中的超慢涨落信息,包括1~255条谱线,分别称为 S1、S2、S3……S255,属于mHz级超慢振荡范围。S谱线的涨落与脑内神经化学活动有密切的联系。现已破译出以下几种神经化学物质的密码:S1反映GABA、S2反映Glu、S3系反映AchR、S4系反映5-HT、S5系反映ACh、S6系反映EXC、S7系反映NE、S11系反映DA、S13系反映INH[4]。脑超慢涨落图技术为本研究提供了在完全自然和绝对无创的条件下获得急性脑梗死患者脑内神经递质活动信息的新方法。
本研究发现急性脑梗死发病早期,脑内神经递质活动情况复杂多样,其中GABA、Glu、EXC活动增强,在大面积梗死组中ACh活动增强;大面积梗死组中INH、幕上基底核组中DA及幕下组中5-HT、NE活动减弱。生理状态下,脑内神经递质活动受神经递质的合成、释放、降解、再摄取过程及神经结构 (包括神经元、神经纤维、突触结构完整性)的影响,其中任何一环节的破坏都可能影响到神经递质的活动。发病早期,多种神经递质活动增强可能与以下3个方面有关: (1)脑组织缺血、缺氧,神经元能量代谢障碍,离子泵功能紊乱,细胞内外离子梯度失衡,均可导致神经元自动去极化,引起神经末梢中神经递质的自发释放;也可以导致细胞水肿,细胞膜完整性破坏引起神经递质的泄露[5]。(2)脑缺血时还可能抑制神经递质的再摄取及相关酶的降解过程。有研究表明脑组织缺血、缺氧时,胶质细胞膜上的Glu转运体功能障碍,不仅能抑制Glu由细胞外转入细胞内,还能逆转Glu由细胞内转入细胞外[6]。脑梗死时,梗死灶中心及周围生化的改变可能影响酶的活性,使主要依赖于相关酶水解而灭活的神经递质在细胞外中的降解过程减弱。(3)正常情况下神经递质对神经元的兴奋和抑制作用处于协调统一状态,脑梗死发病早期,机体为了维持神经元的兴奋与抑制平衡,可能通过反射引起某些神经递质的活动增强。以上3个方面均有可能导致突触间隙中神经递质的浓度增加,并向周围组织扩散,与其受体饱和、作用时间延长致使神经递质功能活动增强。其中某些神经递质活动减弱,可能主要为缺血性脑损伤对其神经结构破坏严重,如神经元的破坏使神经递质的合成减少,神经纤维的破坏影响神经冲动的传导致使神经递质释放减少,突触结构的破坏使神经递质与突触后受体功能性的结合障碍,这些因素都有可能使神经递质活动减弱。
脑梗死时神经递质的活动情况受发病时期、病情程度、梗死范围及梗死部位影响。本研究结果显示,发病早期变化最明显的为GABA、Glu、EXC,此3种神经递质活动均增强,恢复期时活动恢复至正常。考虑此3种神经递质在大脑内分布广泛,含量丰富,易受到缺血性脑损伤的影响。在脑组织缺血模型中有研究者检测到皮质、下丘脑、海马等多部位的细胞外液中Glu、GABA水平升高[7-9],支持本研究结果中发病早期GABA、Glu活动增强。其中EXC为何种物质并不明确,还有待进一步研究。急性脑梗死发病早期,此3种物质活动变化灵敏,同时增强,对于临床早期脑梗死的诊断可能具有重要意义。本研究中Glu、EXC、INH的活动变化与病情程度有关。病情越重Glu、EXC活动越强,INH活动减弱,表明脑梗死病情重者,大脑的兴奋、抑制功能失调,大脑处于强兴奋状态,抑制功能反而减弱。有研究者利用微透析技术检测到左侧大面积脑梗死患者右侧半球细胞外液中Glu水平随着病情加重持续升高[10]。另一研究者发现脑梗死患者脑脊液中Glu浓度的升高与脑梗死病情及梗死面积显著相关[11]。本研究利用脑超慢涨落图技术不仅观察到脑梗死病情越重,Glu活动越强,同时观察到EXC活动也明显增强,而INH活动受到抑制,3者的变化在临床中对于了解脑梗死时大脑的兴奋抑制状态从而判断病情变化可能有一定的价值。本研究中 Glu、EXC、INH、ACh、NE、DA的活动与脑梗死范围的大小有关。大范围脑梗死时,患者病情重,大脑兴奋、抑制失衡,Glu、EXC活动增强,INH活动减弱。同时大范围脑梗死影响到ACh、NE、DA的活动,表现为ACh活动增强,NE、DA活动减弱,这可能与3者神经元胞体的数量、分布和神经纤维的走行、投射部位及密度有关。大面积脑梗死时可能对NE、DA神经结构的破坏相对较重,表现为活动减弱,而对ACh神经结构破坏相对较轻,受缺血性脑损伤的影响表现为活动增强。上述Glu、EXC、INH、ACh、NE、DA活动的变化可能对于临床中脑梗死范围大小的判断具有指导意义。本研究还发现DA、5-HT、NE与脑梗死的特定部位有关。基底核脑梗死时,DA活动降低,可能主要破坏DA的突触结构,影响DA与突触后受体的结合和作用。幕下脑梗死时,5-HT、NE活动减弱。这两种神经元主要位于脑干,分布较聚集、数量较少。有研究者发现脑缺血时中缝背核神经元内5-HT减少[12]。本研究中幕下脑梗死时对5-HT、NE神经结构的破坏性大或对其功能抑制严重,导致神经递质活动减弱。由此可知单胺类神经递质的活动对于判断脑梗死的特定部位有一定参考意义。
综上所述,利用脑超慢涨落图技术观察到急性脑梗死患者脑内神经递质受缺血性脑损伤的影响活动情况复杂多样。其中Glu、GABA、EXC在脑梗死发病早期活动变化均明显增强。病情越重Glu、EXC的活动越强,INH活动减弱。梗死范围越大Glu、EXC的活动越强,INH活动减弱,同时ACh活动增强,NE、DA活动减弱。单胺类神经递质中DA在基底核组中活动减弱,5-HT、NE在幕下组中活动减弱。观察上述神经递质的变化对于了解脑梗死的发病阶段、病情严重程度、梗死灶范围的大小及梗死灶的部位具有一定的临床意义。
1 赵刚,李树清.兴奋性氨基酸毒性与缺血性脑损伤[J].国外医学:脑血管疾病分册,2004,12(6):426-429.
2 徐冉,段淑荣,王慧慧,等.人脑梗死后转化生长因子-β及血管内皮生长因子的表达及神经保护作用研究[J].中国全科医学,2010,13(8):2560.
3 Schetinger MR,Bonan CD,Frassetto SS,et al.Pre-conditioning to global cerebral ischemia changes hippocampal acetylcholinesterase in the rat[J].Biochem Mol Biol Int,1999,47(3):473 -478.
4 李军艳,杨明会,赵冠英,等.应用脑电超慢涨落图技术对帕金森病患者脑内神经递质变化的研究 [J].疑难病杂志,2009,8(1):3.
5 Phillis JW,O'Regan MH.Characterization of modes of release of amino acids in the ischemic/reperfused rat cerebral cortex[J].Neurochem Int,2003,43(4/5):461 -467.
6 Chao XD,Fei F,Fei Z.The role of excitatory amino acid transporters in cerebral ischemia [J].Neurochem Res,2010,35(8):1224 -1230.
7 Lee GJ,Choi SK,Eo YH,et al.The effect of extracellular glutamate release on repetitive transient ischemic injury in global ischemia model[J].Korean J Physicol Pharmacol,2009,13(1):23 -26.
8 Li H,Li C,Yan ZY,et al.Simultaneous monitoring multiple neurotransmitters and neuromodulators during cerebral ischemia/reperfusion in rats by microdialysis and capillary electrophoresis[J].J Neurosci Methods,2010,189(2):162 -168.
9 Djali S,Dawson LA.Characterization of endogenous amino acid efflux from hippocampal slices during chemically-induced ischemia[J].Neurochem Res,2001,26(2):135-143.
10 Berger C,Annecke A,Aschoff A,et al.Neurochemical monitoring of fatal middle cerebral artery infarction [J].Stroke,1999,30(2):460-463.
11 于岚,武祺,关颖,等.急性脑梗死患者脑脊液兴奋性氨基酸水平的变化及其临床意义 [J].临床神经病学杂志,2005,18(5):373-374.
12 吴春云,郭泽云,李素华,等.脑缺血时中缝背核5-HT变化的免疫组化观察 [J].解剖学杂志,2000,23(3):238-241.

