聚氨酯泡沫表面Fe-Cr合金共沉积
王德庆,孙柳霞
(大连交通大学 材料科学与工程学院,辽宁 大连 116028)
0 引言
Fe-Cr合金具有高硬度、高熔点、强耐腐蚀性、有光泽等优点,已被广泛应用于各个领域.Fe-Cr合金中随着Cr含量的增加,镀层的防锈性也增强,在金属材料表面沉积一层含铬合金能提高材料的耐腐蚀性,从而降低不锈钢的用量,节约铬资源[1].
Fe-Cr共沉积应符合以下两个条件[2]:①至少应有一种金属元素能单独从水溶液中沉积出来,Fe、Cr均符合这个条件;②共沉积金属元素的析出电位要十分接近或相等.对于Fe和Cr而言,它们的标准电极电势差较大,分别为-0.447 V和-0.71 V.实验证明,从三价铬和亚铬而言,铁的简单盐混合溶液中得到合格的铁铬合金镀层是不可能的[3].为了实现合金的共沉积可以通过改变金属离子的浓度、加入添加剂、加入络合剂等方法.在镀液中加入合适的络合剂,使金属离子的析出电位相互接近而实现共沉积,是非常有效的方法.它不但使金属离子的平衡电位向负方向移动,还能增大阴极极化[2].
电沉积铁铬合金的镀液主要有甲酸盐体系、甲酸盐—乙酸盐体系和甘氨酸体系等,这方面的研究已经有很多报道[4-6].本文采用甘氨酸体系,利用化学镀、电沉积工艺在聚氨酯泡沫表面得到Fe-Cr合金镀层,采用正交试验研究镀液成分及工艺参数(温度、pH、电流密度)对镀层厚度、沉积速率以及铬含量的影响,确定了聚氨酯表面电沉积Fe-Cr合金的最佳工艺,从而为聚氨酯表面Ni-Fe-Cr共沉积制备多孔耐热合金的制备工艺打下基础.
1 实验步骤
本实验中采用的聚氨酯泡沫孔径为10 PPI(每英寸孔数),比表面积为3.92 cm-1.将聚氨酯泡沫切割成2 cm×2 cm×0.5 cm的试样经清洗和干燥后进行预处理、化学镀Ni和电沉积Fe-Cr合金.
聚氨酯试样预处理的步骤包括:清洗、除油、粗化、中和、敏化和活化,所用溶液及条件如表1所示.为了防止前一道工序的残留物污染下一道工序的溶液,各工序间都要用去离子水冲洗试样.

表1 聚氨酯泡沫化学镀预处理配方及条件
按表2所述配方配制化学镀液,用恒温水浴锅(北京市永光明医疗仪器厂)加热镀液至85℃时,用PHB-3型便携式pH将溶液的pH调节至4.5,将活化后的试样经去离子水冲洗后浸入化学镀液中镀1 h.试样经化学镀后,从镀液中取出,用去离子水清洗并干燥.
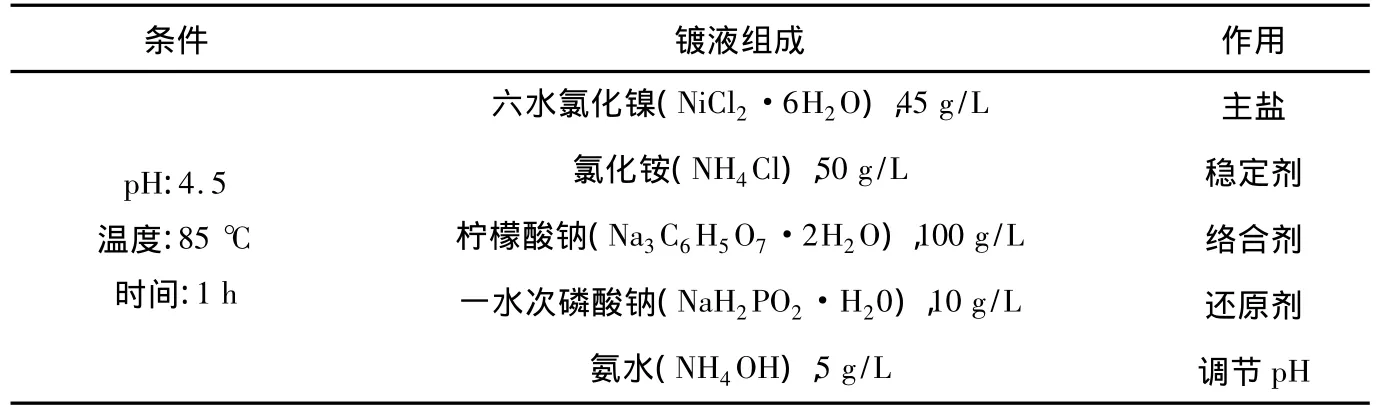
表2 化学镀液配方及条件
按表3配制电沉积镍溶液,将电镀槽放入恒温水浴锅中,通过控制恒温水浴锅温度调节电镀液温度,当电镀槽中的镀液温度达到60℃时,分别用10%氨水和盐酸水溶液调节电镀液的pH为4.2,然后将固定在阴极挂钩的经化学镀镍试样和阳极镍板(2 cm×5 cm)浸入电镀液中,使用WYK-505直流稳压稳流电源(东方集团易事特公司)控制电流,电沉积镍30 min后,取出试样后进行清洗、干燥,然后称重(m1).
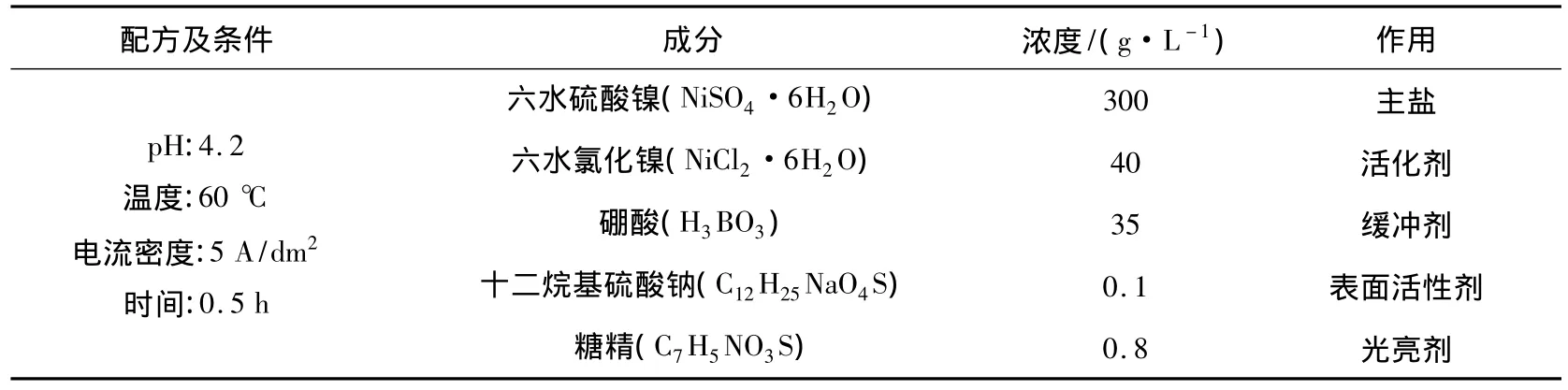
表3 电镀镍溶液配方及条件

表4 电镀铁-铬溶液配方及条件
按表4配制Fe-Cr共沉积溶液,先将电镀槽放入恒温水浴锅中,通过调节恒温水浴锅温度控制电镀液温度,当镀液达到相应温度时,分别用10%氨水和盐水溶液调节电镀液的pH值,当达到给定值后,将固定在阴极挂钩的经电沉积镍试样和阳极镍板(2 cm×5 cm)浸入电镀液中,电极间距为3 cm,在一定的电流密度下电镀30 min,接通电源调节电流,Fe-Cr共沉积开始.共沉积结束后,将试样取出,干燥并称重(m2).

表5 正交设计所用因素及水平
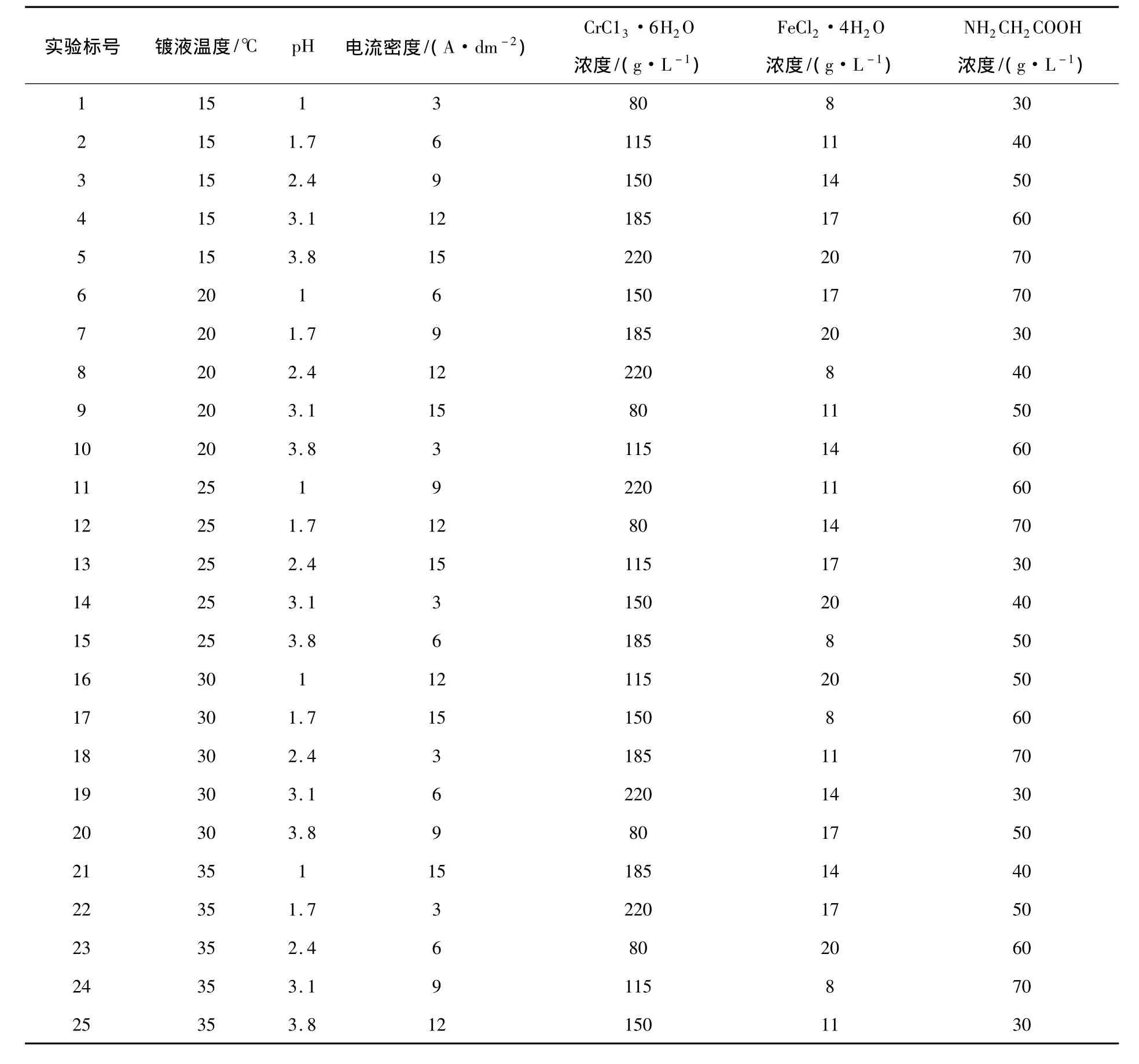
表6 正交设计方案
如表5所示,本实验中考查的变量和水平较多,为了减少实验次数,且得到准确的结果,在不考虑各因素的交互作用的前提下,采用正交设计实验方法.通过L25(56)正交实验设计,结果如表6所示,考查了聚氨酯泡沫表面Fe-Cr共沉积过程中各因素对镀层厚度、沉积速率以及Cr含量的影响.
将电镀后的试样用环氧树脂镶嵌,待室温放置24 h完全固化后,用砂纸打磨试样(砂纸粒度由粗到细依次为 240、400、600、800、1000 和1200号),用粒度为3.5和1 μm的抛光膏进行抛光,然后用清水冲洗试样.用XJF-02A型金相显微镜观察镀层横截面形貌,用Sigmascan Pro软件测量镀层厚度,用JSM-6360LV型扫描电镜(SEM)对试样的镀层质量(镀层表面平滑度和缺陷)进行观察.用能量散射分光仪(EDS)确定镀层中Fe和Cr含量.采用增重称量法测试沉积速率,根据电沉积前后的质量变化,计算公式为
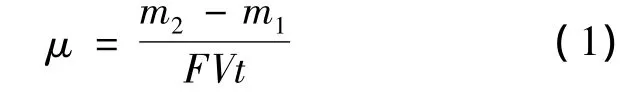
式中,μ为沉积速率(%);m2为Ni-Cr共沉积后质量(mg);m1为电沉积镍后质量(mg);F为试样比表面积(cm2/cm3);V为试样体积(cm3);t为施镀时间(h).
2 结果与讨论
2.1 聚氨酯泡沫表面形貌
图1分别为聚氨酯泡沫表面预处理后、化学镀后、电沉积Ni后、电沉积Fe-Cr后的形貌,可以看到经过不同处理的聚氨酯泡沫保持了原泡沫基体的结构形貌.预处理后聚氨酯泡沫表面附着了一层活性物质,主要成分是金属钯微粒.化学镀是在具有催化活性的表面上,利用还原反应,在泡沫表面沉积金属层.本研究采用次亚磷酸钠为还原剂,反应为:
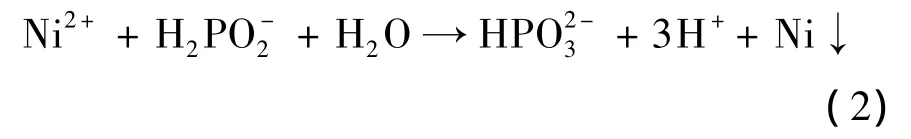
生成的Ni沉积于泡沫表面,由于Ni本身对该反应具有催化作用,所以化学镀可以持续进行,直到达到一定厚度的均匀镀层,颜色为灰白,用肉眼观察可发现化学镀镀层较薄且不均匀.电沉积Ni后,镀层表面较为光亮,致密,无脱落和起皮现象.因此,为了获得更好的Fe-Cr合金镀层,在化学镀之后进行了电沉积Ni.电沉积Fe-Cr后,通过肉眼观察发现,铁铬镀层表面为均匀平整的镀层,具有亮白色的金属光泽.

图1 聚氨酯试样各阶段形貌
2.2 正交试验分析
2.2.1 镀液成分及工艺参数对Fe-Cr镀层厚度与沉积速率的影响
在不考虑镀液pH、温度、电流密度、CrC13·6H2O浓度、FeCl2·4H2O浓度和NH2CH2COOH浓度这些影响实验的诸多因素的交互作用的情况下,在研究工艺参数对Fe-Cr沉积层的厚度和沉积速率的影响时,利用正交实验考查了上述因素对Fe-Cr共沉积层的厚度和沉积速率的影响,按表6进行了实验.为了便于进行分析说明,分别用A、B、C、D、E和F代指镀液的温度、pH、电流密度、CrC13·6H2O浓度、FeCl2·4H2O浓度和NH2CH2COOH浓度.表7为Fe-Cr共沉积层正交试验结果.表8为Fe-Cr共沉积层沉积速率正交试验结果均值与极差,表9为Fe-Cr共沉积层厚度正交试验结果均值与极差.
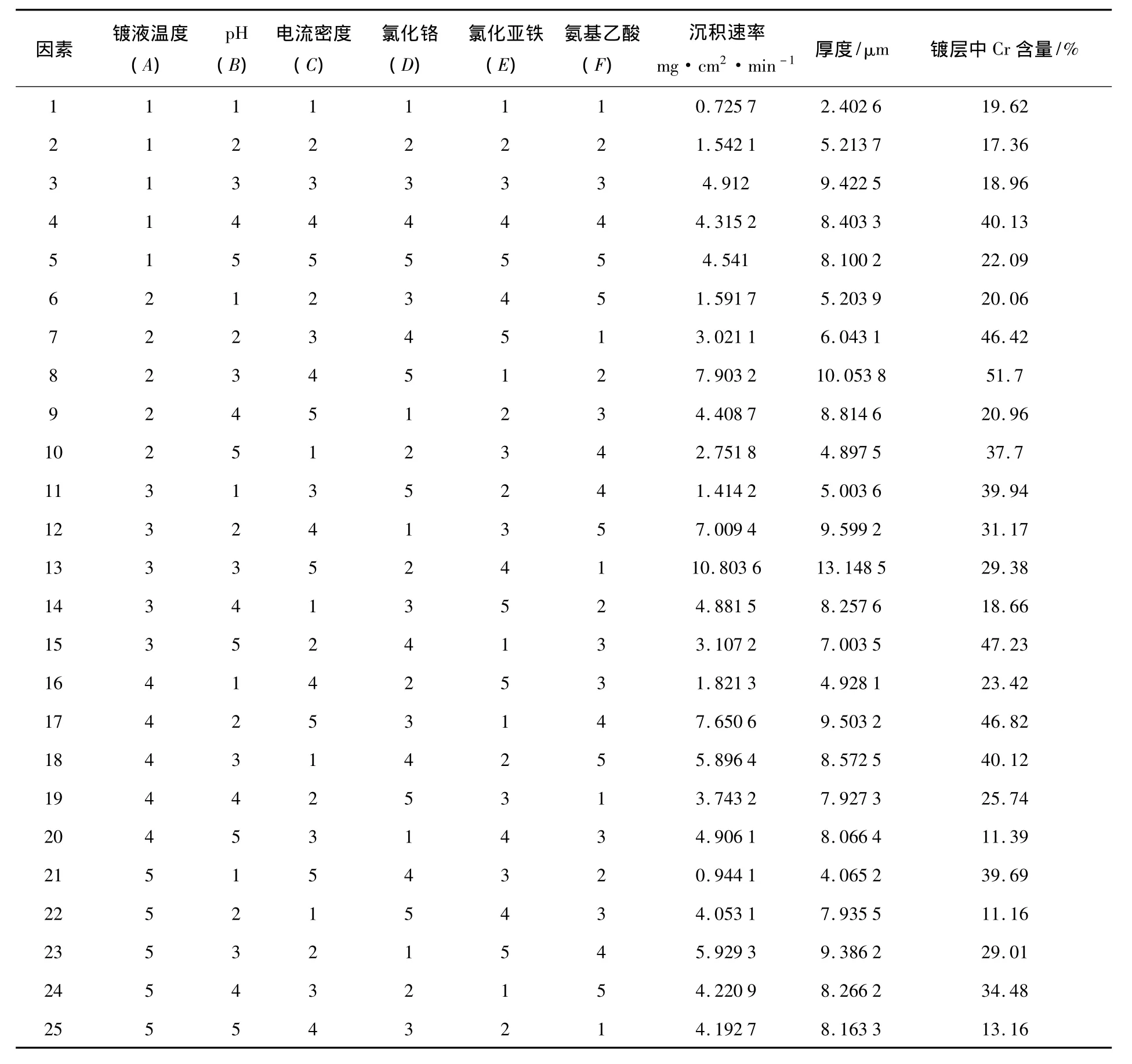
表7 Fe-Cr共沉积层正交试验结果
由表8可以得到,各因素对Fe-Cr共沉积层沉积速率的影响大小为:B>C>A>E>D>F,最佳工艺为:A3B3C5D3E4F5.此结果说明:镀液的pH值对沉积速率的影响最大.在镀液pH值为2.4,电流密度为15 A/dm2,镀液温度为25℃,FeCl2·4H2O 浓度为17 g/L,CrC13·6H2O 浓度为150 g/L,NH2CH2COOH浓度为70 g/L的实验条件下,Fe-Cr共沉积速率最大.
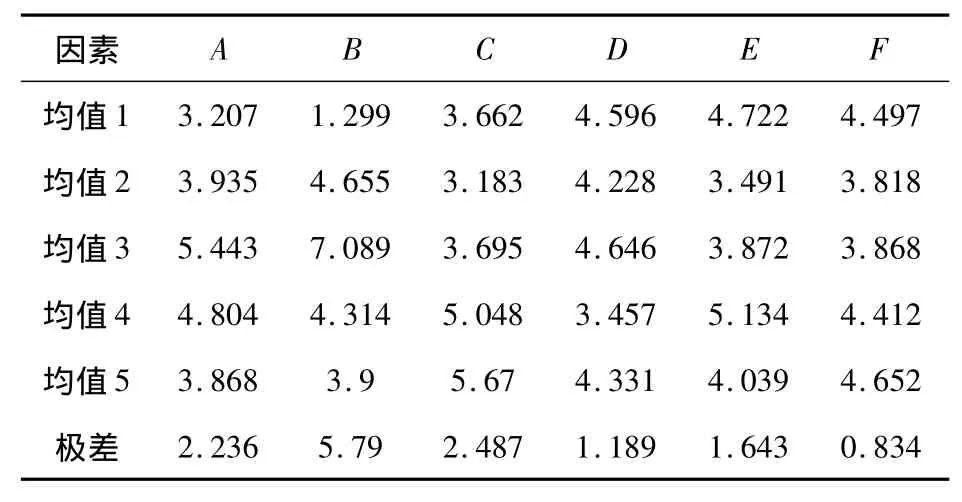
表8 Fe-Cr共沉积层沉积速率正交试验结果均值与极差
由表9可以得到,各因素对Fe-Cr共沉积层厚度的影响大小顺序为:B>C>A>E>D>F,最佳工艺为:A3B3C5D3E4F5.研究表明:在各个影响因素中,pH对Fe-Cr共沉积层厚度的影响最大.当镀液pH值为2.4,电流密度为15 A/dm2,镀液温度为25℃,CrC13·6H2O浓度为 150 g/L,FeCl2·4H2O浓度为17 g/L,NH2CH2COOH浓度为70 g/L时,电沉积30 min后镀层厚度最大.
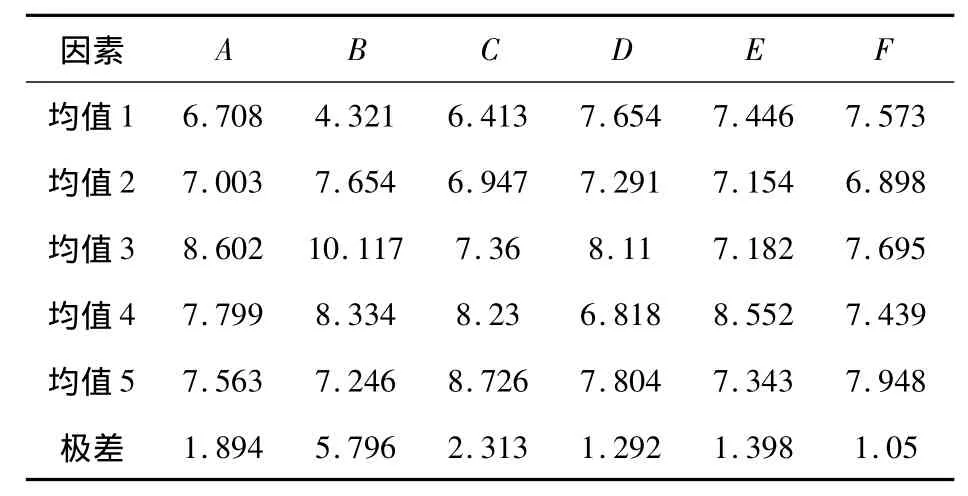
表9 Fe-Cr共沉积层厚度正交试验结果均值与极差
以上研究结果表明,各工艺参数对镀层厚度和沉积速率的影响是基本一致的,即镀液pH的影响最大,电流密度次之.这是因为在不同pH条件下,溶液中Cr3+存在形态不同.在pH较低时,配位体的配位能力差,镀液中的Cr3+主要以稳定的络合离子存在,阻碍了Cr3+的阴极放电;而当pH太高时,Cr3+加速水解,其水解产物形成的化合物吸附在阴极,并有可能形成氢氧化物膜,使铬离子在电极表面的放电阻力增大,镀液变浑浊,严重影响镀层表面质量和镀液的稳定性.有资料表明[7],当 pH < 2.92 时,溶液的三价铬离子以[Cr(H2O)6]3+的形态存在.随pH值升高,羟桥化从无到有,从少到多,至 pH值为4.45时,以[Cr(H2O)5·OH]2+形态存在.因此以氯化铬为主盐的镀液体系中,pH值一般不能超过3.5,否则将大大影响三价铬的电沉积,以致使Cr3+的电沉积变得无法进行.这与本实验的结果是一致的.另外,由于在本实验中加入甘氨酸,在pH为2.4附近有缓冲作用,解离平衡方程为:
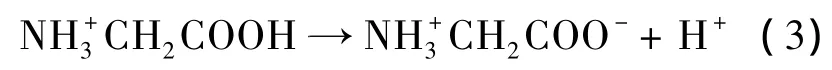
在镀液中由于甘氨酸和硼酸的加入,起到缓冲作用,使电沉积过程中阴极表面附近的pH值能保持在比较稳定的状态.
2.2.2 镀液成分及工艺参数对Fe-Cr镀层Cr含量的影响
在不考虑镀液pH、温度、电流密度、CrC13·6H2O浓度、FeCl2·4H2O浓度和NH2CH2COOH浓度这些影响实验的诸多因素的交互作用的情况下,利用正交实验考查了上述因素对Fe-Cr共沉积层中铬含量的影响,按表6进行了实验.为了便于进行分析说明,分别用A、B、C、D、E和F代指镀液的温度、pH、电流密度、CrC13·6H2O浓度、FeCl2·4H2O浓度和NH2CH2COOH浓度.表10为Fe-Cr共沉积层中Cr含量正交试验结果均值与极差.
由表10可知,各因素对Fe-Cr共沉积镀层中Cr含量的影响大小顺序为:D>E>F>A>B>C,最佳工艺为:A2B3C4D4E1F4.研究表明:在各个影响因素中,CrC13·6H2O浓度对共沉积镀层中Cr含量影响最大,其次为FeCl2·4H2O浓度.当镀液中CrC13·6H2O浓度为185 g/L,FeCl2·4H2O浓度为8 g/L,NH2CH2COOH浓度为60 g/L,镀液温度为20℃,pH值为2.4,电流密度为12 A/dm2时,电沉积30 min后镀层中的Cr含量达到最大.
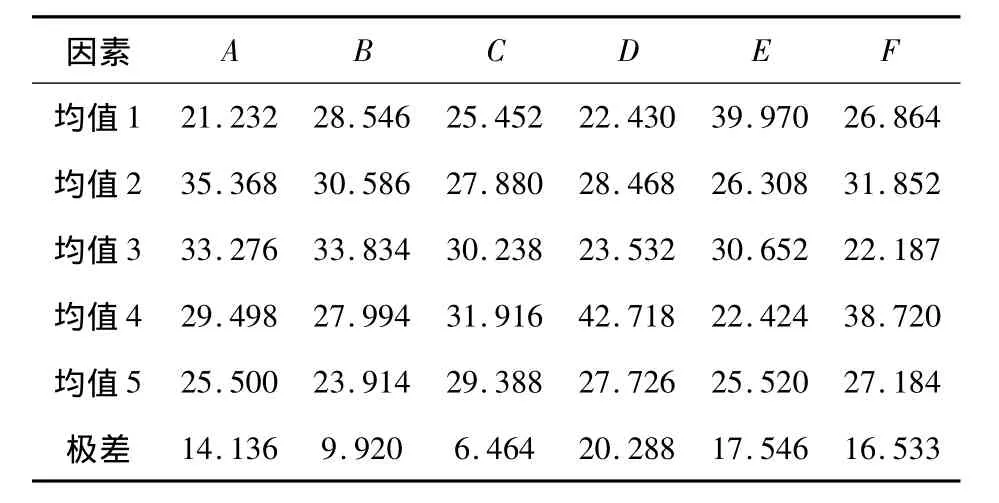
表10 Fe-Cr共沉积层中Cr含量正交试验结果均值与极差
从表10可以看出,Cr含量随着镀液温度的升高先增大后减少.这是因为温度过低,导电盐及主盐析出,附着在阴极表面,反应无法进行且操作不便.升高温度既降低较活泼金属也降低较贵金属在电沉积时的极化作用.温度对阴极—溶液界面上金属浓度的影响,是影响合金电沉积组成的一个重要因素.温度升高,扩散速度将增大,而增大阴极-溶液界面上的金属浓度,将导致较易沉积的金属更加优先沉积.在本镀液体系中铁是较易沉积的金属,温度升高时扩散速度增大,在阴极-溶液界面上的Fe2+浓度增大,使得铁的沉积速度加快,镀层中铁含量上升,铬含量下降.Cr含量随着电流密度升高先增大后减少,这是因为随着电流密度的增大,电镀铬铁合金的电流效率也升高,但是当超过12 A/dm2时,镀层表面发黑.增加阴极电流密度,增大阴极极化,使合金电沉积电位负移较大,从而有助于电位较负的金属铬沉积速率的增加和铬含量的增多.但电流密度过大,则镀层表面变粗糙,容易烧焦[8].
2.3 镀层成分分析
图2为聚氨酯泡沫表面电沉积铁铬镀层的EDS成分谱,结果表明,聚氨酯表面电沉积铁铬镀层中无杂质,纯净度高.
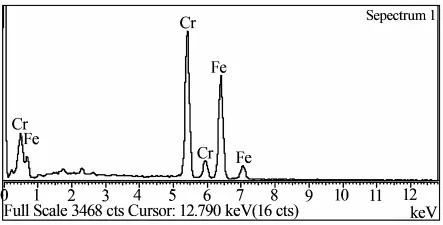
图2 Fe-Cr共沉积镀层表面的EDS成分分析
2.4 优化验证试验
综合考虑镀层厚度、沉积速率和镀层Cr含量的各影响因素,选取温度为20℃,pH为2.4,电流密度为15 A/dm2,镀液中 FeCl2·4H2O浓度为8 g/L,NH2CH2COOH浓度为60 g/L为实验条件,对镀层中Cr含量影响最大的镀液中CrC13·6H2O浓度为变量,进行实验.研究结果如图3所示.
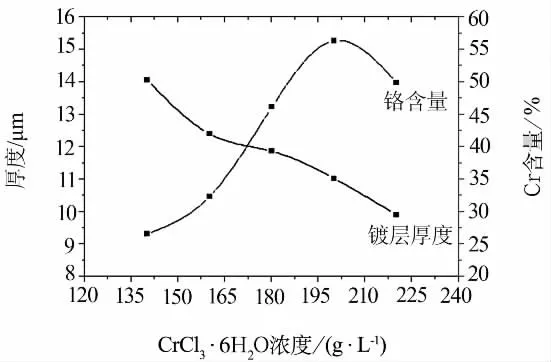
图3 CrCl3·6H2O浓度对镀层厚度和Cr含量的影响
从图3可以看出,镀层厚度随着 CrC13·6H2O浓度的升高而减小,当CrC13·6H2O浓度为140 g/L时,镀层厚度达到最大为14.03 μm,此时镀层中Cr含量为26.42%.镀层中Cr含量随着CrC13·6H2O浓度的升高先增大后降低,当浓度为200 g/L时,镀层中 Cr含量达到最大为56.18%.此时镀层厚度 10.39 μm.
镀液中Cr3+浓度增大,镀层中铬含量也随着增加,Cr3+浓度的改变,Cr3+的沉积电位负移.当镀液中Cr3+浓度增加到一定值时,铬含量开始下降.这是因为在Fe-Cr共沉积过程中,当CrC13·6H2O浓度较小时,不利于Fe-Cr合金的共沉积,镀层中Cr含量很低,得不到光亮的Fe-Cr合金镀层.随着镀液中CrC13·6H2O浓度的增大,镀层中Cr含量增加;但当CrC13·6H2O浓度增大到一定值时,再继续增大其浓度,镀层中Cr含量并无明显增大.这是因为在配位剂含量一定的情况下,Cr3+浓度过大会产生很多游离的 Cr3+,而Cr3+容易发生羟桥基聚合反应[9],生成物附着在阴极表面,阻碍了Cr3+的电沉积.
综上所述,镀液中CrC13·6H2O浓度为140~220 g/L时,可获得 Cr含量为26.42% ~56.18%的Fe-Cr合金镀层.
3 结论
(1)采用预处理、化学镀和电沉积工艺在聚氨酯表面获得了镀层表面平整、光亮、镀层质量高的Fe-Cr合金镀层;
(2)在镀液 pH、温度、电流密度、CrC13·6H2O浓度、FeCl2·4H2O浓度和NH2CH2COOH浓度这些影响实验的诸多影响因素中,pH对Fr-Cr共沉积速率、镀层厚度的影响最大,镀液中的CrC13·6H2O浓度对镀层中Cr含量的影响最大;
(3)在镀液CrC13·6H2O浓度为140~220 g/L、FeCl2·4H2O浓度为8 g/L、NH2CH2COOH浓度为60 g/L、pH为2.4、温度为20℃及电流密度为15 A/dm2的条件下,电镀30 min能够获得表面光亮平整的厚度为9.88 ~14.03 μm 的 Fe-Cr合金镀层,镀层中的Cr含量为26.42% ~56.18%.
[1]MATSUO KAM,KAMMEL R,LARCLAU U.Electrodeposrtron of non-chromrum-nicke alloys[J].Plat.&Surf.Finrsh,1987,74(10):56-60.
[2]屠振密.电镀合金原理与工艺[M].北京:国防工业出版社,1993:199.
[3]吕玮,张永祥.电沉积铁铬合金的研究[J].福建师范大学学报(自然科学版),2002,8(1):51-54.
[4]李惠东,李敏,李惠琪,等.从三价铬镀液中电沉积可替代硬铬镀层的铬合金镀层[J].电化学,1998,4(2):217-222.
[5]成旦红,徐伟一,秦益琴,等.电沉积非晶态铁-铬合金镀层的研究[J].电化学,1997,3(2):202-205.
[6]李东林,刘建平,郭芳洲,等.调制脉冲电流电镀铁铬合金的试验[J].南方冶金学院学报,1996,17(1):1-5.
[7]张新,李惠东,段淑贞,等.三价铬离子在电沉积过程中的形态[J].北京科技大学学报,1995,17(6):582-583.
[8]马正青,黎文献,谭敦强,等.电沉积Fe-Cr合金研究[J].表面技术,2001,3(1):1-2.
[9]郭客,姜效军,徐红波.电镀铬铁合金镀层中铬铁比的影响因素研究[J].材料保护,2008,41(2):29-30.

