人蛋白酶体亚基PSMB1的重组表达、纯化及在蛋白酶体抑制剂体外筛选中的应用
范翠英,冯利兴,张冬梅,潘素娜,刘璇,果德安,樊金玲
1 河南科技大学食品与生物工程系,河南 洛阳 471003
2 中国科学院上海药物研究所,上海 201203
泛素-蛋白酶体通路 (Ubiquitin-proteosome pathway) 是真核细胞中蛋白质降解的重要途径。蛋白酶体 (Proteasomes) 普遍存在于所有真核细胞的细胞核和细胞质中,最常见的蛋白酶体的形式是26S蛋白酶体,由一个20S催化亚基与2个19S调节亚基组成,对肽键的裂解作用是通过20S催化亚基N末端氨基酸残基的亲和反应来完成[1]。拟降解的靶蛋白经过泛素化后,先被19S亚单位识别,随后进入20S催化中心被降解成3~22个氨基酸片段并释放出游离的泛素[2]。
由于蛋白酶体参与降解细胞内多种目标靶蛋白,因此其功能调节可以影响基因转录、细胞周期、信号转导及细胞凋亡等多种生理过程,对基因的转录翻译、细胞的增殖、分化及恶变均有重要影响[3-4]。因此蛋白酶体将成为影响细胞功能的重要药物靶标[5]。例如,寻找能够与20S催化亚基单位共价结合,进而改变其酶切位点活性的蛋白酶体抑制剂已成为近年来恶性肿瘤治疗的研究热点。第一个进入临床的蛋白酶体抑制剂是英国剑桥Millennium Pharmaceuticas公司的二肽硼酸盐类药物硼替佐米(Bortezomib)。这是一种缓慢作用于糜蛋白酶位点的可逆抑制剂。还有2种处于临床前研究的新药,salinosporamide A (NPI-0052,圣地亚哥) 和PR-171 (Proteolix,旧金山)。其中salinosporamide A是口服药物,它不同于硼替佐米,是一种自然提取物,类似于乳胞素,能够不可逆地作用于蛋白酶体的活性亚基,而且其对蛋白酶体催化活性的抑制具有特异性。PR-171是一种合成的能够不可逆地作用于糜蛋白酶位点的抑制剂,来源于环氧霉素,是目前已知的选择性最强的蛋白酶体抑制剂。
重组表达蛋白酶体的活性亚基,可以用于在体外高通量、快速地筛选可能具有蛋白酶体抑制作用的化合物。本研究构建了蛋白酶体20S催化亚基PSMB1 (全长726 bp) 的表达质粒,在原核表达系统中实现PSMB1的可溶性表达,利用固相化金属亲合层析 (Immobilized metal-affinity chromatography,IMAC) 柱对表达产物纯化,获得了纯度较高的重组蛋白。质谱鉴定证实所表达的重组蛋白氨基酸序列完全正确。BIAcore (Biomolecular interaction analysis) 分析表明PSMB1重组蛋白对不同化合物表现出差异的结合能力。本研究为建立以蛋白酶体为分子靶点筛选特异性抑制剂的体外筛选模型提供了纯化的PSMB1重组蛋白。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
大肠杆菌菌株DH5α/BL21 (DE3) 购自北京全式金生物有限公司。表达载体pET28a (+) 由本实验室保存。PSMB1 cDNA购于Thermo公司。
1.1.2 酶和主要试剂
EcoR Ⅰ、Xho Ⅰ限制性内切酶购于北京NEB公司。T4 DNA连接酶、Taq酶、PCR试剂盒均购于 TaKaRa公司。质粒提取及纯化试剂盒购于博大泰克生物基因技术有限公司。PCR扩增引物及 DNA测序由上海英骏生物技术有限公司完成。IPTG、卡那霉素为鼎国生物技术有限公司产品。固相化金属亲合层析(Immobilized metal-affinity chromatography,IMAC) 柱购自上海 Bio-Rad公司。二硫苏糖醇(DTT) 和碘乙酰胺为 Sigma公司产品,甲酸(FA) 购自美国TEDIA公司,胰蛋白酶 (Trypsin)购自美国 (Promega) 公司,乙腈为色谱纯(Honeywell)。其他试剂均为国产分析纯。其他试剂均为分析纯。
1.1.3 NanoLC-MS/MS分析仪器
Tempo nano MDLC色谱系统、质谱仪 (4000 QTRAP LC-MS/MS) 美国Applied Biosysterms公司;C18反相分析柱,MICHROM Magic C18 5 μm 100Å 0.075 mm×150 mm美国MICHROM公司。
1.2 方法
1.2.1 表达载体pET28a-PSMB1的构建
根据 GenBank中 PSMB1基因的编码序列(Accession No. NM_002793. 3)及表达载体pET28a (+) 的多克隆酶切位点,设计特异性引物:上游:5'–CGGAATTC ATGTTGTCCTCTAC AGCCATGTATTC-3' (下划线为 EcoR Ⅰ酶切位点)。下游:5'–CCCTCGAG CGTCCTTCCTTAA GGAAACAGTTTCCT-3' (下划线为 Xho Ⅰ酶切位点)。以PSMB1 cDNA (全长726 bp) 为模板,扩增出目的基因。PCR反应程序为:94 ℃预变性2 min;94 ℃ 30s,58 ℃ 30s,72 ℃ 1 min,30个循环;72 ℃延伸5 min。胶回收纯化的PCR产物采用EcoR Ⅰ、Xho Ⅰ双酶切,再经过电泳回收纯化后与经过同样处理的pET28a (+) 连接,连接产物转化大肠杆菌DH5α感受态细胞,利用卡那霉素抗性筛选阳性克隆,挑选单菌落,小提质粒后经PCR及双酶切分析验证后,进行DNA测序鉴定。
1.2.2 重组蛋白的可溶性表达
将构建成功的重组质粒 pET28a-PSMB1转化感受态的大肠杆菌BL21 (DE3),挑选单菌落,接种于5 mL LB/Km (50 μg/mL) 液体培养基,1∶100扩大培养至OD600约0.8左右,加入终浓度1.0 mmol/L IPTG诱导培养 (20 ℃),每隔1 h分别取样,6 h后剩余菌体过夜诱导。次日,离心收集菌体,进行SDS-PAGE分析。其中以不加诱导剂的菌体为对照。
1.2.3 目的蛋白的纯化及NanoLC-MS/MS分析
诱导表达的菌体经离心收集后,将沉淀重悬于预冷的裂解缓冲液 (300 mmol/L KCl,50 mmol/L KH2PO4,5 mmol/L咪唑,pH 8.0),超声破碎,12 000 r/min离心30 min后收集上清,经0.45 μm膜过滤后用Profinity IMAC柱纯化。亲合柱先用结合缓冲液平衡 10个柱体积,上样流速为1 mL/min,然后依次用含10 mmol/L、30 mmol/L咪唑的洗涤缓冲液洗去柱子上非特异性结合的蛋白,脱盐缓冲液 (137 mmol/L NaCl,2.7 mmol/L KCl,4.3 mmol/L Na2HPO4,8.1 mmol/L KH2PO4,pH 7.4) 脱盐,最后用含250 mmol/L 咪唑的洗脱缓冲液洗脱目的蛋白。依次收集穿透液 (A)、洗杂液 (B)、洗杂液 (C)、洗脱液 (D),纯化的蛋白经超滤浓缩后以Bradford测定蛋白含量,得到最终的目的蛋白。12% SDS-PAGE分析目的蛋白。
1.2.4 NanoLC-MS/MS 分析
切取胶内目标蛋白条带,用含 30%乙腈/ 100 mmol/L (NH4)2CO3脱色,真空干燥脱水。将新配制的含100 mmol/L DTT的100 mmol/L碳酸氢铵溶液加入脱色干燥后的胶片管内,使胶片水化。56 ℃水浴,还原l h,弃去DTT溶液,加入乙腈放置5 min吸去,真空干燥15 min。加入100 μL 55 mmol/L碘乙酰胺的100 mmol/L碳酸氢铵溶液,烷基化半胱氨酸残基上的巯基。室温暗室中放置l h,弃去上清液,重复上述步骤。在完全脱水的胶片中加入 10 ng/μL胰蛋白酶液适量,4 ℃放置30 min使酶液完全吸收,再补加25 mmol/L碳酸氢铵缓冲液适量,37 ℃孵育过夜。加入100 μL 60%乙腈/0.1 FA,超声提取15 min,吸取上清液,反复3次,合并3次提取液,真空浓缩至干。
采用API 4000 Qtrap 串联四极杆-线性离子阱质谱仪与在线Tempo nano MDLC色谱系统相连,样品以 5 μL/min的流速进样,300 nL/min流速冲洗脱盐。流动相A液:98%水,2%乙腈,0.1%甲酸;流动相B液:2%水,98%乙腈,0.1%甲酸。液动相洗脱梯度:5% 2 min,5%~ 10% 6 min,10%~30% 42 min,30%~50% 10 min,50%~95% 15 min,95% 20 min,95%~5% 5 min,5% 5 min。MS选用 IDA (Information dependent aequisition) 阳离子模式,仪器参数设置如下:Curtain gas (20),Ionspray voltage (2 300 V),Ion source gas (30),Interface heater temperature (150 ℃),Collision gas (High),Declustering potential (80),Entrance potential (10) and Collision cell exit potential (15)。第1级四极杆和第3级四极杆扫描分辨率设置为“unit”;选择目标离子传输窗口为0.7 Da;每对离子对处理时间为50 ms。
1.2.5 BIAcore分析重组 PSMB1与雷公藤红素的结合活性
BIAcore技术是基于一种表面等离子共振(Surface plasmon resonance,SPR) 的物理光学现象的生物传感器分析技术,它利用全反射时入射光可以和金属表面的等离子发生共振的原理,探测生物分子之间是否发生作用以及反应的动力学参数。在研究两分子的相互作用时,将一种分子固定在传感器表面,而另一种分子的溶液流过其表面,两种分子的结合会使传感器表面的折射率改变,从而检测两分子间的相互作用。
本研究通过氨基偶联方法将PMSB1偶联到CM5芯片的FC4通道上。HBS-EP作为工作缓冲液,PMSB1用10 mmol/L NaAC (pH 4.13) 1∶15稀释。芯片表面用0.2 mol/L EDC (活化剂) 和 50 mmol/L NHS (活化剂) 1∶1混合以10 μL/min的流速进样7 min,然后注射受体溶液,以1 mol/L乙醇胺 (pH 8.5),进样7 min,封闭活化的芯片表面。用HBS-EP缓冲液稀释待测配体浓度为1 µmol/L和10 µmol/L,离心后自动进样,检测不同浓度配体与受体的结合活性。对有结合活性的配体进行详细的动力学实验。
2 结果
2.1 PSMB1基因的PCR扩增
PCR扩增PSMB1 cDNA,琼脂糖凝胶电泳可见一条大小约为726 bp的DNA条带,与预期结果一致 (图1)。
2.2 表达载体pET28a-PSMB1的构建及鉴定
成功构建重组表达质粒pET28a-PSMB1,经EcoR Ⅰ、Xho Ⅰ双酶切后,琼脂糖凝胶电泳分析可见约726 bp和5 369 bp两条带,与预期结果相符 (图2)。
2.3 重组蛋白PSMB1的诱导表达
pET28a-PSMB1转化宿主菌 BL21 (DE3),IPTG诱导后,经12% SDS-PAGE分析可见一条分子量约为27 kDa的明显的新增表达条带。根据表达条带的浓度变化趋势选择过夜诱导为最佳培养时间 (图3)。
2.4 表达蛋白的纯化
重组蛋白利用IMAC柱亲和纯化,依次用不同浓度的咪唑洗脱,分别收集穿透液 (A)、洗杂液 (B)、洗杂液 (C)、洗脱液 (D) 进行 SDSPAGE分析。在上清与洗脱液洗脱后的回收液中均发现目标蛋白,大小约为27 kDa,与预期结果吻合。纯化后的蛋白经超滤离心后,Bradford测定蛋白含量为3.5 g/L。上样20 μg,几乎无杂带,蛋白纯度大于95% (图4)。
2.5 NanoLC-MS/MS分析PSMB1重组蛋白
从SDS-PAGE胶上切取PSMB1融合蛋白片段,胶内酶解后,进入NanoLC-MS/MS质谱分析,实验获得的MS/MS数据由ProteinPilot™3.0软件数据库进行自动处理,蛋白鉴定置信度设置为95%,共检测到34个肽段。如表1所示。表明所表达的蛋白即为PSMB1融合蛋白。
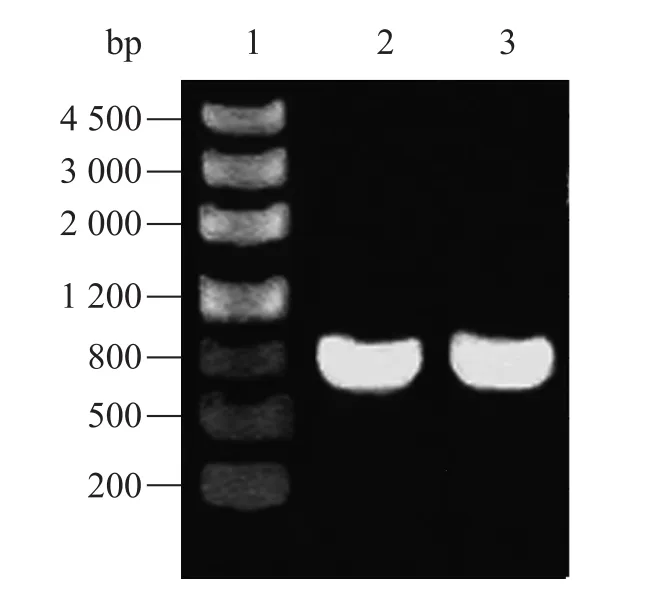
图1 PCR产物的琼脂糖凝胶电泳图Fig. 1 Agarose gel electrophoresis of PCR products. 1: DNA marker (Marker Ⅲ); 2: PCR product of PSMB1.
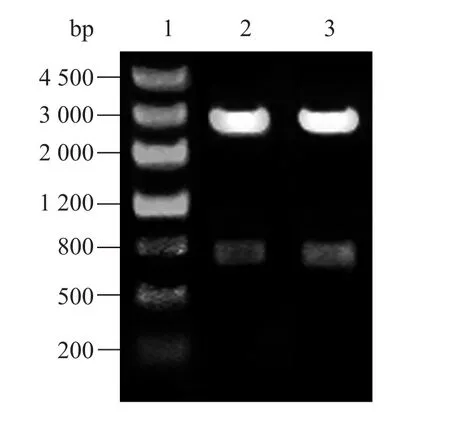
图2 重组质粒pET28a-PSMB1酶切鉴定Fig. 2 Identification of recombinant plasmid pET28a-PSMB1 by enzyme digestion. 1: marker III; 2–3: pET28a-PSMB1 digested with EcoR I and Xho I.

图3 PSMB1的诱导表达Fig. 3 Induced expression of PSMB1. 1,10: marker; 2: total protein before induction; 3–9: total protein in 1−6 hours after induction; 10: total protein overnight induction.
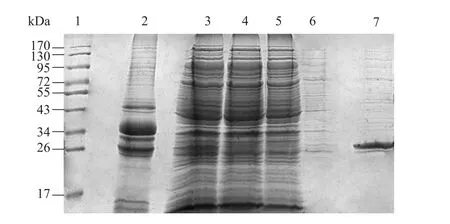
图4 PSMB1重组蛋白的纯化Fig. 4 Purification of PSMB1 recombinant protein. 1: marker; 2: precipitate of cell lysate; 3: culture supernatant; 4: flowthrough (A); 5: wash (B); 6: wash (C); 7: concentrated purification protein (D).
图5是表 1中序列为 DVFISAAER DVYTGDALR (MH2+=999.39) 的MS/MS分析结果。
2.6 重组蛋白PSMB1与雷公藤红素的体外结合
BIAcore初筛结果显示,不同的化合物 (配体) 与受体PSMB1的结合能力各不相同,结果见表2。
其中,雷公藤红素 (Celastrol) 与受体PSMB1最强,响应值达27RU,且表现出浓度依赖性。不同浓度的雷公藤红素 (0、2.40、3.43、4.90、7.0、10.0 µmol/L) 与PSMB1之间的相互作用如图6所示。图中从上到下的曲线依次是浓度由高到低的雷公藤红素在PSMB1表面流过的响应值。用 Biacore3000分析软件中的 1∶1 Langmuir结合模型对图6的曲线进行拟合,得到ka(1/Ms) 值为 15.7,kd(1/s) 值为 0.0142,KD(μmol/L) 为903,Chi2为1.09。
表1 重组PSMB1蛋白NanoLC-MS/MS鉴定结果Table 1 Identification of PSMB1 recombinant protein by NanoLC-MS/MS

表1 重组PSMB1蛋白NanoLC-MS/MS鉴定结果Table 1 Identification of PSMB1 recombinant protein by NanoLC-MS/MS
Number Sequence Score 1AGGSASAMLQPLLDNQVGFK 20 2AMTTGAIAAMLSTILYSR 24 3DVFISAAERDVYTGDALR 14 4GAVYSFDPVGSYQR 19 5KNMQNVEHVPLSLDR 19 6LTDKTVIGCSGFHGDCLTLTK 16 7LVKDVFISAAER 17 8MYKHSNNKAMTTGAIAAMLSTILYSR 18 9RFFPYYVYNIIGGLDEEGKG 19 10TVIGCSGFHGDCLTLTK 18 11DVFISAAER 12 12EGIREETVSLR 13 13EGIREETVSLRK 12 14FISAAERDVYTGDALR 13 15PLLDNQVGFK 12 16FFPYYVYNIIGGLDEEGK 12 17TTGAIAAMLSTILYSR 13 18SLDRAMRLVKDVFISAAER 13 19LKMYKHSNNKAMTTGAIAAMLSTILYSR 13 20RFFPYYVYNIIGGLDEEGKGAVYSFDPVGSYQR 13 21AMLSTILYSRRFFPYYVYNIIGGLDEEGK 12 22DVFISAAERDVYTGDALR 12 23FSPYVFNGGTILAIAGEDFAIVASDTR 19 24KNMQNVEHVPLSLDR 15 25NMQNVEHVPLSLDR 19 26RFFPYYVYNIIGGLDEEGK 18 27KHDKSASDALR 12 28KRQSPEPSPVTLGR 12 29DSLNSDCLTSFKITDLGK 12 30AENTRLNAELLK 12 31HSNNKAMTTGAIAAMLSTILYSR11 32NGFLLDGFPR 10 33SVPAAEPEYPK 10 34KEPKNLVWRDVSLGQTSRTPR 10

表2 不同配体与PSMB1的结合能力比较Table 2 The comparation of binding ability between different ligands and PSMB1
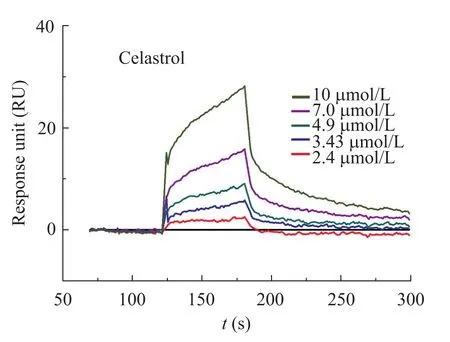
图6 celastrol与PSMB1结合的BIAcore分析Fig. 6 BIAcore analysis of interactions between celastrol and PSMB1.
3 讨论
本研究选取带有六聚组氨酸标签的 pET28a (+) 原核表达载体,实现了PSMB1在大肠杆菌BL21 (DE3) 内的可溶性表达。由于pET28a (+)载体N端带有His-tag标签,可以直接采用Ni+亲和层析实现重组蛋白的纯化,且组氨酸标签相对较小,对融合蛋白结构影响小,不需要从蛋白中切除。目的蛋白经IPTG诱导后以可溶性形式表达,再利用His亲和柱对PSMB1重组蛋白直接进行纯化,一步法纯化可达到 95%以上的纯度,可直接用于BIAcore分析,筛选潜在的具有蛋白酶体抑制剂活性的化合物。在本研究中,对重组PSMB1融合蛋白的氨基酸序列的鉴定采用的是 NanoLC-MS/MS方法,蛋白鉴定置信度设置为95%。该检测方法与常规的Western blotting等方法相比,检测快速、灵敏、准确,极大地提高了鉴定结果的可靠性。此外,蛋白酶体抑制剂筛选主要采用连续荧光监测法,通过测定蛋白酶体活性来寻找对蛋白酶活性影响的化合物,但该方法不能确证化合物是否与蛋白酶体发生结合,以及与哪个亚基结合。本研究中利用BIAcore直接检测蛋白酶体亚基与化合物小分子之间的相互作用,进而筛选特异性蛋白酶体抑制剂,无需借助任何标记物 (酶标或荧光底物) 也不需要对所研究蛋白质做任何修饰即可监测生物分子之间的相互作用[6]。BIAcore结果还可以提供关于结合反应的动态过程数据,且测量周期短,这些都是其他技术无法比拟的。
雷公藤红素 (Celastrol) 又名南蛇藤醇,是从雷公藤根部分离到的三萜类色素[7]。近年来因为其具有广谱的抗炎和抗氧化作用,被广泛地应用于哮喘、自身免疫性及神经性疾病的治疗[8-15]。雷公藤红素还可以抑制肿瘤细胞增殖并诱导其死亡[16-18]。有报道指出,雷公藤红素可以显著抑制大鼠20S中的β5催化亚基及PC-3、LNCaP细胞中的26S蛋白酶体活性[19],但其分子机制还不太清楚。本研究发现雷公藤红素可以作用于人20S蛋白酶体中的PSMB1催化亚基。这一发现为进一步深入研究雷公藤红素抑制蛋白酶体活性的分子机制提供了研究方向。
总之,本研究建立了重组表达、纯化人蛋白酶体亚基PSMB1的方法,并初步试用于体外筛选具有蛋白酶体抑制作用的化合物。本研究结果为建立快速、高通量的蛋白酶体抑制剂筛选平台奠定了基础,同时也有助于对已知的蛋白酶体抑制剂进行作用机制研究。
REFERENCES
[1] 顾光华, 孔祥. 泛素蛋白酶体通路以及蛋白酶抑制剂对NF-κB信号通路作用的研究进展. 实用临床医药杂志, 2009, 13(5): 114−116.
[2] Glickman MH, Ciechanover A. The ubiquitinproteasome proteolytic pathway: destruction for the sake of construction. Physiol Rev, 2002, 82(2): 373−428.
[3] Ciechanover A. Intracellular protein degradation: from a vague idea thru the lysosome and the ubiquitin–proteasome system and onto human diseases and drug targeting. Cell Death Differ, 2005, 12(9): 1178−1190.
[4] Smalle J, Vierstra RD. The ubiquitin 26S proteasome proteolytic pathway. Annu Rev Plant Biol, 2004, 55(1): 555−590.
[5] Adams J. The proteasome: a suitable antineoplastic target. Nat Rev Cancer, 2004, 4(5): 349−360.
[6] Deng HW, Guo Y, Sun Y, et al. A novel small molecule ligand for epidermal growth factor receptor targeting. Prog Biochem Biophys, 2005, 32(2): 180−186.邓宏伟, 郭妍, 孙烨, 等. 靶向表皮生长因子受体的全新小分子配体筛选. 生物化学与生物物理进展, 2005, 32(2): 180−186.
[7] 程薇, 马保根, 张茵, 等. 雷公藤红素抗肿瘤研究进展. 中国医药, 2008, 3(6): 383−384.
[8] Tao X, Younger J, Fan FZ, et al. Benefit of an extract of Tripterygium wilfordii Hook F in patients with rheumatoid arthritis: a double-blind, placebo-controlled study. Arthritis Rheum, 2002, 46(7): 1735−1743.
[9] Li H, Jia YF, Pan DJ, et al. Effect of tripterine on collagen-induced arthritis in rats. Acta Pharm Sin, 1997, 18(3): 270−273.
[10] Li H, Zhang YY, Huang XY, et al. Beneficial effect of tripterine on systemic lupus erythematosus induced by active chromatin in BALB/c mice. Eur J Pharmacol, 2005, 512(2/3): 231−237.
[11] Xu X, Wu Z, Xu C, et al. Observation on serum anti-double stranded DNA antibodies of tripterine in systemic lupus erythematosus of (NZB×W) F1 mice. Ann Rheum Dis, 2003, 62(4): 377−378.
[12] Liu RL, Liu ZL, Li Q, et al. The experimental study on the inhibitory effect of tripterine on airway inflammation in asthmatic mice. Chin J Tuberc Respir Dis, 2004, 27(3): 165−168.
[13] Pinna GF, Fiorucci M, Reimund JM, et al. Celastrol inhibits pro-inflammatory cytokine secretion in Crohn’s disease biopsies. Biochem Biophys Res Commun, 2004, 322(3): 778−786.
[14] Cleren C, Calingasan NY, Chen J, et al. Celastrol protects against MPTP- and 3-nitropropionic acid-induced neurotoxicity. J Neurochem, 2005, 94(4): 995−1004.
[15] Allision AC, Cacabelos R, Lombardi VRM, et al. Celastrol, a potent antioxidant and anti-inflammatory drug, as a possible treatment for Alzheimer’s disease. Prog Neuropsychopharmacol Biol Psychiatry, 2001, 25(7): 1341−1357.
[16] Chang FR, Hayashi K, Chen IH, et al. Antitumor agents. 228. Five new agarofurans, Reissantins A-E, and cytotoxic principles from Reissantia buchananii. J Nat Prod, 2003, 66(11): 1416−1420.
[17] Zhou YX, Huang YL, Xu QN, et al. Several monomes from Tripterygium wilfordii inhibit proliferation of glioma cells in vitro. Chin J Cancer, 2002, 21(10): 1106−1108.
[18] Nagase M, Oto J, Sugiyama S, et al. Apoptosis induction in HL-60 cells and inhibition of topoisomerase II by triterpene celastrol. Biosci Biotechnol Biochem, 2003, 67(9): 1883−1887.
[19] Yang HJ, Chen D, Cui QZC, et al. Celastrol, a triterpene extracted from the Chinese “Thunder of God Vine,”is a potent proteasome inhibitor and suppresses human prostate cancer growth in nude mice. Cancer Res, 2006, 66(9): 4758−4765.

