再生胰腺提取物诱导人羊膜间充质干细胞定向分化为胰岛素分泌细胞
张艳梅,王佃亮,曾虹燕,王烈明,孙晋伟,张珍,东莎莎
1 中国人民解放军第二炮兵总医院中心实验室,北京 100088
2 湘潭大学生物技术研究所,湖南 湘潭 411105
胰岛移植是一种有效治疗糖尿病的方法,但目前用于移植的胰岛主要是来源于尸体捐赠者,来源紧缺和免疫排斥反应严重阻碍了胰岛移植的推广应用,因此寻找可替代β细胞移植的细胞资源成为移植研究的必然趋势。干细胞因其具有自我复制和多向分化潜能成为替代细胞的最佳选择。胚胎干细胞虽然可以诱导分化为胰岛素分泌细胞,但因其伦理争议和形成畸胎瘤的危险而受到阻碍[1]。已有研究证明骨髓[2]、肝[3]、胰胆管[4]、脐带血[5]和皮肤[6]等来源的成体干细胞在体外可以成功诱导分化为胰岛样细胞。相对于以上诸多干细胞,hAMSCs具有取材方便,免疫原性低,增殖能力强和向3个胚层来源的组织细胞分化的潜能等优势[7-8],在细胞替代治疗领域显现出更为可观的前景。大鼠胰腺部分切除后具有胰腺再生功能,并且胰腺部分切除后的再生胰腺提取物具有激发糖尿病大鼠胰岛再生和血糖恢复的功能[9],而这种激发再生机制是否和干细胞的诱导机制有关?本课题组利用大鼠胰腺再生提取物对hAMSCs进行了诱导研究。
1 材料与方法
1.1 主要试剂
达氏修正依氏培养基 (DMEM) (Sigma);F12 (Sigma),胎牛血清 (Fetal Bovine Serum,FBS) (Gibico),胰蛋白酶 (Gibico),胶原酶Ⅱ和DNaseⅠ (Roche),重组人碱性成纤维细胞生长因子 (Recombinant human basic fibroblast growth factor,rhbFGF) (Sino),双硫腙 (Dithizone,DTZ) (Sigma),小鼠抗人胰岛素抗体 (Boster),FITC标记的羊抗小鼠IgG (Boster),凯基Super一步法RT-PCR试剂盒 (凯基生物),人胰岛素 (INS)试剂盒 (Invitrogen),SD大鼠 (军事医学科学院动物中心)。
1.2 hAMSCs的分离培养
细胞分离参考 Huo等的方法[10],并在此基础上改进:经产妇知情同意后于无菌条件下,取足月剖宫产胎盘 (HIV、梅毒等检测结果为阴性),钝性分离脐带近端羊膜组织,剪成6 cm× 6 cm大小的羊膜片,用含双抗的PBS缓冲液多次洗涤。本实验先将羊膜组织置于无菌培养皿中,细胞刮刀刮除未洗涤的血块和初步刮除羊膜上皮细胞,PBS冲洗,而后才将羊膜尽量剪碎,采用体积比为 1∶1的 0.25%胰酶和 0.02% EDTA 37 ℃消化60 min,过100目细胞筛网,收集羊膜碎皮,1 g/L胶原酶Ⅱ和0.1 g/L DNaseⅠ(体积比1∶1) 37 ℃消化60 min,过300目细胞筛网,收集过滤细胞液,1 000 r/min离心5 min,苔盼蓝染色计数,5×106个/mL接种细胞于25 cm2透气培养瓶,含10% FBS的DMEM/F12培养基、37 ℃、0.5% CO2培养箱培养,3 d首次换液,细胞90%铺满板底时,1∶2传代培养。实验的分离方法通过细胞刮刀辅助去除血块和羊膜上皮,利用EDTA辅助消化,节省了实验时间,提高了细胞的提取率和成活率,而且最后采用的细胞筛网是300目的可以充分去除未消化完全的细胞团或羊膜碎片组织,提高细胞的纯度,更方便细胞培养。
1.3 大鼠胰腺提取物的制备
生物诱导剂的提取是在Lee等[11]方法的基础上略有修改:将6~8周龄的SD大鼠腹腔麻醉,从胰尾端开始行60%胰腺切除手术,而后缝合伤口,正常喂养3 d后,断颈处死大鼠,提取剩余的胰腺组织,在加有1 μg/mL蛋白酶抑制剂的PBS缓冲液中研磨匀浆,以3 000 r/min和12 000 r/min,4 ℃分别离心10 min和20 min,收集上清液,0.22 μm针式过滤器过滤除菌,分装后,−80 ℃低温冰箱保存待用。
1.4 hAMSC的诱导分化
用12孔板培养第3代hAMSCs,当细胞铺满板底 60%左右时,向其中加入最终浓度为20 mg/L的RPE,3 d换液,定期观察诱导状况。
1.5 双硫腙染色
细胞培养15 d后,用PBS缓冲液洗涤细胞3次,而后,加入0.1 g/L的双硫腙染色液,37 ℃孵育30 min,倒置显微镜下观测染色结果。双硫腙染色液的配置参照侯萍等的方法[12]。
1.6 免疫荧光检测
PBS缓冲液洗涤诱导结束的细胞3次,用4%的多聚甲醛室温固定细胞20 min,PBS洗涤5 min/次×2次;1%牛血清蛋白封闭液室温封闭30 min,去除非特异性阳性;滴加一抗鼠抗人胰岛素抗体,4 ℃孵育过夜;移除一抗,PBS洗涤3次,5 min/次;滴加FITC荧光标记的二抗,室温孵育1 h,PBS洗涤3次,5 min/次;荧光显微镜下观测拍照。
1.7 RT-PCR检测
取诱导 15 d后的细胞,用 Trizol提取总RNA。然后通过RT-PCR方法检测以下基因的表达:insulin和Pdx1。该实验采用的是凯基Super一步法RT-PCR试剂盒,RT反应条件:42 ℃保温1 h。PCR扩增条件:94 ℃,5 min;94 ℃变性30 s,最适退火温度退火45 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。PCR产物经2%琼脂糖凝胶电泳分析并紫外成像系统拍照。引物序列及退火温度见表1。
1.8 诱导细胞的胰岛素分泌检测
将诱导成功的细胞和对照组细胞 (未经诱导的hAMSCs) PBS缓冲液洗涤3次,而后于加有 30 mmol/L的葡萄糖的 10% FBS的DMEM/F12培养基培养,于0 h、6 h、12 h、24 h、36 h、48 h各时间点取0.2 mL培养液上清,3 000 r/min低温离心10 min后取上清,于−80 ℃低温冰箱保存待一起测定胰岛素含量。胰岛素检测按照胰岛素检测试剂盒说明书严格操作。
2 结果
2.1 hAMSC的生长状况与特性
本实验分离hAMSCs时,结合使用细胞刮刀刮除上皮,降低酶作用时间和提高细胞存活率,分离获得的细胞量高达108个/mL。hAMSCs隔夜贴壁,5~7 d首次传代,P1代细胞培养中可见两种形态细胞的生长,一种梭形的hAMSCs,生长增殖迅速,一种鹅卵石状 (图1A单箭头所示)或煎鸡蛋状 (图 1A双箭头所示) 的羊膜上皮样细胞,贴壁牢固,增殖缓慢,不易消化。传至P3代,细胞形态均一,呈漩涡状生长,基本为纯的hAMSCs (图1B)。
2.2 诱导分化结果
RPE诱导的hAMSCs形态变化明显,诱导8 d后就可见细胞呈簇集落生长,诱导15 d后,细胞几乎分化融合为一团,呈小岛状生长 (图2)。
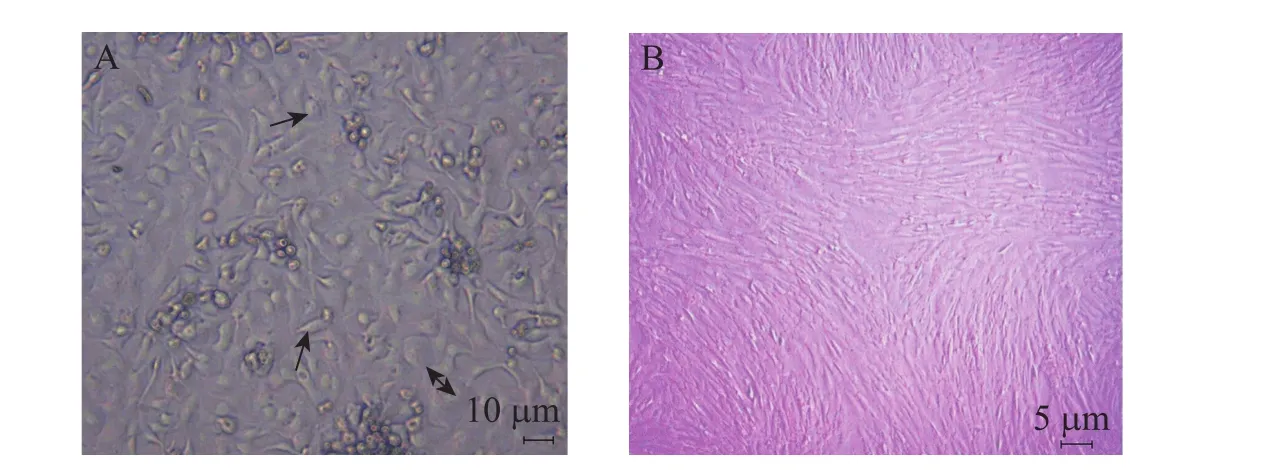
图1 hAMSC的形态Fig. 1 Morphology of hAMSCs. (A) Primary cells cultured for 7 d. Double-headed arrow showed the amniotic epithelial-like cells. Single-headed arrow indicated the egg-shaped elliptical cells. Round arrow showed the spindle cell. (B) The third passage hAMSC, uniform cell morphology, like some whirlpools.
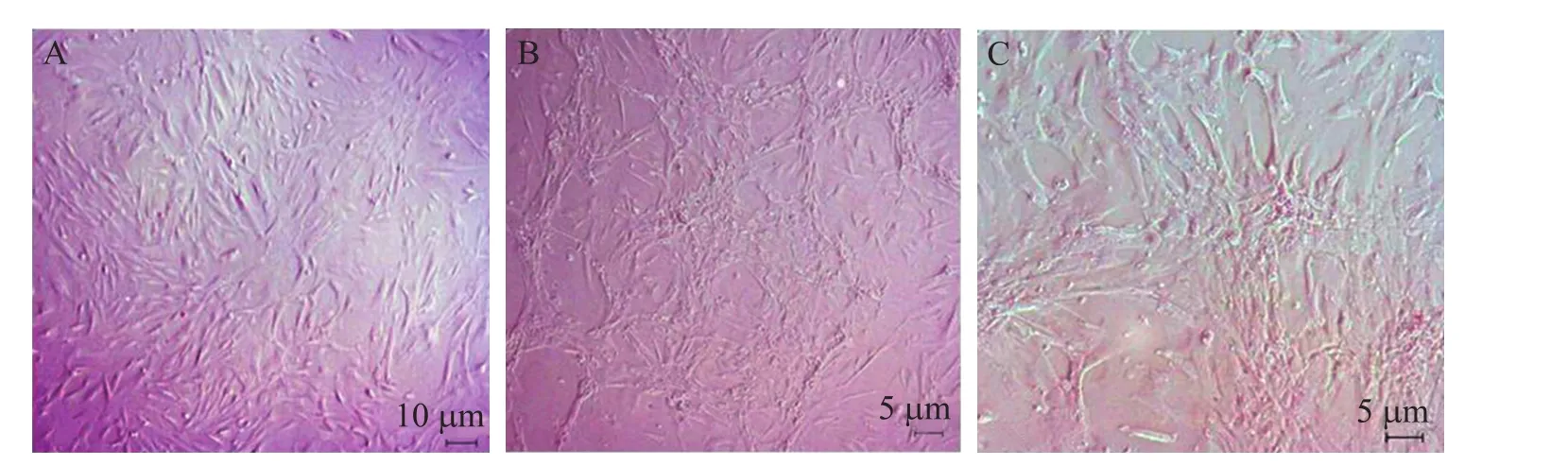
图2 hAMSC的诱导分化Fig. 2 Differentiation of hAMSCs. (A) Cells before RPE-treating. (B) Cells after RPE-treating for 8 days. (C) Cells after RPE-treating for 15 days, like some small islands.
2.3 双硫腙染色结果
胰岛β细胞含有高浓度锌,双硫腙是很强的螯合剂,能与β细胞中的锌结合呈现猩红色,故可以作为胰岛的染色剂。实验通过双硫腙来染色诱导后的细胞,在显微镜下观测可见猩红色团状细胞簇。对照组则无颜色显示 (图3)。
2.4 免疫荧光检测结果
通过细胞的免疫荧光法检测诱导干细胞是否如胰岛细胞具有胰岛素分泌功能,由图4A可见,诱导细胞呈胰岛素阳性表达,而非 RPE诱导组的胰岛素无表达 (图4B)。
2.5 RT-PCR检测结果
实验通过RT-PCR检测诱导细胞是否有胰岛细胞的相关基因表达,图5实验结果显示,诱导细胞不仅可以表达人胰岛素、胰高血糖素等基因的激活因子Pdx1,同时也表达人insulin,而在对照组未经诱导的hAMSCs中未见insulin和Pdx1的表达,这就从基因学角度证明了诱导后的细胞具有胰岛细胞的部分生物学特性。
2.6 诱导细胞胰岛素分泌情况
图6是经高糖刺激后,诱导细胞在不同时间点的胰岛素分泌情况,可见诱导细胞不仅可以分泌胰岛素,而且随着高糖刺激的时间的延长,分泌量增多,但增加到一定的程度,就会逐渐趋于稳定,而对照组非诱导 hAMSCs则无胰岛素分泌,对照组的非零数据值属于实验误差范围。
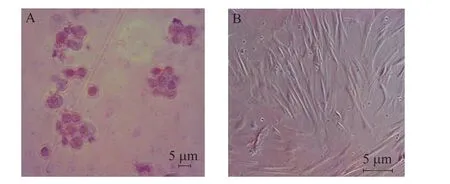
图3 双硫腙染色Fig. 3 Dithizone staining. (A) The induced hAMSCs were positive for dithizone staining. Cell clusters were stained scarlet. (B) Control cells without RPE induction.
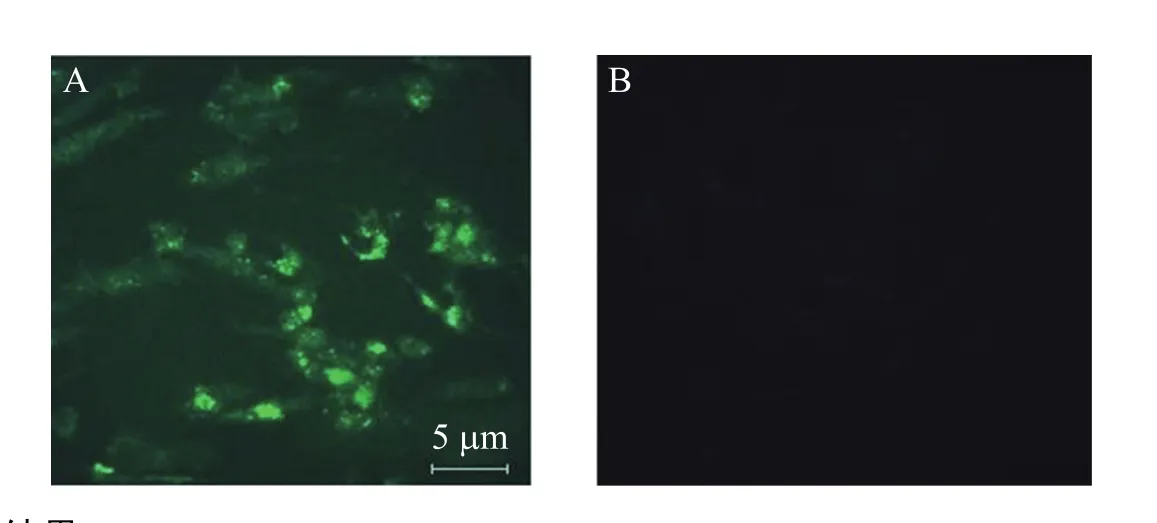
图4 胰岛素免疫荧光结果Fig. 4 Insulin immumofluorescence. (A) Induced hAMSCs. (B) hAMSC control. Immunofluorescence analysis revealed islet-like clusters differentiated from hAMSC were insulin-positive cells.
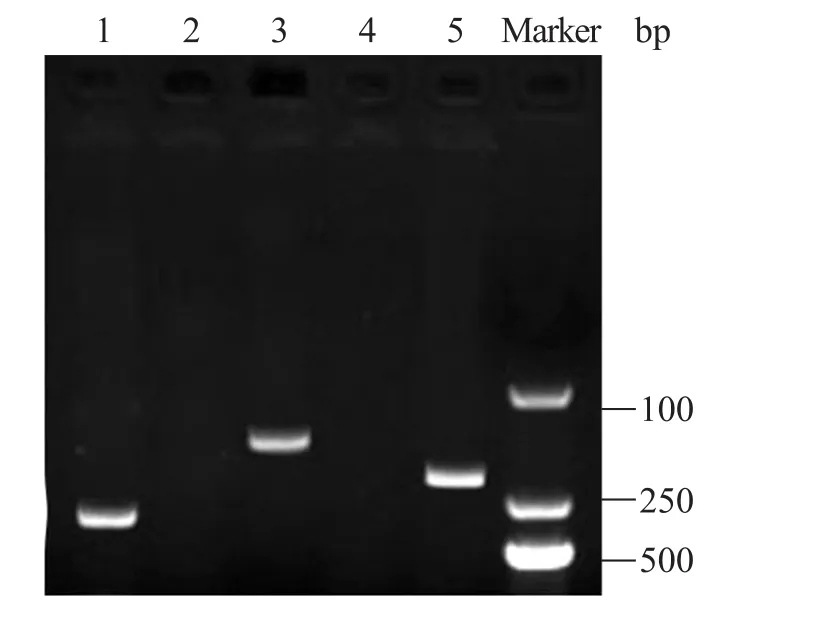
图5 诱导细胞的RT-PCR分析Fig. 5 RT-PCR analysis of induced cells. 1: Pdx 1; 2: control 1 (Pdx1 expression of hAMSCs without inducing); 3: insulin; 4: control 2 (insulin gene expression of hAMSCs without inducing); 5: β-action. Pdx1 and insulin were positive expression in induced cells, but negative in control hAMSC.
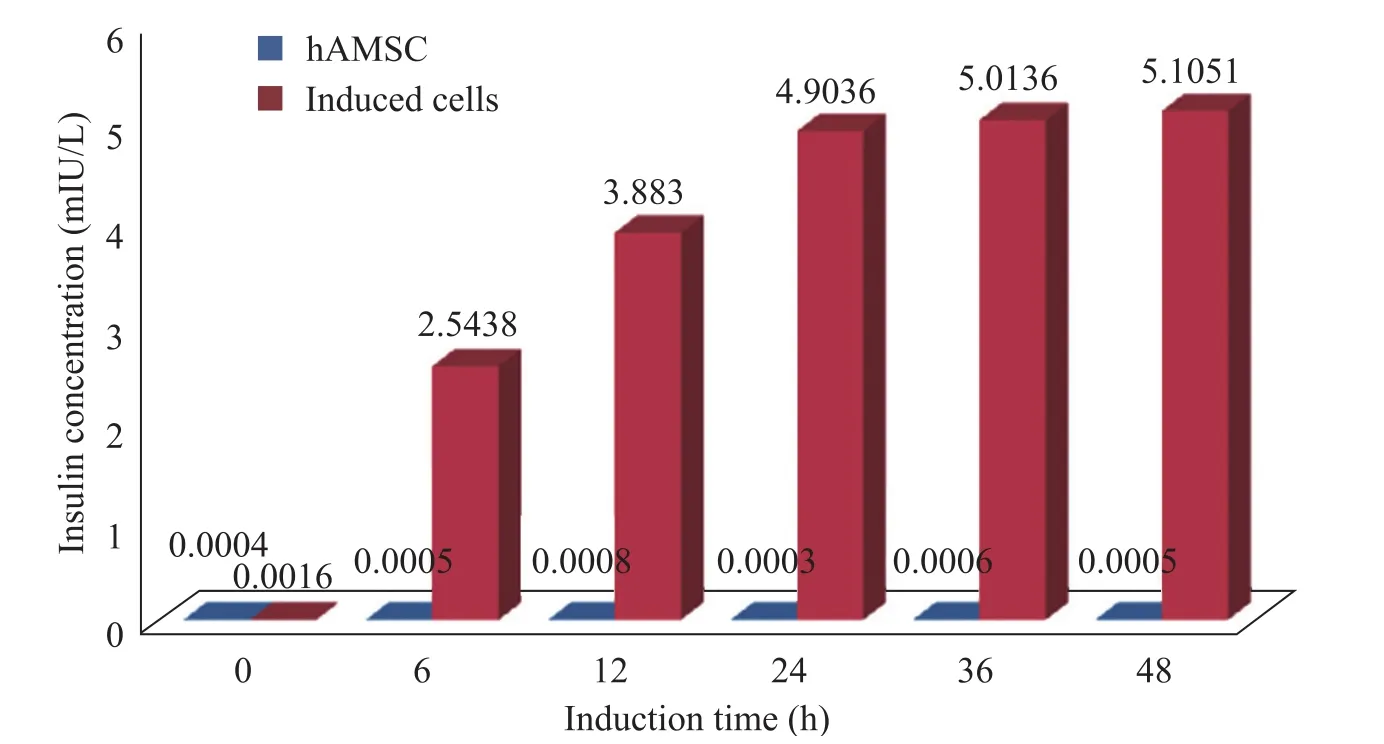
图6 高糖刺激后诱导细胞的胰岛素分泌情况Fig. 6 Insulin secretion of induced hAMSCs after high glucose stimulation. Induced hAMSCs had increased insulin secretion with the glucose-stimulating time. The control hAMSCs didn’t secret insulin.
3 讨论
近年来国内外对干细胞诱导分化为胰岛样细胞的研究较多,采用的干细胞主要有胚胎干细胞[13-14]和成体干细胞 (脐血来源干细胞、骨髓来源干细胞、胰腺干细胞、脂肪干细胞、肝来源干细胞和神经干细胞)[15-18],诱导方法总体上有一步诱导法、二步诱导法和三步诱导法,有的用到了五步法,使用的诱导剂也很多,包括角质化细胞生长因子、碱性成纤维细胞生长因子、肝细胞生长因子、activin-A,GLP-1、烟酰胺和 ITS介质 (I-胰岛素、T-转铁蛋白、s-硒) 等[19],虽然实验诱导出胰岛样细胞,但成本高、耗时长,诱导率低。
本实验采用的是胎盘来源的人羊膜间充质干细胞,具有来源广泛、增殖能力强、免疫原性低和造血支持等优势[8],但目前尚未报道其体外向胰岛样细胞诱导的研究。采用的诱导剂是异种来源的再生胰腺提取物,属于天然生物诱导剂,成分更接近于机体微环境中成分,而且制取方便,成本低且诱导步骤简便,诱导率较高。Lee等[11]和Choi等[20]都利用RPE分别将脂肪干细胞和骨髓间充质干细胞成功诱导为具有胰岛表型的细胞。本实验采取的是第3代hAMSCs细胞,诱导15 d后就明显可见类胰岛样细胞团,经双硫腙染色后初步断定其具有胰岛细胞的特性。Pdx1和 insulin的阳性表达从基因学的角度证明了诱导的成功,而胰岛素分泌检测是从细胞功能的角度证明了hAMSCs的成功诱导。可见再生胰腺提取物不仅具有促进胰腺再生的功能,而且具有调控和促进不同种属的干细胞向胰岛分泌细胞分化的功能。
本研究表明异种来源的胰腺再生提取物可以诱导hAMSCs分化为胰岛素分泌细胞,为糖尿病细胞替代治疗提供了新的细胞来源和新的干细胞诱导技术方案。至于诱导成功的胰岛素分泌细胞是否在体内发挥正常作用,及是否具有其他致畸等副作用,还有待进一步研究。
REFERENCES
[1] Amour KA, Bang AG, Eliazer S, et al. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells. Nat Biotechnol, 2006, 24(11): 1392−1401.
[2] Li Y, Zhang R, Qiao H, et al. Generation of insulin-producing cells from PDX-1 gene-modified human mesenchymal stem cells. J Cell Physiol, 2007, 211(1): 36−44.
[3] Yang LJ, Li SW, Hatch H, et al. In vitro trans-differentiation of adult hepatic stem cells into pancreatic endocrine hormone-producing cells. Proc Natl Acad Sci USA, 2002, 99(12): 8078−8083.
[4] Ramiya VK, Maraist M, Arfors KE, et al. Reversal of insulin-dependent diabetes using islets generated in vitro from pancreatic stem cells. Nat Med, 2000, 6(3): 278−282.
[5] Sun B, Roh KH, Lee SR, et al. Induction of human umbilical cord blood-derived stem cells with embryonic stem cell phenotypes into insulin producing islet-like structure. Biochem Biophys Res Commun, 2007, 354(4): 919−923.
[6] Yang JH, Lee SH, Heo YT, et al. Generation of insulin-producing cells from gnotobiotic porcine skin-derived stem cells. Biochem Biophys Res Commun, 2010, 397(4): 679−684.
[7] Parolini O, Caruso M. Preclinical studies on placenta-derived cells and amniotic membrane: an update. Placenta, 2011, 32(S2): S186−S195.
[8] Manuelpillai U, Moodley Y, Borlongan CV, et al. Amniotic membrane and amniotic cells: potential therapeutic tools to combat tissue inflammation and fibrosis? Placenta, 2011, 32(S4): S320−S305.
[9] Hardikar AA, Bhonde RR. Modulating experimental diabetes by treatment with cytosolic extract from the regenerating pancreas. Diabetes Res Clin Pract, 1999, 46(3): 203−211.
[10] Huo SZ, Shi P, Pang XN. Culture and identification of human amniotic mesenchymal stem cells. Chin Med Sci J, 2010, 25(4): 211−214.
[11] Lee J, Han DJ, Kim SC. In vitro differentiation of human adipose tissue-derived stem cells into cells with pancreatic phenotype by regenerating pancreas extract. Biochem Biophys Res Commun, 2008, 375(4): 547−551.
[12] Hou P, Zhao DY, Li GF, et al. Differentiation of human umbilical cord blood stem cells into islet-like cells following in vitro induction of various cytokine combination. J Clin Reh Tiss Eng Res, 2009, 13(6): 1073−1076.侯萍, 赵东阳, 李革飞, 等. 不同细胞因子组合体外诱导人脐血干细胞向胰岛样细胞分化. 中国组织工程研究与临床康复, 2009, 13(6): 1073−1076.
[13] Ibii T, Shimada H, Miura S, et al. Possibility of insulin-producing cells derived from mouse embryonic stem cells for diabetes treatment. J Biosc Bioeng, 2007, 103(2): 140−146.
[14] Docherty K, Bernardo AS, Vallier L. Embryonic stem cell therapy for diabetes mellitus. Semin Cell Dev Biol, 2007, 18(6): 827−838.
[15] Jones PM, Courtney ML, Burns CJ, et al. Cell-based treatments for diabetes. Drug Discovery Today, 2008, 13(19/20): 888−893.
[16] Limbert C, Päth G, Jakob F, et al. Beta-cell replacement and regeneration: strategies of cell-based therapy for type 1 diabetes mellitus. Diabetes Res Clin Pract, 2008, 79(3): 389−399.
[17] Burke ZD, Thowfeequ S, Peran M, et al. Stem cells in the adult pancreas and liver. Biochem J, 2007, 404(2): 169−178.
[18] Efrat S. Beta-cell replacement for insulin-dependent diabetes mellitus. Adv Drug Deliv Rev, 2008, 60(2): 114−123.
[19] Xie T, Ouyang J. Research progress in the differentiation of stem cells into islet-producing cells. J Clin Rehab Tiss Eng Res, 2008, 12(25): 4931−4934.谢婷, 欧阳建. 干细胞诱导分化为胰岛素分泌细胞的研究与进展. 中国组织工程研究与临床康, 2008, 12(25): 4931−4934.
[20] Choi KS, Shin JS, Lee JJ, et al. In vitro trans-differentiation of rat mesenchymal cells into insulin-producing cells by rat pancreatic extract. Biochem Biophys Res Commun, 2005, 330(4): 1299−1305.

