三种大豆分离蛋白的比较研究和物化特性相关性分析
范 媛,马永强,袁美玲,李 丹
(1.哈尔滨米旗食品有限公司,哈尔滨 150060;2.哈尔滨商业大学食品工程学院,哈尔滨 150076;3.黑龙江省普通高等学校食品科学与工程重点实验室,哈尔滨 150076)
大豆分离蛋白(soybean protein isolate,SPI)是以低温脱溶大豆粕为原料生产的一种全价大豆蛋白,其蛋白质含量在90%以上,是植物蛋白中为数不多的可替代动物蛋白的品种之一。大豆分离蛋白除具有营养价值外,还具有许多重要的功能特性,如凝胶性、溶解性、乳化性、乳化稳定性、粘性等,这些特性可有效地改善食品的口感,增加食品的弹性、保水性、吸油性,提高贮存性等[1]。大豆分离蛋白组成和结构是决定其功能性的重要因素,近几十年来备受国内外研究者的关注[2]。相关研究与工业化实践的资料都显示,不同生产企业的大豆分离蛋白在功能特性方面具有显著差异,而这些差异主要是由于加工工艺条件的差异导致的[3]。
本研究选取了不同生产企业的大豆分离蛋白样品,通过对其基本化学组成、表面基团和功能性的研究,了解前2方面因素对功能性的影响,以期为进一步探讨上述影响奠定理论基础。
1 实验材料与方法
1.1 实验材料
1.1.1 实验原料 3种大豆分离蛋白样品分别由吉林省、黑龙江省和山东省的大豆蛋白生产企业提供。
1.1.2 实验仪器 TGL-16G-B型台式高速离心机:湖南星科科学仪器有限公司;722E型可见分光光度计:上海光谱仪器有限公司;DZF-6020真空干燥箱:上海一恒科技有限公司;NDJ-8S型数显粘度计:上海精密科学仪器有限公司;202型电热恒温干燥箱:余姚市东方电工仪器厂;KDN-F自动定氮仪:上海纤检仪器有限公司;FSH-2可调高速匀浆机:常州国华电器有限公司;TA-XT2i质构仪:英国Stable Micro Systems Ltd公司。
1.1.3 试剂 硫酸铜、硫酸钾、氢氧化钠、甲基红、亚甲基蓝、十二烷基磺酸钠、尿素、亚硫酸钠等均为分析纯。
1.2 实验方法
1.2.1 原料的基本组成分析
(1)水分测定 水分含量测定采用直接干燥法。
(2)灰分测定 灰分测定采用干法灰化法。
(3)蛋白质测定 采用凯氏定氮法。
(4)粗脂肪测定 采用索氏提取法。
1.2.2 蛋白表面基团的测定
(1)蛋白表面巯基的测定 采用分光光度法测定[4]。
①溶液配制方法:
缓冲液A:8mol/L尿素,3mmol/L EDTA,l%SDS和0.2mol/L Tris-HC1(pH8.0);
缓冲液B:10mmol/L DTNB,0.2mol/L Tris-HC1(pH8.0);
缓冲液C:8mol/L尿素,3mmol/L EDTA,1%SDS,0.1mol/L Na2SO3,10mL/L NTSB和0.2mol/L Tris-HC1(pH9.5);
缓冲液D:8mol/L尿素,3mmol/L EDTA,1%SDS,0.1mol/L Na2SO3,0.2mol/L Tris-HC1(pH 8.0);
NTSB的制备:100mg的Ellment试剂溶解到10mL 1mol/L的亚硫酸钠中,在38℃下通入氧气直到亮红色溶液变成淡黄色,就表明NTSB已经生成。
②测定方法:直接用缓冲液A 20mL溶解0.100g大豆粉(1#),缓冲液D 20mL溶解0.100g大豆粉(2#),振荡并使其全溶。用缓冲液A 20mL溶解一份处理过的豆浆(1#),缓冲液D 20mL溶解另一份处理过的豆浆(2#),震荡并使其全溶。取1#溶液于纸型管中,分别测3次后取平均,在纸型管中分别加入0.1mL的缓冲液B,震荡30min后加缓冲液A稀释至3mL再测吸光度。以加缓冲液B而不加样品为空白。取2#溶液于纸型管中,分别测3次,在纸型管中加入相同量的缓冲液C振荡30min后加缓冲液D稀释至3mL再测吸光度。以加缓冲液C而不加样品为空白。
计算公式如下:
SH(μmol/g)=A412nm×D×10-6/C×V×13600
A412nm——吸光度;
D——稀释倍数(对游离SH,D=(3/所取样品溶液体积)×20;对总巯基,D=(3/所取样品体积)×20);
C——豆浆固形物含量,5mg/mL;
V——所取豆浆或牛奶的体积mL;
SS(μmol/g)=(总巯基含量-游离巯基含量)/2。
(2)表面疏水性的测定 采用SDS结合法测定蛋白质表面疏水性。
①用尿素对大豆分离蛋白进行改性,对改性SPI进行冷冻干燥,研磨,过100目筛,测其表面疏水性。
改性方法:室温配制8mol/L的尿素溶液。将SPI以1g 1003d110mL的比例加入到尿素溶液中,室温搅拌4h后冷冻干燥,制得常温尿素变性大豆分离蛋白[5]。
②测定方法:取改性大豆分离蛋白,溶解于SDS溶液中,静置30min,在pH为8的磷酸缓冲液中透析24h后取0.5mL透析液,加入10mL CHCl3,混匀后在CHCl3层中加入0.0024%的亚甲基蓝溶液,充分混合,2500r/min离心15min,取底层SDS与亚甲基蓝混合物,于波长655nm处测其吸光度[6]。
③标准曲线制作:已知含量的SDS按上述测定方法测其吸光度,用1mg蛋白质结合的SDS的微克数来表示蛋白质的疏水性。
1.2.3 大豆分离蛋白物化特性的测定
(1)测定大豆蛋白质溶液粘度 将25g SPI样品分散到500mL蒸馏水中,分散均匀后,静置1h,再搅拌2min,80℃水浴60min,冷却至25℃,再次搅拌2min,立即用旋转粘度计测定粘度。将旋转粘度计安装于固定支架上,校准水平,用直径不小于70mm的直筒式烧杯盛装样液,并保持样液恒温,根据估计的被测样液的最大粘度值选择适当的转子及转速,装好转子,调整仪器高度,使转子浸入样液直至液面达到标志处为止。接通电源,使转子在样液中旋转,经多次旋转后指针趋于稳定时或按规定的旋转时间指针达到恒定值时,压下操纵杆,同时中断电源,读取指针所指示的数值。如读数值过高或过低,应改变转速或转子,以使读数在20~90之间,选择4号转子,0.6转/min。
(2)乳化性与乳化稳定性 在0.05mol/L pH7.0磷酸钠缓冲液中配置1%的大豆分离蛋白溶液,加入大豆油(0.25L/L),均质(10000r/min×10s)2次,形成均一的乳化液。均质后,分别在0min和10min取1mL新制备的乳化液,用蒸馏水稀释100倍,然后再取1mL被稀释的乳化液,用0.1%SDS稀释10倍,将最后溶液在500nm下进行吸光值测定[7]。
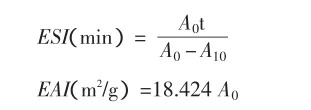
A0——均质后0min时被稀释的乳化液的吸光值;
A10——均质后10min时被稀释的乳化液的吸光值;
t——时间(10min)。
(3)大豆分离蛋白凝胶性质分析
①凝胶的制备:将蛋白质溶于去离子水中,浓度为12%(w/v), 搅拌均匀, 用分散器(Ultra-TURRAXT25)分散1min(12500r/min),均质20MPa,将此蛋白质溶液装于100mL的烧杯中,盖以铝箔,将此烧杯置于90℃的水浴中加热保温30min,然后用冰浴冷却至室温,在4℃的冰箱中保存24h,从冰箱中取出立即测定其凝胶强度[8]。
②凝胶强度的测定:选用TA.XT2物性仪进行测定,物性仪主要参数设定如下[9]:
运行模式:TPA

数据采集速率:200pps
探头:10mm圆柱型(P/0.5)
1.2.4 物化特性与蛋白组成及表面基团的相关性分析 采用SPSS11.0软件进行线性回归分析。
2 数据分析与讨论
2.1 原料的基本组成分析
大豆分离蛋白基本组成分析见表1。
2.2 蛋白表面基团的测定
不同大豆分离蛋白巯基、二硫键含量及疏水性见表2。
计算公式如下:
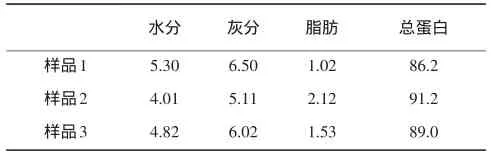
表1 大豆分离蛋白基本组成分析 %
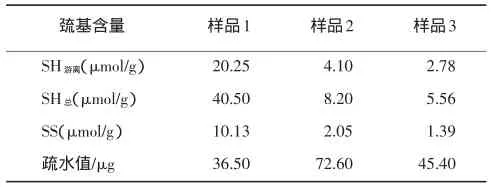
表2 不同大豆分离蛋白巯基、二硫键含量及疏水性
2.3 大豆分离蛋白物化特性的测定
2.3.1 大豆分离蛋白粘度测定 相关数据见表3。
2.3.2 大豆分离蛋白乳化性及乳化稳定性测定 相关数据见表4。

表3 不同大豆分离蛋白的粘度值
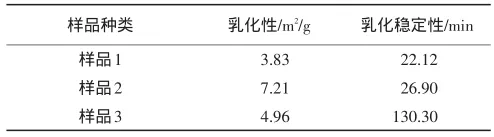
表4 不同大豆分离蛋白的乳化性与乳化稳定性
2.3.3 大豆分离蛋白凝胶强度测定 测定结果见附图,相关数据见表5。
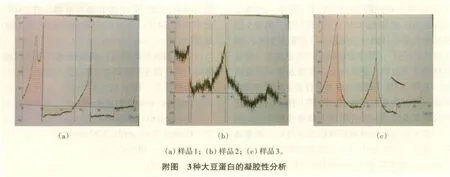
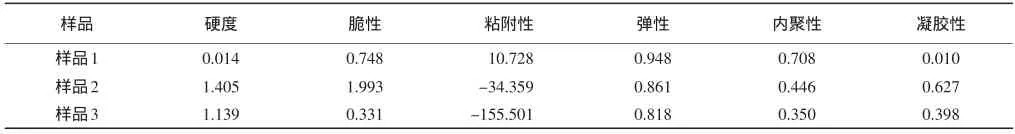
表5 凝胶性质测定数据
2.4 数据相关性分析
根据SPSS软件分析显示:
(1)建立粘度(Y)与各测定指标之间的相关性,得到线性回归方程为:
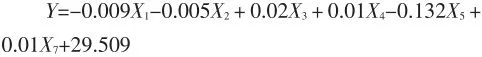
X1—水分;X2—灰分;X3—脂肪;X4—蛋白质含量;X5—游离巯基;X7—二硫键含量。
根据软件分析得出:粘度与蛋白质含量、二硫键含量、游离巯基含量具有显著的相关性。粘度与蛋白质含量之间具有正相关性,大豆分离蛋白的粘度随着蛋白质含量增加而增加。大豆分离蛋白的表观粘度随蛋白质浓度的增加呈指数型增加。这是因为大豆分离蛋白的主要成分是大豆球蛋白和伴球蛋白,而球蛋白的轴比近于1,要使分子排列平行于流动方向所需的能量远小于具有较高轴比的纤维状蛋白质。在后一种情况下,与流体流动方向垂直的某些分子的取向增加流动时的摩擦力。在较高浓度的蛋白质溶液中即有类似的效应发生。在这种情况下,一个分子周围流动模式的紊乱将会与另一个分子周围的流动模式紊乱发生相互作用或重叠,从而增加流动时的摩擦力。大豆分离蛋白粘度随浓度呈指数型增长的现象,是由上述效应引起的。
粘度与二硫键含量之间具有正相关性,粘度随二硫键含量增加而增强。二硫键含量增加导致分子间作用力加强,增加了分子间的摩擦力,导致粘度增加。
粘度与巯基含量之间具有负相关性,粘度随巯基含量的增加而降低。巯基含量增加、二硫键含量减少导致分子间作用力减弱,减小了分子间的摩擦力,导致粘度降低。
(2)建立乳化性与各测定指标之间的相关性,得到线性回归方程为:
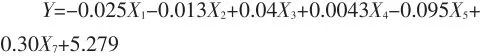
根据软件分析得出:乳化性与蛋白质含量具有显著的相关性。
乳化性与蛋白质含量之间具有正相关性,大豆分离蛋白的乳化性随着蛋白质含量增加而增强。蛋白质分子中由于同时含有亲水基团和亲油基团这种特征结构,因此具有乳化性,蛋白质含量高时亲水和亲油基团也随之增加,因此乳化性也随之增加。
(3)建立乳化稳定性与各测定指标之间的相关性,得到线性回归方程为:
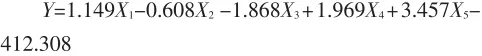
根据软件分析得出:乳化稳定性与各指标之间相关性均不显著。
(4)建立凝胶性与各测定指标之间的相关性,得到线性回归方程为:
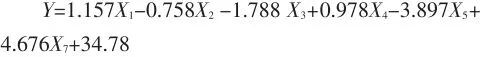
根据软件分析得出:凝胶性与蛋白质含量、二硫键含量、游离巯基含量具有显著的相关性。凝胶性与蛋白质含量之间具有正相关性,大豆分离蛋白的凝胶性随着蛋白质含量增加而增加。大豆蛋白质的浓度是凝胶能否形成的决定性因素之一。浓度为8.0%~16.0%的大豆蛋白质溶胶,经一定的加热过程,冷却后即可形成凝胶,浓度越高,凝胶强度越大。
凝胶性与二硫键之间具有正相关性,凝胶强度及性能随二硫键含量增加而增强。加热导致大豆分离蛋白变性分子形成,由大豆蛋白内的二硫键、氢键、疏水键作用使解链的肽链间重新交联成网络从而形成了凝胶网络结构。因此高含量的二硫键倾向于形成凝胶,从而导致凝胶性较好。
凝胶性与游离巯基含量之间具有负相关性,凝胶强度及性能随巯基含量增加而减弱。巯基含量高时,二硫键含量随之减少,导致肽链间重新交联减弱,从而使凝胶强度降低。
3 结论
由表面特性分析可知:3种大豆分离蛋白中的游离巯基和二硫键含量由多到少的顺序均为:样品1>样品2>样品3。样品2的疏水值高于样品1和样品3,说明处理后得到的样品2蛋白质表面疏水键暴露较多,疏水基含量较高,疏水性较强。通过SPSS软件分析可知:大豆分离蛋白中粘度与蛋白质含量、二硫键含量呈正相关、与巯基含量呈负相关;大豆分离蛋白的乳化性与蛋白质含量、粘度、蛋白质组成中7S组分含量呈正相关;大豆分离蛋白的凝胶性与蛋白含量、二硫键含量呈正相关,与巯基含量呈负相关。
[1]李玉珍,肖怀秋,兰立新.大豆分离蛋白功能特性及其在食品工业中的应用[J].中国食品添加剂,2008(1):121-125.
[2]谢良,王璋,蔡宝玉.大豆分离蛋白的组成与功能性质[J].中国粮油学报,2000(6):6-10.
[3]黄友如,华欲飞,裘爱泳.大豆分离蛋白功能性质及其影响因素[J].粮食与油脂,2003(5):12-15.
[4]李丽娜,李军生,阎柳娟.分光光度法测定食品蛋白质中二硫键的含量[J].食品科学,2008,29(8):562-564.
[5]游宗保,吴金建.阴离子表面活性剂测定方法的探讨[J].福建分析测试,2003,2(12):22-24.
[6]唐凯,俞稼镛.阴离子表面活性剂的测定方法——混合指示剂程序加入法[J].兰州大学学报,2000,36(4):61-65.
[7]郭兴凤,慕运动,阮诗丰.不同测定方法对大豆分离蛋白乳化性测定结果的影响[J].食品研究与开发,2007,28(2):129-131.
[8]郭兴凤,张艳红,陆惠,等.大豆分离蛋白凝胶制备和凝胶质构特性研究[J].中国粮油学报,2005,20(6):68-70,75.
[9]Zhang Lu,Sun Xiuzhi,SuSan.Effect of Sodium Bisulfite on Properties of Soybean Glycinin[J].Agriculture Food Chemistry,2008,56:11192-11197.

